用于肿瘤光热治疗的有机纳米材料研究进展  下载: 1621次特邀综述
下载: 1621次特邀综述
1 引言
激光光热治疗是近年来兴起的一种具有临床应用前景的无创/微创性癌症治疗方法,该方法采用对组织穿透力较强的近红外光(NIR)辐射肿瘤组织,利用光热转换使肿瘤组织温度升高,从而达到杀伤肿瘤细胞的目的[1-2]。由于肿瘤部位血管的不均质特性,肿瘤对42~45 ℃的高温比正常组织更加敏感[3-4]。此治疗方法最显著的特点是无创性或微创性,患者在治疗过程中不会感到十分痛苦。治疗过程产生的热量仅对周围细胞产生作用,不会引发系统反应,副作用显著降低。
为了提高光热治疗的深度、范围、效率和肿瘤选择性,研究人员提出有必要在光热治疗中结合使用可吸收NIR光并可产生热量的材料,即光热治疗剂。光热治疗剂吸收NIR光,并将其高效转换为热能,再传导至周围组织,可实现较大范围组织的温度升高。理想的光热治疗剂应具有低毒性和在NIR窗口(650~950 nm)具有较强的吸收和较高的光热转换效率。随着纳米技术的发展,大量在NIR区域有强烈吸收的纳米材料表现出一定的光热治疗应用前景。其中,无机纳米材料(例如不同结构的金纳米材料[5-6]、碳纳米材料[7]、钯纳米片[8]、硫化铜纳米材料[9]和其他新型纳米材料[10-11])已被作为光热剂应用到光热治疗中。此外,对纳米材料进行优化设计,不仅能对肿瘤进行光热治疗,还能实现多种治疗手段的协同作用。然而,无机光热治疗剂(如金纳米材料、碳纳米材料与铜基纳米晶等)在体内不易降解,存在潜在长期毒性的问题,大大限制了它们的应用。比如,碳纳米管具有优异的光热转换能力,但是基于碳纳米管的复合物往往会在肝脏和肾脏聚集。一些研究将碳纳米管注射到小鼠腹腔中,结果发现它们的致癌性与石棉相似[12-15]。近年来,基于有机材料的光热治疗剂引起了研究者的广泛兴趣。目前研究较多的有机光热治疗剂包括有机近红外染料[16]、卟啉脂质体[17]和高分子聚合物等,这些有机光热治疗剂在生物安全性方面具有明显优势。例如:以吲哚菁绿(ICG)为代表的NIR染料可随尿液代谢排出体外;基于蛋白质、脂质体、聚多巴胺等物质的光热治疗剂可在体内完全降解;基于聚苯胺、聚吡咯等材料的纳米光热治疗剂虽然不易降解,但也不会溶解释放出有毒元素。在提升光热治疗效果方面,小分子NIR染料具有吸收率高和可激发出强烈荧光的优势,然而NIR染料严重的光漂白特性以及非常短的血液循环寿命,限制了其在光热治疗领域的进一步应用。近年来,聚苯胺、聚吡咯、聚多巴胺等聚合物纳米粒子因在NIR区域的特征吸收以及优异的结构稳定性和光稳定性而被用于光热治疗。还有研究工作将卟啉脂质体用于肿瘤的成像和治疗中[17],这些聚合物材料具有良好的应用前景,但仍需要解决一些问题,如
表 1. 典型的有机纳米光热治疗剂
Table 1. Typical organic nanoparticles photothermal agents
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2 通过纳米胶束包裹NIR染料
通过纳米胶束包裹NIR染料可提升NIR染料在动物体内的应用效果。如前所述,小分子NIR染料在生物安全性和代谢方式方面有明显优势。例如,ICG已被批准应用于临床,其安全性毋庸置疑,然而其实际应用却受到光漂白以及血液循环寿命短等缺陷(半衰期
研究者尝试通过磷脂PEG包裹ICG形成纳米胶束,该胶束没有毒性,而且在胶束内的ICG相比于游离的ICG具有更优异的光稳定性。例如,Zheng等[18]发现ICG通过PL-PEG包裹后,其光稳定性可延长至40 d,在光热治疗方面的应用效果也明显提升。针对ICG的光漂白问题,研究人员开发了多种与ICG具有类似结构的吲哚染料,如IR780[19]、IR808[41]、IR825[20]等(如
为了实现光热治疗和化疗的整合,有研究人员采用了纳米胶束同时包裹NIR染料和化疗药物的方法。例如:Zheng等[21]把阿霉素和ICG同时包裹进纳米胶束中,纳米胶束在激光照射下显示出了优异的肿瘤治疗效果,在体实验显示其可对耐药性肿瘤细胞产生治疗作用;刘庄组把IR825和Ce6分子包裹进纳米胶束中,实现了在多模态成像指引下的肿瘤光热和光动力治疗的整合,在较低剂量激光的照射下(光动力治疗采用的剂量为7.2 J/cm2,光热治疗采用的剂量为108 J/cm2),可对表层和深层肿瘤细胞进行杀伤[22]。
尽管通过纳米胶束包裹NIR染料可在一定程度上提高染料的光稳定性,但反复的高功率激光照射仍会破坏染料的结构。因此,目前报道的NIR纳米胶束不能应用于反复的光热治疗,为解决此问题,有必要继续探寻高稳定性的NIR染料。
3 基于蛋白结构的光热治疗剂
蛋白质不仅具有理想的生物相容性,还具有大量可供修饰的活性基团,以便于功能性修饰,因此蛋白质常常被作为药物载体。近年来,研究人员发现某些NIR染料与蛋白质之间存在共价或非共价相互作用,从而开始探索以蛋白质负载NIR染料作为光热治疗剂的可行性[42-45]。
利用NIR染料与蛋白质之间的非共价相互作用可容易地制备NIR染料-蛋白质复合物。Gao等[23]报道了方酸菁染料(SQ)可通过疏水相互作用和氢键结合至牛血清白蛋白(BSA)的疏水域,得到的复合物具有显著提升的荧光发射效果,可用于成像指引的光热治疗。Huang等[25]以转铁蛋白负载NIR染料IR820,并将其用于光声/荧光多模态成像指引的光热治疗。Chen等[24]以人血清蛋白(HSA)负载IR825制备了HSA-IR825复合物,如
虽然非共价相互作用可使染料-蛋白质复合物的制备过程变得简单,但其作用力不足是最大的问题,难以避免染料与蛋白质在血液循环过程中的分离。通过共价连接可使染料与蛋白质牢固结合。例如,Rong等[47]通过酰胺键使NIR染料CySCOOH与HSA共价连接,如
通过蛋白质和NIR染料之间的相互作用构建纳米光热治疗剂是近年来颇受关注的话题,其基本化学组成预示了较高的生物安全性。下一步可考虑通过表面修饰和结构优化来提升NIR染料-蛋白质复合物在肿瘤组织中的靶向富集效果;还可进一步探索结合化疗药物,实现诊断、光热治疗和药物控释功能相结合,最大限度提升肿瘤治疗效果。
4 卟啉脂质体纳米颗粒
卟啉和磷脂共价连接得到的复合物分子可自组装形成直径约为100 nm颗粒(如
卟啉脂质体的优势在于其安全和酶生物降解的特点,临床应用前景广阔;除此之外,卟啉脂质体可负载多种药物分子,有望实现多种治疗手段的有机结合。
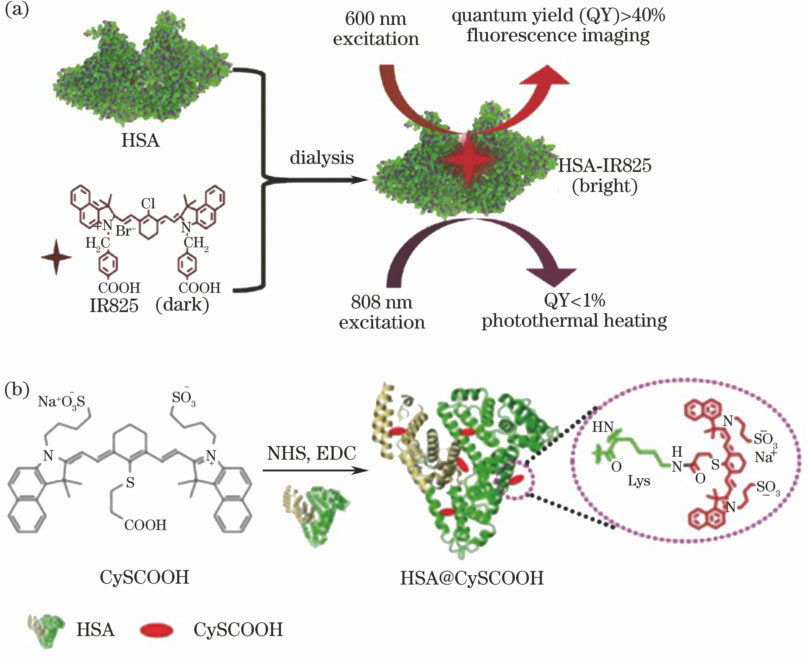
图 2. 基于蛋白结构的光热治疗剂。(a) HSA-IR825的制备示意图及其特殊光学性质;(b) NIR染料CySCOOH与血清蛋白的共价连接示意图
Fig. 2. Protein-based photothermal agents. (a) Schematic of preparation of HSA-IR825 complex, as well as the unique optical behavior of HSA-IR825; (b) schematic of the covalent conjugation of NIR dye molecules CySCOOH to HSA
![(a)卟啉脂质体的制备示意图和(b)透射电镜表征[26]](/richHtml/zgjg/2018/45/2/0207020/img_3.jpg)
图 3. (a)卟啉脂质体的制备示意图和(b)透射电镜表征[26]
Fig. 3. (a) Schematic of preparation of pyropheophorbide-lipid porphysome and (b) transmission electron microscopy images of as-prepared porphysome[26]
5 聚合物近红外吸收材料
相比于上述各种光热治疗剂材料,聚合物纳米材料具有制备成本低、尺度容易调控、组成单一、光学稳定性高等优点,一直是光热治疗剂的研究热点。目前已有多种聚合物材料(如聚苯胺、聚吡咯、聚多巴胺、半导体聚合物等)被研究用作光热治疗剂。
5.1 聚苯胺
聚苯胺是最先被研究用作光热治疗剂的聚合物材料。聚苯胺结构中的亚胺基团容易受到掺杂剂(如强酸、过渡金属、氧化剂等)的作用而转变为亚胺盐,其吸收峰可红移到NIR区域,因此可应用于光热治疗。Yang等[27]制备了一种新型聚苯胺纳米颗粒,在细胞内氧化性组分的作用下,聚苯胺纳米颗粒的吸收峰从570 nm红移到780 nm,如
5.2 聚吡咯(PPy)
PPy因出色的稳定性和生物相容性,在生物电子器件和生物医学应用方面受到广泛关注。在Fe3+的氧化作用下,吡咯单体容易聚合形成PPy纳米颗粒,如
5.3 聚多巴胺(PDA)
PDA是另一种受到广泛关注的高分子近红外吸收材料。作为广泛分布于人体的黑色素的重要组成成分,PDA在生物安全性方面具有明显优势。研究显示,PDA并不干扰多种哺乳动物细胞的活性和增殖能力,即使在很高的剂量下,也不会产生明显的细胞毒性[57]。更重要的是,PDA已被证实在体内可完全降解[58],相比其他共轭聚合物具有更高的安全性。在光学性质方面,PDA具有与黑色素相似的光吸收性能,其在紫外光到可见光的范围内有宽波段的吸收,并且光吸收一直延伸至近红外区域。根据此性质,Liu等[29]探索了PDA作为光热治疗剂的可行性,实验显示PDA纳米颗粒的光热转换效率(
5.4 共轭有机半导体颗粒(SPNs)
近年来,SPNs在设计和制备方面取得了巨大进步。SPNs较高的吸光系数、优良的生物相容性和出色的抗光漂白能力使其在光热治疗方面的应用受到越来越多的关注。Pu等[63-65]报道了SPNs可发展为高效的光声成像探针,该探针可用于动物体内活性氧和pH的成像分析,他们发现SPNs的光声信号强度与光热转换效率呈正相关,并进一步探索了SPNs作为光热治疗剂的效果。Pu等[66]在SPNs中设计了具有光活性的两种不同组分,并将它们分别作为电子给体和受体,它们拥有匹配的轨道能级差,有利于光电子转移,从而导致荧光的猝灭和非辐射热量的生成,有助于更高效地进行光热转换;他们还尝试在SPNs中掺入吸收NIR光的富勒烯,通过光电转移原理使SPNs的最大光热温度提高1.3倍(如
除了上述介绍的几种典型的高分子聚合物材料外,还有其他的高分子纳米近红外吸收材料也被研究作为光热治疗剂,如聚3,4-乙烯二氧噻吩∶聚苯乙烯磺酸盐(PEDOT∶PSS)[31]、聚[9,9-二(4-(2-乙基己氧基)苯基)芴-alt-co-6,7-二(4-己氧基苯基)-4,9-二噻吩基噻二唑并喹喔啉](PFTTQ)[68]等,在此领域不断有结构新颖、性能优异的材料涌现出来,使得肿瘤的光热治疗效果不断提升。
![用于光热治疗的聚合物近红外吸收材料。(a)在细胞内的氧化性环境下,聚苯胺亚胺基团转变为亚胺盐[27];(b)聚吡咯纳米颗粒的合成示意图及颗粒的微观形貌[28];(c)聚多巴胺纳米颗粒的微观形貌、吸收光谱,以及作为光热治疗剂在肿瘤治疗中的应用效果[29];(d)通过颗粒内的光电子转移提升共轭有机半导体纳米颗粒的光热转换效率,并用于肿瘤的光热治疗[30]](/richHtml/zgjg/2018/45/2/0207020/img_4.jpg)
图 4. 用于光热治疗的聚合物近红外吸收材料。(a)在细胞内的氧化性环境下,聚苯胺亚胺基团转变为亚胺盐[27];(b)聚吡咯纳米颗粒的合成示意图及颗粒的微观形貌[28];(c)聚多巴胺纳米颗粒的微观形貌、吸收光谱,以及作为光热治疗剂在肿瘤治疗中的应用效果[29];(d)通过颗粒内的光电子转移提升共轭有机半导体纳米颗粒的光热转换效率,并用于肿瘤的光热治疗[30]
Fig. 4. Conjugated polymers for photothermal therapy of cancer. (a) Transition of the emeralidine group of polyaniline to the emeralidine salt, induced by the intracellular oxidative species[27]; (b) schematic of the formation of polypyrrole nanoparticles and morphology of nanoparticles[28]; (c) morphology and absorption spectrum of polydopamine nanoparticles, and their application in photothermal therapy[29]; (d) photoinduced electron transfer (PET) within the confined nanocompartment resulting in enha
6 结束语与展望
光热疗法为肿瘤的治疗提供了机遇,而光热材料在制备和应用方面的发展则显著推动了光热治疗技术的进步。对近年报道的典型的有机光热治疗剂,包括包裹NIR染料的纳米胶束、基于蛋白结构的光热治疗剂、卟啉脂质体和聚合物近红外吸收材料进行综述,介绍了它们各自的特点、优势和存在的问题,并思考了解决的方向。总体而言,相比于无机材料,有机光热治疗剂在生物安全性方面更具潜力,因此更容易走向临床应用,但仍有大量问题需要解决:
1) 临床应用的安全性问题。在报道的NIR染料中,仅有ICG和普鲁士蓝被批准用于人体。尽管文献显示上述介绍的大部分纳米材料不会引起急性毒性,但这些材料是否可以降解?是否可以通过安全的途径代谢出体外?是否会在体内长期积存并引起长期毒副作用?这些问题都必须在人体实验之前解决,而目前甚少看到对上述纳米材料的毒性进行深入细致研究的报道。
2) 结构和表面性质需要进一步优化。一方面,需要继续探寻光热转换效率高,并且具有生物降解能力的光热治疗剂;另一方面,纳米材料的尺寸、形状、表面基团等性质会显著影响其在肿瘤组织中的富集效果,因此需要对光热治疗剂的结构和表面性质进行细致的优化,以提高其肿瘤靶向能力。
3) 多种治疗技术的结合。临床研究表明,由于病人个体差异、肿瘤边界不明确、肿瘤转移等原因,单一疗法难以取得理想的治疗效果。利用纳米材料在设计上的灵活性,可考虑在光热治疗剂结构中引入抗肿瘤药物、光敏剂或者其他治疗目的的分子,实现光热治疗、药物控释、光动力治疗、放疗等肿瘤治疗技术的结合,以进一步提高肿瘤的治疗效果。
此外,光热治疗的实施还需要配套使用相关的医疗设备。光热治疗最大的障碍是光的穿透深度较小,即使采用近红外光,治疗深度仍不超过1 cm,因此需要发展相应的医疗器件,如超微光纤,使激光可以传导至深层组织,发挥治疗作用。另一方面,光热治疗剂在肿瘤区域的递送以及光热治疗的效果都需要通过合适的手段进行监控,如MRI、超声等,因此亟需在整合治疗和成像监控设备方面开展研究工作。
[52] Liu T W. MacDonald T D, Shi J Y, et al. Intrinsically copper-64-labeled organic nanoparticles as radiotracers[J]. Angewandte Chemie International Edition, 2012, 51(52): 13128-13131.
Article Outline
梁国海, 邢达. 用于肿瘤光热治疗的有机纳米材料研究进展[J]. 中国激光, 2018, 45(2): 0207020. Liang Guohai, Xing Da. Progress in Organic Nanomaterials for Laser-Induced Photothermal Therapy of Tumor[J]. Chinese Journal of Lasers, 2018, 45(2): 0207020.