用于内窥光学相干层析成像探头的小型化及焦深拓展技术  下载: 2282次特邀综述
下载: 2282次特邀综述
1 引言
通过细小的内窥探头,光学相干层析成像(OCT)能在体获取生物体内部组织和器官的三维结构或功能信息,是重要的生物医学成像手段[1]。一方面,为了减轻患者的痛苦,方便伸入狭窄弯曲的生物体管道同时防止对管壁组织的损伤,探头的小型化设计是关键问题之一。使用自聚焦光纤(Graded index fiber, GIF)取代传统透镜组作为聚光元件,制作的全光纤探头的外径能缩小至125 μm及以下,从而可伸入到管径为23 G或25 G的注射针头、活检针等医疗设备中,已被应用于神经外科手术中对人脑内血管的实时检测[2]、动物实验中肺泡的静态/动态成像[3]、动物实验中经支气管的光学引导针活检[4]、离体乳房组织中肿瘤的边界鉴定[5]等前沿领域。另一方面,实现一次性探头的低成本化,对防止感染与普及先进技术具有重要意义。得益于光纤通信技术的发展,普通光纤不仅具有优异的光学特性而且价格低廉,让低成本光纤探头的研制成为可能。但如何在几百μm的尺度下,制作结构简单,且符合实际应用需求的高质量OCT系统微型光学组件,仍有待研究。虽然采用传统透镜的方法适用于小型化探头,但对球面或锥面中透镜的物距和焦距控制增加了制作难度。因此,寻找一种无透镜设计能进一步降低制作难度和成本。Sharma等[6]仅用一根单模光纤(Single mode fiber, SMF)实现了对动脉组织的OCT,但由于从SMF出射的光束具有发散特性,图像的横向分辨率低,且有效的成像范围有限。为了优化出射光束降低光束的发散性,Moon等[7-8]通过引入大纤芯光纤(Large core fiber, LCF)实现了对光纤基模的放大。但LCF中的高阶模式被认为不利于成像,且没有被利用,所以不能实现对出射光场的调控。因此,提出一种高传输效率的无透镜全光纤探头,并在探头的设计过程中考虑了模式干涉对出射光场的影响[9]。
发展高分辨率的内窥OCT系统,实现对生物体内部的活体细胞及细胞外结构的分辨,有利于推动病理研究、诊断及治疗技术的发展[10]。但如何解决横向分辨率与有效成像范围的矛盾,是一个重要的问题。不同于常规的光学成像方法,OCT的轴向分辨率与横向分辨率无关,而是取决于光源的相干长度。目前最先进的宽带光源,轴向分辨率能达到1~5 μm[11]。但如果将横向分辨率提高到同等量级,由于光束在焦点附近的快速发散特性,OCT的有效成像范围会受限于光束极短的焦深。为解决横向分辨率和焦深的矛盾,人们提出多种方案实现了一个数量级的焦深拓展,比如数字聚焦[12-13]、动态聚焦[14-15]和准光针(Optical needle)聚焦[16]。但上述方法有的需要相位稳定性,有的需要机械扫描,有的需要使用两条光路分别实现照明和探测,因此都难以应用在小型化的探头中。通过化学腐蚀[17]或研磨抛光[18]制作的微型轴锥镜,通过软光刻制作的微型二元相位板[19]都已用于探头焦深的扩展,但与台式系统相比,对探头的焦深拓展倍数十分有限。除此之外,人们还设计了一种对一系列光纤进行切割和熔接,且不需其他加工工艺的基于相位掩模板的方案[20],但对光纤的切割精度要求很高,制作难度较大。全光纤探头利用阶跃折射率光纤中的高阶模式,通过产生一系列共轴但在空间上错开的焦点,也可以实现焦深的拓展[21]。但是焦深区域内的干涉相消会导致出射光束的光强在轴向上分布不均匀,不利于整体成像效果。因此,人们提出了一种基于光纤型光瞳滤波器拓展焦深的探头[22],利用光纤中的多模干涉,在聚焦物镜的光瞳中产生可控的复振幅场,通过模仿传统复振幅型光瞳滤波器,实现焦深拓展。与传统振幅型光瞳滤波器相比,基于多模干涉的技术中心无遮挡,具有更高的传输效率,适合于信号较弱的生物成像领域。与基于相位掩模板的方案相比,容许更大的光纤长度误差,降低了制作难度。为增加探头的工作距离,提出了用成像放大的多模干涉场来优化光瞳处的复振幅场。
基于模式干涉的内窥OCT探头在解决探头的小型化问题、调控出射光场、降低制作难度方面有显著优势。通过优化聚焦物镜光瞳处的多模干涉场,拓展了焦深;通过控制模间相位差,优化了焦深范围内的轴向光强均匀性;通过改变多模干涉场的放大方式,延长了探头的工作距离。由于具有图像质量高、易于制作、尺寸小巧、结构可靠的优点,基于模式干涉的OCT探头具有较好的应用潜力,尤其是在生物内部组织和器官的在体内窥成像领域。本文重点介绍了本课题组在基于多模干涉的聚焦光场优化以及小型化探头的制作方面取得的进展。
2 多模干涉探头的原理
传统探头的原理如
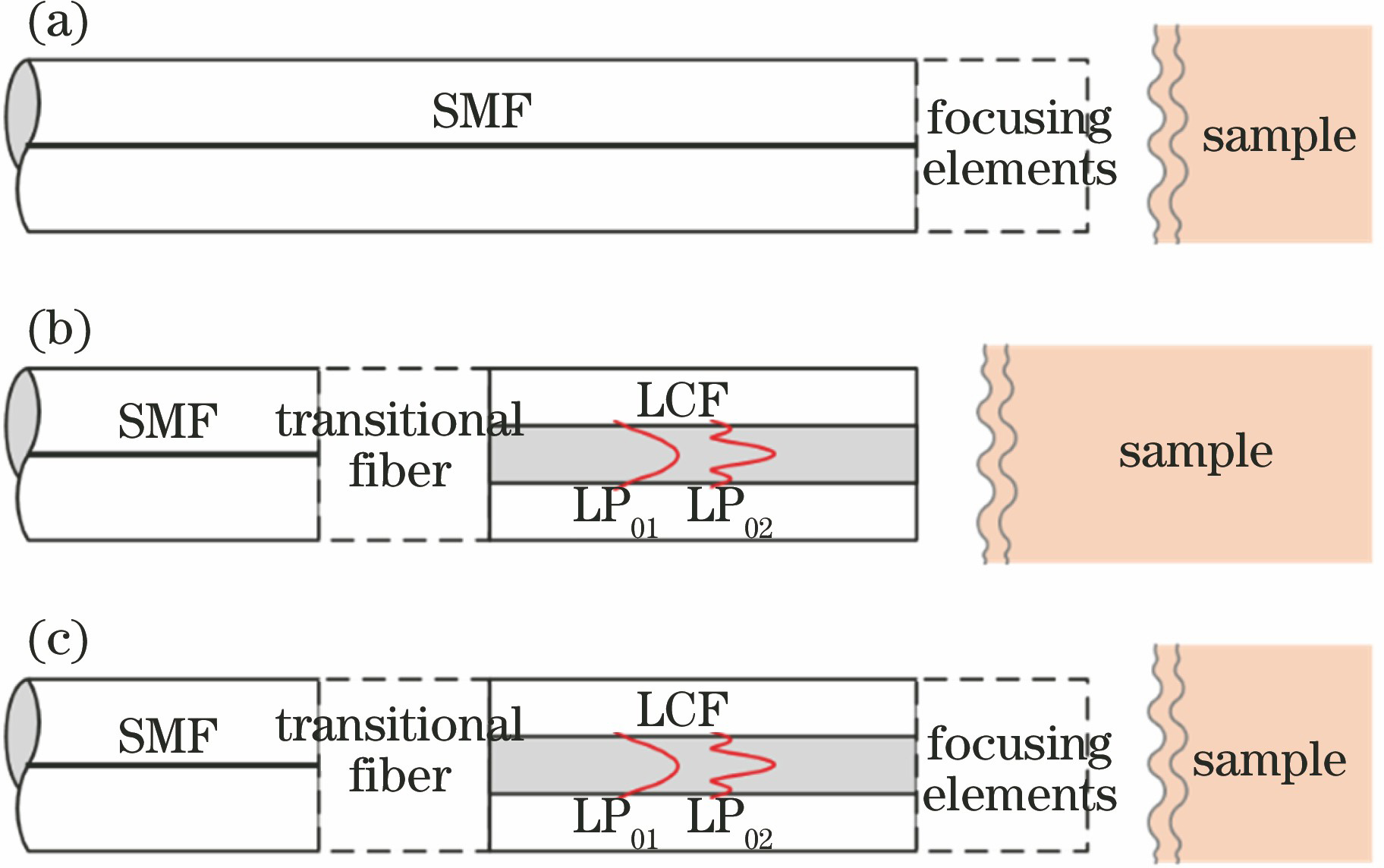
图 1. 探头原理图。(a)传统探头;(b)不含聚焦元件的多模干涉探头;(c)包含聚焦元件的多模干涉探头
Fig. 1. Schematic of probes. (a) Conventional probe; (b) multi-mode interference probe without focusing elements ; (c) multi-mode interference probe with focusing elements
将导光系统的SMF输出线偏光近似为高斯光束,则SMF末端的电场分布表示为
式中,r为极径,wSMF为SMF的模场半径,E0为中心位置的振幅。设变换后高斯光束的束腰在TF末端,则经过渡段变换后形成的电场表示为
式中,wTF为束腰半径,相位项Φ(r)是一个与r无关的常数。若wTF>wSMF,光束经TF后发散角变小,有助于能量耦合进LCF的低阶模式;若wTF
式中,PSMF为SMF的输出光功率,c为光速,ε0为真空中介电常数,nLCF为LCF芯层折射率,N为LCF中允许存在的LP0n模的数量,ηn为LP0n模的耦合效率,
式中,J0为零阶贝塞尔函数,k0为真空中波数,K0为零阶第二类修正贝塞尔函数,bn为一常系数,分段函数在r=ρ位置处连续。根据模式的正交性,可由重叠积分计算ηn
式中,
式中,k=nsk0为介质中的波数,ns为介质折射率,R=
对于
式中,ρcl为光纤的包层半径,u=k(NA)2(z-zf),zf为焦点位置,NA为数值孔径。(8)式显示的轴上电场强度在形式上是光瞳函数P(t)=ELCF(
3 探头的小型化设计以及多模干涉探头
与其他生物医学成像技术如计算层析成像(CT)、核磁共振成像(MRI)、超声成像(US)相比,OCT技术虽然具有很高的分辨率(约10 μm),但在生物组织中的穿透深度仅有1~2 mm。在有限的穿透深度下,虽然能应用于对人眼等相对透明的组织或皮肤、肌肉、牙齿等表面组织的高分辨率在体成像,但无法显示发生在内部的病变问题。1996年,Tearney等[23]提出一种外径为1 mm尺度的内窥OCT探头原型,能够通过血管网络实现对生物体内部组织的成像。由SMF、自聚焦透镜(GRIN lens,又称格林透镜)以及直角棱镜组成,如
![探头原理图。(a)血管内OCT探头[23];(b)针式探头[24]](/richHtml/zgjg/2020/47/2/0207013/img_2.jpg)
图 2. 探头原理图。(a)血管内OCT探头[23];(b)针式探头[24]
Fig. 2. Schematic of probes. (a) Intravascular OCT probe[23]; (b) imaging needle for OCT[24]
为了减轻探头在插入过程中对组织的损坏程度,如何实现探头的小型化是内窥探头设计的重要问题之一。2000年,Li等[24]提出一种外径为亚mm尺度(约410 μm)的针式探头原型。采用直径为250 μm的微型GRIN透镜和定制的微型直角棱镜实现探头的小型化,如
虽然早期在内窥探头的制作工艺方面和图像质量方面都存在问题,但侧向探头原型的提出开启了人们对探头小型化的广泛研究。寻找一种易获取、易制作同时具有合适光学特性的微型聚焦组件和光束偏转组件是实现探头小型化的主要因素。贝克曼先进科学技术学院的Boppart等[25]在SMF的末端粘贴一个侧抛的玻璃珠代替传统透镜和直角棱镜,将探头的尺寸和硬端长度减小至125 μm,如
![基于球透镜的小型探头。(a)用于反射和聚焦光束的玻璃半球[25];(b)直径为500 μm的蓝宝石球透镜 [26];(c)能够同时用在空气中和液体中的直径为70 μm的共路OCT探头[27];(d)探头的光束大小随距探头末端距离的变化曲线[27]](/richHtml/zgjg/2020/47/2/0207013/img_3.jpg)
图 3. 基于球透镜的小型探头。(a)用于反射和聚焦光束的玻璃半球[25];(b)直径为500 μm的蓝宝石球透镜 [26];(c)能够同时用在空气中和液体中的直径为70 μm的共路OCT探头[27];(d)探头的光束大小随距探头末端距离的变化曲线[27]
Fig. 3. Miniature probe based on ball lens. (a)Glass hemisphere for reflecting and focusing beam[25]; (b) sapphire ball lens with 500 μm[26]; (c) 70 μm diameter probe for common-path OCT in air and liquids[27]; (d) curve of beam size of the probe changing with the distance from the end of the probe[27]
基于球透镜方案研制的探头在直径在250~500 μm时具有较好的应用潜力,但随着探头尺寸的进一步减小,球透镜的焦距同比减小而聚集能力变强,可能导致出射光束具有过强的发散性,从而限制了OCT的有效成像范围。实现探头小型化的途径也可以借鉴光纤通信中用于减小插入损耗的光纤透镜技术,其中一种典型的工艺是利用电弧、高温钨丝或激光熔融光纤末端,使熔融石英在液面张力的作用下形成泪滴状的弧面。但与光纤互连的光纤透镜由于工作距离非常短,所以不能直接应用于OCT探头的制作。Ryu等[28]将一段无芯光纤熔接在SMF上,然后利用光纤熔机产生的高温电弧在无芯光纤的末端形成光纤透镜(
![光纤透镜的制作及其出射光斑。(a)~(c)光纤透镜的弧度半径随无芯光纤直径的增大而增大[28];(d)光纤透镜的弧度半径随电弧功率的增大而减小[29];(e)基于侧向抛光光纤透镜的侧向探头[30];(f)不经过保护套管时光斑的横向强度分布;(g)经过保护套管后的光斑横向强度分布[30]](/richHtml/zgjg/2020/47/2/0207013/img_4.jpg)
图 4. 光纤透镜的制作及其出射光斑。(a)~(c)光纤透镜的弧度半径随无芯光纤直径的增大而增大[28];(d)光纤透镜的弧度半径随电弧功率的增大而减小[29];(e)基于侧向抛光光纤透镜的侧向探头[30];(f)不经过保护套管时光斑的横向强度分布;(g)经过保护套管后的光斑横向强度分布[30]
Fig. 4. Fabrication of lensed fibers and their output beam spots. (a)-(c) Radii of the fiber lens increase with the diameters of the coreless fibers[28]; (d) radii of the fiber lens decrease with arc power of the splicer[29]; (e) side viewing probe design with angle polishing fiber lens[30]; (f) transverse intensity distribution of the spot without the pro
使用GIF作为聚焦元件是小型化探头最常用的技术之一,尤其在裸探头的尺寸小于或等于250 μm的情形中。与球透镜相比,GIF无需三维光纤对准,就能通过商用光纤熔接机直接熔接至光纤探头的末端,有效降低了制作难度以及制作成本。与光纤透镜相比,10 Gbit/s以太光纤的制作工艺保证了自聚集光纤具有能达到很理想的抛物形径向折射率分布曲线[31],具有低像差以及高成像质量的优势。但该工艺仅适用于芯层直径较小的GIF(比如芯层直径为50 μm或65 μm),对于更大芯层直径的GIF,现有技术会在折射率分布曲线的中心处产生明显的凹陷,不利于成像质量。但在不同时要求高横向分辨率与大工作距离的情形下,具有较好的光学特性和机械特性,成本低廉并且易于制作,是探头小型化技术中理想的选择。西澳大学的Lorenser等[32]2011年提出的一种超小侧向针式探头采用的聚焦元件就是GIF。该探头的外径为0.31 mm,是当时尺寸最小的OCT探头。在中心波长为840 nm、工作距离为300 μm、成像深度为550 μm时实现了优于30 μm的横向分辨率。探头采用光纤型反射器,即通过对光纤末端倒45°斜角实现光束的偏转,如
![超小型侧向针式探头[32-33]。(a)探头原理图;(b)使用针式探头获得的羊肺的三维OCT成像图;(c)使用针式探头获得的骨骼肌的OCT成像图;(d)骨骼肌的显微图](/richHtml/zgjg/2020/47/2/0207013/img_5.jpg)
图 5. 超小型侧向针式探头[32-33]。(a)探头原理图;(b)使用针式探头获得的羊肺的三维OCT成像图;(c)使用针式探头获得的骨骼肌的OCT成像图;(d)骨骼肌的显微图
Fig. 5. Subminiature lateral probe[32-33]. (a) Schematic of probe; (b) three dimensional OCT image of sheep lung obtained by needle probe; (c) OCT image of skeletal muscle obtained by the needle probe; (d) micrograph of skeletal muscle
新设计的探头在700 μm的深度范围内实现了优于20 μm的横向分辨率。对骨骼肌组织的成像图显示出正常肌肉呈条状的纤维结构,散射信号相对均匀的坏死区以及具有较强散射信号的结缔组织,如
基于微型GRIN透镜、球透镜、光纤透镜以及GIF的探头虽然能通过改变探头参数实现对出射光束的工作距离、聚焦光斑大小以及焦深在一定范围内的连续可调,但难以校正球差、像散或实现非高斯光束照明。阿德莱德大学的Li等[34]利用基于双光子聚合反应的3D打印技术实现了自由曲面微型光学元件的打印,并用于光纤型OCT探头的制作,如
![具有自由曲面透镜的探头及其成像效果[34]。(a)共路的3D打印的离轴抛物全反射面以及光纤的装配体;(b)多层胶带的OCT成像图;(c)黄瓜的OCT成像图;(d)人类手掌的OCT成像图](/richHtml/zgjg/2020/47/2/0207013/img_6.jpg)
图 6. 具有自由曲面透镜的探头及其成像效果[34]。(a)共路的3D打印的离轴抛物全反射面以及光纤的装配体;(b)多层胶带的OCT成像图;(c)黄瓜的OCT成像图;(d)人类手掌的OCT成像图
Fig. 6. Probe with free form surface lens and its imaging effect[34]. (a) 3D printing of off-axis parabolic total-reflection surface and optical fiber assembly. (b) OCT image of tape phantom; (c) OCT image of cucumber; (d) OCT image of human hand
虽然自由曲面透镜在探头的全面优化方面具有不可替代的优势,但由于其制作成本较高并且短时间内难以下降,不利于新型探头在科学研究和临床研究上的普及。在探头的小型化技术中,与之截然相反的思路是无透镜探头的设计。在基于透镜的探头设计中,探头的出射光束与透镜参数,如球透镜的直径、光纤透镜的弧面半径、GIF的长度密切相关。因此为了保证制作探头产生所需的出射光束特性,在制作过程中必须严格控制这些参数,从而提高了探头的制作难度。约翰霍普金斯大学的Liu等[35]使用一根SMF作为内窥探头,对人类手指皮肤以及指甲获得了令人满意的图像。如
![无透镜探头及其成像效果图。(a)基于单根SMF的探头对人类手指指尖;(b)指甲盖的OCT成像图[35];(c)基于逐步过渡纤芯的探头的原理图;(d)人类手指指尖OCT成像图[7]](/richHtml/zgjg/2020/47/2/0207013/img_7.jpg)
图 7. 无透镜探头及其成像效果图。(a)基于单根SMF的探头对人类手指指尖;(b)指甲盖的OCT成像图[35];(c)基于逐步过渡纤芯的探头的原理图;(d)人类手指指尖OCT成像图[7]
Fig. 7. Lens-free probes and their imaging performances. (a) Human finger nail obtained from single SMF probe; (b) OCT image of human finger tip[35]; (c) schematics of ultra-thin probe based on stepwise transitional core fiber; (d) OCT image of human finger tip[7]
为了减小无透镜探头的发散性同时提高传输效率,提出一种基于拉锥光纤的无透镜探头[9]。与Moon等的设计思路不同的是,探头中LCF的高阶模式被用于实现对出射光束的调制,由一根SMF、一段拉锥光纤和一段LCF组成,结构图如
![输出光束可调控的无透镜探头[9]。(a)探头的结构图;(b)四组典型参数下出射光束的二维光强分布;(c)所制作的探头的整体图和显微图;(d)基于探头的OCT系统;(e)基于振镜的台式系统对人类手指的OCT成像图](/richHtml/zgjg/2020/47/2/0207013/img_8.jpg)
图 8. 输出光束可调控的无透镜探头[9]。(a)探头的结构图;(b)四组典型参数下出射光束的二维光强分布;(c)所制作的探头的整体图和显微图;(d)基于探头的OCT系统;(e)基于振镜的台式系统对人类手指的OCT成像图
Fig. 8. Lens-free probe with tunable output beam[9]. (a) Layout of the probe; (b) two-dimensional light intensity distribution of the outgoing beam under four typical parameters; (c) photograph and micrograph of the fabricated probe; (d) OCT system based on the probe; (e) OCT image of the human finger based on galvanometer desktop system
4 探头的焦深拓展以及多模干涉探头
小型化探头的焦深拓展技术有利于推动人体内部器官的高清晰三维OCT在体成像的发展。2011年,哈佛药学院的Tearney团队研制了一种能够对人体动脉易损斑块进行亚细胞结构成像的微OCT系统,将常规OCT系统约10 μm的分辨率提高了一个数量级[10],具有优于1 μm的轴向分辨率、2 μm的横向分辨率,首次实现了对内皮细胞、白细胞和血小板等细胞结构的高清OCT成像。如何在提高横向分辨的同时获得较大的焦深,是发展高分辨率OCT系统亟待解决的问题。
轴锥镜可以产生具有无衍特性贝塞尔光束,很早就被用于拓展OCT系统的焦深[36]。圣安德鲁斯大学的Tan等[17]使用化学腐蚀技术,利用氢氟酸对不同掺杂浓度的石英的腐蚀速率不同的原理,在SMF的端面上形成了微型圆锥透镜,如
![基于微型圆锥透镜的探头。(a)通过化学腐蚀制作的基于微型圆锥透镜的探头的电场强度分布图[17];(b)通过研磨抛光制作的基于微型圆锥透镜的探头的显微图;(c)焦平面上的光强分布图;(d) x轴方向上的归一化光强分布曲线[18];(e)内窥镜中微型圆锥透镜组的原理图[37]](/richHtml/zgjg/2020/47/2/0207013/img_9.jpg)
图 9. 基于微型圆锥透镜的探头。(a)通过化学腐蚀制作的基于微型圆锥透镜的探头的电场强度分布图[17];(b)通过研磨抛光制作的基于微型圆锥透镜的探头的显微图;(c)焦平面上的光强分布图;(d) x轴方向上的归一化光强分布曲线[18];(e)内窥镜中微型圆锥透镜组的原理图[37]
Fig. 9. Probes based on micro conical lens. (a) Electric field intensity distribution diagram of probe based on micro conical lens made by chemical corrosion[17]; (b) microscope image of probe based on micro conical lens made by polishing and grinding; (c) light intensity distribution diagram on focal plane; (d) normalized light intensity distributions curve in x axis[18]; (e) schematic of micro co
西澳大学的Lorenser等[20]研制了一种基于相位板的小型化焦深拓展的探头,如
![小型化的拓展焦深的探头。(a)使用GIF相位板拓展焦深的探头;(b)其出射光束在水中的光强分布[20];(c)基于自成像波前分割的光学系统;(d)其出射光束在生物组织中的光强分布;(e) 0阶模式的边缘光束追迹;(f) 1阶模式的边缘光束追迹; (g) 2阶模式的边缘光束追迹[21]](/richHtml/zgjg/2020/47/2/0207013/img_10.jpg)
图 10. 小型化的拓展焦深的探头。(a)使用GIF相位板拓展焦深的探头;(b)其出射光束在水中的光强分布[20];(c)基于自成像波前分割的光学系统;(d)其出射光束在生物组织中的光强分布;(e) 0阶模式的边缘光束追迹;(f) 1阶模式的边缘光束追迹; (g) 2阶模式的边缘光束追迹[21]
Fig. 10. Miniature probes with extended focus depth. (a) Using GIF phase plate to expand the focus depth of the probe; (b) its light intensity distribution of the outgoing beam in water[20]; (c) self-imaging wavefront division optical system; (d) its field intensity distribution in tissue; (e) edge beam trace of the 0th-order mode; (f) edge beam trace of the 1st-order mode; (g) edge beam trace of the 2nd-order mode[21<
为减小探头的尺寸和硬端长度,降低制作难度,本课题组[22]提出一种基于光纤型光瞳滤波器拓展焦深的探头。如
![基于GIF-LCF光瞳滤波器扩展焦深的全光纤OCT探头[22]。(a)探头的原理图;(b)~(d)含滤波器的三种探头的归一化光强分布;(e)不含滤波器的常规探头的归一化光强分布](/richHtml/zgjg/2020/47/2/0207013/img_11.jpg)
图 11. 基于GIF-LCF光瞳滤波器扩展焦深的全光纤OCT探头[22]。(a)探头的原理图;(b)~(d)含滤波器的三种探头的归一化光强分布;(e)不含滤波器的常规探头的归一化光强分布
Fig. 11. All fiber OCT probe based on GIF-LCF pupil filter to extend depth of focus[22]. (a) Schematic layout of probe; (b)-(d) normalized light intensity distributions of the probes with three designed filters; (e) normalized light intensity distribution of the conventional probe without filter
为了进一步提高基于光纤型光瞳滤波器探头的工作距离,在原有设计的基础上增加了一段GIF用于实现多模干涉场(MIF)的放大,如

图 12. 全光纤探头。(a)探头的原理图;(b)三种典型情况下所仿真的空气中出射光束的光场强度分布; (c)所制作的传统探头的显微照片
Fig. 12. All-fiber probe. (a) Layout of the probe; (b) simulated field intensity of the output beams in air for three typical cases of the designed probe; (c) microscope images of the proposed probe

图 13. 探头对人造微球-琼脂样本的OCT成像图。(a)使用传统探头;(b)使用所提出的探头
Fig. 13. Cross-sectional OCT images of the microbeads-agarose phantom taken by probes. (a) Image taken by the conventional probe; (b) image taken by the proposed probe
5 结论
OCT技术是一种重要的生物医学成像手段,能通过一根细小的内窥探头实现对人体内部组织器官的高分辨率三维在体结构或功能成像。内窥探头的小型化,是发展内窥OCT系统的关键技术之一。根据不同应用场景,OCT探头可大致分为直径大于1 mm的中型探头,直径约等于1 mm的小型探头以及直径小于250 μm的超小型探头。中小型探头往往被用于管腔直径较大的场景,因此需要具有较长的工作距离。毫米尺度的传统的GRIN透镜(最小直径可达250 μm)和微型透镜组的工艺比较成熟,且容易获得更长的工作距离,因而在该领域具有明显的优势。但对于更加细小的管腔结构引导的内窥实验、细针活检或者小动物活体成像实验,超小型探头就具有明显的优势[38]。设计超小型探头的中心问题是寻找一种易于制造、具有优质光学特性,并在一定范围内可调的微型聚焦元件。主流的微型聚焦元件有球透镜、光纤透镜和自聚焦光纤。其中球透镜具有较大的有效孔径,适用于对工作距离要求高、尺寸要求小的场合;光纤透镜由于其椭球形结构,在补偿由探头保护套管引起的像散方面具有独特的优势;虽然现在的光纤制备技术使自聚焦光纤的径向折射率分布呈现理想的抛物型曲线,但其芯层直径往往小于65 μm,很难同时实现长工作距离和高横向分辨率;基于3D打印技术的微型自由曲面透镜,具有高自由度,结合焦深拓展技术和像差补偿技术,能同时优化探头的横向分辨率、焦深、工作距离,获得零像散的对称光斑,实现高质量的成像,但其制作成本较高可能会阻碍其进一步的推广;无透镜的内窥探头在易于制造方面具有明显的优势,在对人类手指皮肤和指甲的成像图中,由一根单模光纤组成的内窥探头能显示出不错的信噪比和一定的成像深度,除了能观察清楚汗腺的螺旋结构外,还能观察到表皮内部约0.6 mm处的血管;而基于逐步过渡纤芯、拉锥结构的无透镜内窥探头改善了单模光纤出射光束的快速发散问题,虽然与有透镜的探头相比,损失了一半的焦深,但是在对尺寸要求小和横向分辨率中等的场景中,由于制作简单而具有竞争优势。与逐步过渡纤芯光纤的无透镜探头相比,基于拉锥结构的无透镜探头除了具有更高的传输效率外,还充分利用模式干涉实现了对出射光场的调控。对于能量主要集中在LP01模,而模式干涉不明显的情形,大纤芯光纤的长度变化对出射光场的调制可忽略不计;对于LP01模和LP02模能量相当的情形,大纤芯光纤的长度变化会引起模间相位差的改变,从而调制出射光场的强度。但由于模式之间的传播常数的差别足够小,模间相位差对光纤长度的变化不敏感,因此即便大纤芯光纤的长度对出射光场有明显的调制作用,出射光场在较宽的光纤长度误差范围内也不会有明显的变化。虽然光纤的拉锥工艺增加了潜在的制作难度,但考虑到只需满足绝热条件即可,难度不会太大。无论是基于逐步过渡纤芯,还是基于拉锥结构的无透镜探头都可以通过化学腐蚀的方法进一步减小其外径。在兼顾机械强度和插入损耗的情况下,其外径能减小至85 μm,更方便于与其他类型探头,如超声探头、荧光探头、光声探头等组合形成小型化的联合探头。
超宽带光源的发展将OCT系统的分辨率推动到μm级别,使OCT系统对细胞成像成为可能。但如何在提高横向分辨率的同时获得较长的焦深,是发展高分辨率OCT系统的关键问题之一。而实现对小型探头的焦深拓展,有利于发展生物体内部的高分辨的三维在体成像技术。在500 μm的探头尺寸下,基于多模光纤高阶模式的方法实现了5倍的焦深拓展,但由于模式干涉,出射光束在焦深范围内具有不均匀轴向光强分布;在125 μm的探头尺寸下,基于圆锥透镜的方法实现了约5倍的焦深拓展,但同时产生了明显的旁瓣;而基于相位板的方法产生的出射光束虽然旁瓣不明显,但其焦深拓展倍数有限。因此在小的探头尺寸下,难以同时获得低旁瓣水平和高焦深的拓展倍率。基于光纤型光瞳滤波器的探头对入瞳处的模式干涉场进行优化,制作难度较低,可实现与基于相位板的方法相当的焦深拓展倍数,且具有较低的旁瓣水平、优化的工作距离和焦深,与传统光纤探头相比有更优越的成像效果。通过调节模间相位差,尽可能地避免焦深范围内的模式干涉相消,实现了更均匀的轴向光强分布。因此基于光纤型光瞳滤波器的焦深拓展方案具有明显的竞争优势,但目前焦深拓展倍率仍然有限,未来将研究840 nm波长下,以及更多模式下,探头的焦深、轴向光强均匀性以及工作距离的优化问题。
[1] Herz P R, Chen Y, Aguirre A D, et al. Ultrahigh resolution optical biopsy with endoscopic optical coherence tomography[J]. Optics Express, 2004, 12(15): 3532-3542.
[2] RamakonarH, Quirk BC, Kirk RW, et al., 2018, 4(12): eaav4992.
[4] Li J W, Quirk B C, Noble P B, et al. Flexible needle with integrated optical coherence tomography probe for imaging during transbronchial tissue aspiration[J]. Journal of Biomedical Optics, 2017, 22(10): 106002.
[5] Villiger M, Lorenser D. McLaughlin R A, et al. Deep tissue volume imaging of birefringence through fibre-optic needle probes for the delineation of breast tumour[J]. Scientific Reports, 2016, 6: 28771.
[6] Sharma U, Kang J U. Common-path optical coherence tomography with side-viewing bare fiber probe for endoscopic optical coherence tomography[J]. Review of Scientific Instruments, 2007, 78(11): 113102.
[8] Lee J, Chae Y, Ahn Y C, et al. Ultra-thin and flexible endoscopy probe for optical coherence tomography based on stepwise transitional core fiber[J]. Biomedical Optics Express, 2015, 6(5): 1782-1796.
[9] Ding Z H, Qiu J R, Shen Y, et al. Lens-free all-fiber probe with an optimized output beam for optical coherence tomography[J]. Optics Letters, 2017, 42(14): 2814-2817.
[10] Liu L B, Gardecki J A, Nadkarni S K, et al. Imaging the subcellular structure of human coronary atherosclerosis using micro-optical coherence tomography[J]. Nature Medicine, 2011, 17(8): 1010-1014.
[11] Drexler W, Morgner U, Ghanta R K, et al. Ultrahigh-resolution ophthalmic optical coherence tomography[J]. Nature Medicine, 2001, 7(4): 502-507.
[12] Ralston T S, Marks D L, Scott Carney P, et al. Interferometric synthetic aperture microscopy[J]. Nature Physics, 2007, 3(2): 129-134.
[13] Bo E, Luo Y M, Chen S, et al. Depth-of-focus extension in optical coherence tomography via multiple aperture synthesis[J]. Optica, 2017, 4(7): 701-706.
[14] Qi B, Phillip Himmer A, Maggie Gordon L, et al. Dynamic focus control in high-speed optical coherence tomography based on a microelectromechanical mirror[J]. Optics Communications, 2004, 232: 123-128.
[15] Cobb M J, Liu X M, Li X D. Continuous focus tracking for real-time optical coherence tomography[J]. Optics Letters, 2005, 30(13): 1680-1682.
[16] Bao W, Ding Z H, Qiu J R, et al. Quasi-needle-like focus synthesized by optical coherence tomography[J]. Optics Letters, 2017, 42(7): 1385-1388.
[17] Tan K M, Mazilu M, Chow T H, et al. In-fiber common-path optical coherence tomography using a conical-tip fiber[J]. Optics Express, 2009, 17(4): 2375-2384.
[18] Wang W, Wang G Y, Ma J, et al. Miniature all-fiber axicon probe with extended Bessel focus for optical coherence tomography[J]. Optics Express, 2019, 27(2): 358-366.
[19] Kim J, Xing J C, Nam H S, et al. Endoscopic micro-optical coherence tomography with extended depth of focus using a binary phase spatial filter[J]. Optics Letters, 2017, 42(3): 379-382.
[20] Lorenser D, Yang X J, Sampson D D. Ultrathin fiber probes with extended depth of focus for optical coherence tomography[J]. Optics Letters, 2012, 37(10): 1616-1618.
[21] Yin B W, Hyun C, Gardecki J A, et al. Extended depth of focus for coherence-based cellular imaging[J]. Optica, 2017, 4(8): 959-965.
[22] Qiu J R, Shen Y, Shangguan Z W, et al. All-fiber probe for optical coherence tomography with an extended depth of focus by a high-efficient fiber-based filter[J]. Optics Communications, 2018, 413: 276-282.
[23] Tearney G, Boppart S, Bouma B, et al. Scanning single-mode fiber optic catheter-endoscope for optical coherence tomography[J]. Optics Letters, 1996, 21(7): 543-545.
[24] Li X D, Chudoba C, Ko T, et al. Imaging needle for optical coherence tomography[J]. Optics Letters, 2000, 25(20): 1520-1522.
[26] Zhao M T, Huang Y, Kang J U. Sapphire ball lens-based fiber probe for common-path optical coherence tomography and its applications in corneal and retinal imaging[J]. Optics Letters, 2012, 37(23): 4835-4837.
[27] Marrese M, Offerhaus H, Paardekam E, et al. 70 μm diameter optical probe for common-path optical coherence tomography in air and liquids[J]. Optics Letters, 2018, 43(24): 5929-5932.
[28] Ryu S Y, Choi H Y, Na J, et al. Lensed fiber probes designed as an alternative to bulk probes in optical coherence tomography[J]. Applied Optics, 2008, 47(10): 1510-1516.
[29] Qiu Y, Wang Y, Belfield K D, et al. Ultrathin lensed fiber-optic probe for optical coherence tomography[J]. Biomedical Optics Express, 2016, 7(6): 2154-2162.
[30] Tan K M, Shishkov M, Chee A, et al. Flexible transbronchial optical frequency domain imaging smart needle for biopsy guidance[J]. Biomedical Optics Express, 2012, 3(8): 1947-1954.
[31] Reed W A, Yan M F, Schnitzer M J. Gradient-index fiber-optic microprobes for minimally invasive in vivo low-coherence interferometry[J]. Optics Letters, 2002, 27(20): 1794-1796.
[32] Lorenser D, Yang X, Kirk R W, et al. Ultrathin side-viewing needle probe for optical coherence tomography[J]. Optics Letters, 2011, 36(19): 3894-3896.
[34] Li J W, Fejes P, Lorenser D, et al. Two-photon polymerisation 3D printed freeform micro-optics for optical coherence tomography fibre probes[J]. Scientific Reports, 2018, 8: 14789.
[36] Ding Z, Ren H, Zhao Y, et al. High-resolution optical coherence tomography over a large depth range with an axicon lens[J]. Optics Letters, 2002, 27(4): 243-245.
[37] Weber N, Spether D, Seifert A, et al. Highly compact imaging using Bessel beams generated by ultraminiaturized multi-micro-axicon systems[J]. Journal of the Optical Society of America A, 2012, 29(5): 808-816.
[38] 孙伟, 李嘉男, 戚苈源, 等. 内窥扫频光学相干层析探测牙齿根裂的研究[J]. 光学学报, 2019, 39(8): 0811002.
Article Outline
邱建榕, 韩涛, 王迪, 孟佳, 刘智毅, 丁志华. 用于内窥光学相干层析成像探头的小型化及焦深拓展技术[J]. 中国激光, 2020, 47(2): 0207013. Qiu Jianrong, Han Tao, Wang Di, Meng Jia, Liu Zhiyi, Ding Zhihua. Probes for Endoscopic Optical Coherence Tomography: Minimized Design and Depth of Focus Extension[J]. Chinese Journal of Lasers, 2020, 47(2): 0207013.






