腔道肿瘤光动力诊疗内窥技术的发展及临床应用现状  下载: 598次
下载: 598次
Photodynamic therapy (PDT) is a novel cancer treatment technique based on the local or systemic application of a photosensitizer that selectively accumulates within tumor cells and peaks after a certain time. The photosensitizer can then be activated by light of an appropriate wavelength, leading to generation of reactive oxygen species (ROS). There are three main processes by which ROS contribute to tumor destruction in PDT: direct cellular damage, indirect vascular shutdown, and activation of immune responses against tumor cells. For deep luminal tumors, the PDT approach involves the passage of a flexible optical fiber that can follow the naturally curving orifice of the human body to deliver the laser directly to the target tumor through the operating channel of a flexible endoscope. Endoscopic photodynamic therapy has a good selective killing effect on tumors, resulting in a strong curative effect. Endoscopic PDT is also minimally invasive, making it suitable for treating gastrointestinal and respiratory tumors. PDT spares vital organ function while effectively removing tumor cells after treatment; therefore, it is a standard treatment option for esophageal cancer and central lung cancers.
During PDT for luminal tumors, the endoscope, an important auxiliary device, can accurately identify the lesion tissue preoperatively, provide a high-definition view in real time perioperatively, guide optical fibers to emit light toward the lesion, and detect postoperative lesion response to evaluate treatment efficacy. However, conventional endoscopes display technical deficiencies in achieving the above functions. Hence, it is important and necessary to summarize existing specific problems and the application status of endoscopic technology in PDT to guide the development of photodynamic diagnosis and treatment technologies.
Conventional endoscopes have some limitations and problems, such as invisible targets resulting from lens exposure under the laser, deviations between treatment light and the observation field, leakage, and tumor tissue misdiagnosis. Here we analyze the specific causes of these problems by briefly describing the basic principles of electronic endoscopy. We comprehensively introduce the laser visualization endoscope during PDT, coaxial laser endoscope, and fluorescence diagnostic endoscopes and describe the combination of the endoscopic systems of photodynamic diagnosis (PDD) and PDT, which were earlier separated and now developed into integrated systems. We further introduce the integrated endoscope used for PDD and PDT.
Using the laser visualization endoscope during PDT avoids charge-coupled device (CCD) exposure resulting from intense laser light and, therefore, whiteout; however, the real picture of the tumor can be restored. Prior studies have reported that simultaneous imaging endoscopes are highly suitable for PDT. A coaxial laser endoscope, which couples the laser fiber and optical image fiber on the same axis with the same view field and laser irradiation field, improves laser positioning accuracy. Fluorescence diagnostic endoscopes include autofluorescence endoscopes and PDD-based endoscopes, in which the tumor and normal tissue are labeled with different fluorescent colors. These have a higher diagnostic sensitivity than white light detection endoscopes. Photodynamic diagnosis and therapy all-in-one endoscopes can realize PDD and PDT simultaneously, avoiding the inconvenience caused by switching endoscopes, detect photosensitizer consumption, and judge the treatment effect. These new all-in-one endoscopes can be used for PDT and PDD. The innovation of endoscopic devices plays an important role in the clinical practice of PDT, reducing technical difficulty and operation time.
The endoscopy technology for the clinical application of PDD and PDT in luminal tumors has gradually adapted to the disease characteristics. PDD is used to diagnose gastric cancer, allowing an objective diagnosis and not completely relying on the endoscopist’s clinical experience. Thus, it is a promising tool for diagnosing early peritoneal metastases in gastric cancer. Moreover, the simultaneous video endoscopy systems can image tumor sites in greater detail, improving PDD and PDT accuracy. PDT for unresectable cholangiocarcinoma is usually performed with duodenoscopy guided by endoscopic retrograde cholangiopancreatography (ERCP) and percutaneous transhepatic cholangioscopy (PTCS). Transoral digital cholangioscopy can shorten fluoroscopy time and reduce patient and physician radiation exposure. Regarding central lung cancer, PDT can be assisted by bronchoscopy and autofluorescence bronchoscopy. In peripheral lung cancer cases, the optical fiber can be placed under computed tomography or magnetic resonance imaging guidance. Furthermore, a new small-diameter laser probe, the composite-type optical fiberscope, was recently developed to enable non-invasive treatment. Blue-light cystoscopy assists in the diagnosis of non-muscle-invasive bladder cancer and has been recognized clinically to resolve the problem of residual tumors after transurethral resection. In conclusion, these new endoscopic devices make PDT and PDD more efficient, minimally invasive, and safe.
Here we summarize the clinical application status of PDT for luminal tumors. With the increasing clinical demand for PDT, endoscopic technology will be continuously optimized for luminal tumors, featuring improving device intelligence, minimally invasive usage, and modernization. The integration of emerging technologies will allow the products to perform more powerful functions, making PDT more diverse and further improving its surgical quality.
1 引言
光动力疗法(PDT)起源于20世纪70年代,是目前临床应用中达到细胞水平的肿瘤治疗技术[1],现已得到美国、英国、德国、法国、日本等国家政府相关部门的正式批准,成为肿瘤治疗的一项常规手段[2-3]。随着内窥镜及光纤等介入技术的发展,对于消化道、呼吸道等腔道肿瘤,PDT能够利用光源、光敏剂的双重靶向作用发挥出显著的治疗作用,避免了开胸、开腹等创伤性手术给患者带来的痛苦[4],降低了术后并发症的发生率。PDT可以使早期癌和癌前病变得到根治,中晚期癌获得姑息效果;此外,它还可以消除复发性病变,激活继发性免疫反应。
内窥镜是PDT的关键辅助设备,但其与光动力技术的融合仍不够完美。譬如,当前国内使用的传统内镜在治疗激光下会产生白屏现象,而且常规白光检测存在漏检问题[3,5-6],限制了PDT的实施和监测的准确性。精准、可控是PDT未来的发展方向。近年来,内窥镜技术的不断进步使其能够更好地服务于PDT的临床应用。本文从内窥镜技术角度出发,就光动力诊疗的发展展开讨论,并综述了其在腔道肿瘤光动力诊疗临床应用上的进展,以期为精准化肿瘤PDT提供指导。
2 PDT原理
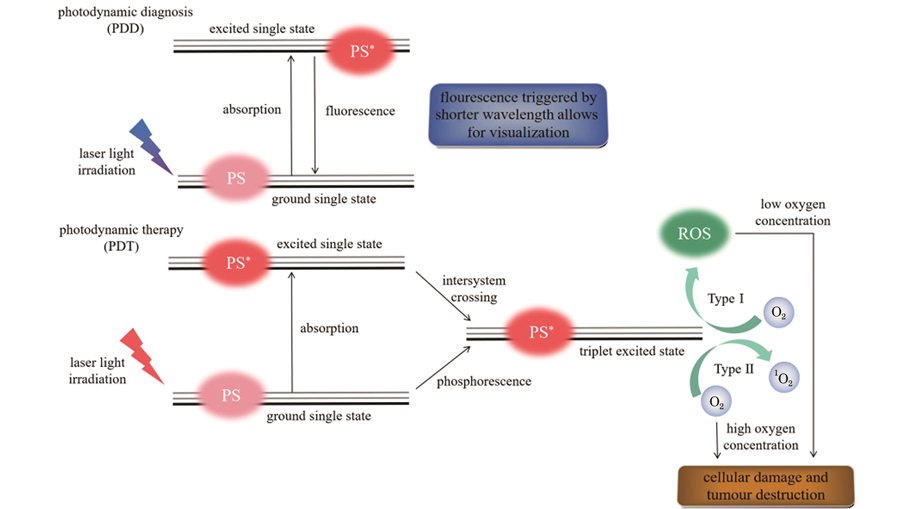
PDT是光、光敏剂和分子氧共同参与下的光敏化反应。PDT示意图如
光动力诊断(PDD)是利用光动力效应进行疾病诊断的一种方法。其原理是基态光敏剂受到与之波长匹配的激光激发后跃迁到激发态,从激发态退回基态过程中释放能量产生荧光[10]。因此,PDD也被称作为荧光诊断。在诊断过程中,正常组织内的光敏剂含量少不发光,而肿瘤组织会特异性地显现出荧光从而被标定。
3 腔道肿瘤光动力治疗内窥镜
3.1 内窥镜的应用现状
内窥镜是一种常用的医疗器械,可以通过自然腔道或人工建立的通道进入人体,辅助医生更高效便捷地诊断或治疗人体局部病灶,现已被应用于消化内科、呼吸科、耳鼻喉科、骨科、泌尿外科、妇科等专科疾病的诊治[11]。内窥镜自19世纪问世以来经历了硬管式内窥镜、半可屈式内窥镜、纤维内窥镜和电子内窥镜四代技术变革[12]。采用高性能微型图像传感技术替代光导纤维导像术的电子内窥镜具有图像更清晰、色彩更逼真、分辨率更高等优势,可供多人同时观察,目前已逐步取代了纤维内窥镜[13]。
电子内窥镜主要由三大系统组成,分别为窥镜系统、图像显示系统和照明系统[14]。电子内窥镜的成像原理为:用导光纤维将照明系统发出的光导入腔内,图像传感器接收到腔内黏膜的反射光后将光信号转换成电信号,再通过电缆将电信号输送到图像处理系统,图像处理系统对电信号进行存储和处理,并传输到电子屏上显示受检脏器的彩色黏膜图像[15-16]。医用电子内窥镜的图像传感器主要为电荷耦合元件CCD,它也是电子内窥镜的核心部件,其性能决定了内窥镜图像的质量。目前,电子内窥镜的成像方式有两种[17-18]:
1)顺次式成像。该成像方式采用的CCD仅能感受光信号的明暗强弱,只能得到黑白图像;在光源与导光纤维前搭载一块可高速旋转的红、绿、蓝三色滤光片圆板,光线通过滤镜顺次过滤后照明物体,反射光线被CCD感知并合成彩色图像。
2)同步式成像。该成像方式的内窥镜用彩色CCD芯片替代黑白CCD,将光照部位的反射光信号直接转换成彩色信号。彩色CCD是在黑白CCD表面加拜耳滤光片得到的,拜耳滤光片使得每个像素只能显示红、绿或蓝中的一种颜色。对于彩色CCD来说,当前像素点的真实彩色值是由与之相邻的若干像素点的色值通过插值法估算得到的,故其分辨率与同等像素的黑白CCD相比较低[19];但其消除了顺序成像在物体晃动时常出现的色彩割裂问题,色彩还原更为真实。
3.2 PDT中的激光可视化内窥镜
PDT以光纤作为载体输出治疗激光,柔性光纤可插入电子内窥镜的活检通道从而被送至腔道肿瘤部位。目前可用于PDT的内窥镜有胃镜、肠镜、喉镜、胆道镜、支气管镜、膀胱镜、宫颈镜等[20]。在顺次式成像内镜进行PDT期间,光纤输出的治疗光以及来自组织的散射光会导致内窥镜CCD过饱和,画面出现曝光和漂白现象,如
![激光照射期间两种视频内窥镜的比较[21]。(a)顺次式成像内窥镜下的“白屏”画面;(b)同步式成像内窥镜下可清晰分辨的激光光斑](/richHtml/zgjg/2023/50/9/0907202/img_04.jpg)
图 2. 激光照射期间两种视频内窥镜的比较[21]。(a)顺次式成像内窥镜下的“白屏”画面;(b)同步式成像内窥镜下可清晰分辨的激光光斑
Fig. 2. Comparison of two types of video endoscopes during laser irradiation[21]. (a)
Comparison of two types of video endoscopes during laser irradiation[21]. (a)
为了克服PDT内窥镜泛白问题,20世纪90年代,Marijnissen等[22]对可拆卸CCD摄像头的内窥镜装载了蓝绿色滤光片,通过滤掉治疗的红光实现了对光纤位置的实时监测。随后,研究人员在传统光纤镜和新电视系统组成的新设备上插入干涉滤光片和中性密度滤光片,进一步增加了CCD的灵敏度,实现了在监视器上以原色观察病变和激光光斑[23]。但这种自组装方法不适合集成的一体式内窥镜。还有报道称,通过更改自体荧光诊断系统SAFE-3000的快门速度为最快模式,可以减少对散射激光的捕获,从而确定激光的照射目标[24]。但快门速度调快的操作会使曝光时间变短,从而无法获得高质量图像。另有研究表明,基于图像增强技术对灰度CCD采集的光信号用直方图均衡化色彩校正算法进行后处理,可以实现内窥镜过度曝光区域图像颜色信息的自然校正[25]。随着图像处理技术的不断发展,对采集到的光信号进行图像后处理也是一种还原PDT治疗过程中真实图像的办法。
近年来,同步式成像内窥镜被证实更适合用于PDT。Sonokawa等[5]发现,在中心型肺癌PDT过程中使用他拉泊芬钠后,同步式视频内窥镜系统ELUXEO7000®在蓝色激光成像模式下不会出现白屏现象。同时,该系统能够在观察病变的同时进行激光照射,避免了激光照射不足引起的肿瘤残留或局部复发。
顾瑛院士团队[26]研制了可视化光动力治疗肿瘤的电子内窥镜系统。他们通过设计及制造微型光学系统、开发色彩补偿还原算法和术中光斑边界自动识别算法、进行系统集成与验证,实现了内窥镜下治疗光斑位置的可视与实时调控,弥补了普通内窥镜下PDT术中“白屏盲视”的过饱和盲视缺陷。截至2022年,该系统已被成功应用于食管癌、食管胃结合部癌、结直肠癌等多种消化道肿瘤的治疗,实现了术中的实时动态高质量可视,提高了PDT的准确性、可靠性和安全性。
3.3 同轴激光内窥镜
通常情况下,PDT的实施需要借助活检通道中插入激光光纤的内窥镜。内窥镜镜头和激光光纤的通道不同,如

图 3. 多通道内窥镜先端部示意图(光纤通过器材出口通道进入人体)
Fig. 3. Schematic of the tip of multi-channel endoscope (optical fiber enters the body through exit channel of the equipment)
Yamanaka等[27]在使用Nd∶YAG激光消融法治疗双胎输血综合征时,研制了一种激光光纤与光学图像光纤同轴耦合的复合光纤镜。该复合光纤镜能将激光束导航至视野中的任意一点,提高了激光的定位精度,但它是刚性结构,只能消融位于镜头前端的组织。参考这种同轴式内窥镜理念,Hu等[28]设计了用于PDT的柔性同轴激光内窥镜系统,利用偏振分束器以及陷波滤波器等技术将治疗激光与照明光耦合进同一根输送管。此后,Hu等[29]还进一步研发了兼具PDD和PDT功能的柔性同轴内窥镜系统,如
![柔性激光转向内窥镜示意图[29]。(a)激光内窥镜示意图;(b)实验装置](/richHtml/zgjg/2023/50/9/0907202/img_06.jpg)
图 4. 柔性激光转向内窥镜示意图[29]。(a)激光内窥镜示意图;(b)实验装置
Fig. 4. Illustration of flexible laser steering endoscope[29]. (a) Schematic illustration of laser endoscope; (b) experimental setup
3.4 荧光诊断内窥镜
常规内窥镜(WLE)检查可以大幅降低胃癌、结肠癌的发病率及病死率。然而,对于微小、扁平和凹陷病变,WLE难以区分癌前病变和非恶性黏膜[30]。利用荧光的差异检测可以反映出病变组织的黏膜厚度、血红蛋白浓度、荧光团浓度以及组织微环境差异。
荧光诊断可以分为两种:1)自体荧光诊断。生物组织受激光激发后,内源性荧光团(蛋白质、核酸和类脂化合物)吸收能量产生荧光,而肿瘤组织的理化特性与正常组织不同,因而对应的自体荧光光谱也存在特异性差异。2)药物诱导荧光诊断,也叫光动力诊断,即利用外源性光敏物质诱导产生荧光。光敏物质因具有亲肿瘤特性而在肿瘤组织与正常组织间形成显著的浓度差,在适当波长激光的照射下,病变组织发射出较强的荧光,而正常组织的吸收峰很弱,几乎不发光,基于此可将肿瘤和正常组织区分开来。
3.4.1 自体荧光诊断内窥镜
临床检测中用于自体荧光诊断的内窥镜有加拿大Xillix Technologies公司推出的光诱导荧光内窥镜(LIFE)系统、Olympus公司的自体荧光成像(AFI)系统以及日本Pentax公司基于彩色CCD组成的SAFE-3000自体荧光支气管镜。此类内窥镜通常包含两套光源(白光和激发光)以及两个CCD。以SAFE-3000为例,氙灯和二极管激光器分别为白光模式和自体荧光模式提供照明。在白光模式下,如
![SAFE-3000的工作原理[31]。(a)SAFE-3000在白光模式下的工作原理,其中,氙灯是白光模式下的激发光,红外光被红外截止滤光片消除,白光被镜头收集并通过视频内窥镜的光导传输到物体;(b)SAFE-3000在自体荧光模式下的工作原理,其中,二极管激光器是自体荧光(AF)模式下的激发光源,物镜消除激发光并仅从目标捕获自体荧光](/richHtml/zgjg/2023/50/9/0907202/img_07.jpg)
图 5. SAFE-3000的工作原理[31]。(a)SAFE-3000在白光模式下的工作原理,其中,氙灯是白光模式下的激发光,红外光被红外截止滤光片消除,白光被镜头收集并通过视频内窥镜的光导传输到物体;(b)SAFE-3000在自体荧光模式下的工作原理,其中,二极管激光器是自体荧光(AF)模式下的激发光源,物镜消除激发光并仅从目标捕获自体荧光
Fig. 5. Operating principle of SAFE-3000[31]. (a) Operating principle of SAFE-3000 at white light mode, where a xenon lamp is used for excitation light for white light mode, infrared light is eliminated by an infrared cut filter and white light is collected by the lens and transmitted to the object through light guide of the videoendoscope; (b) operating principle of SAFE-3000 at autofluorescence, where a diode laser is used as an autofluorescence mode excitation light source,the objective lens eliminates excitation light and captures only autofluorescence from the target
使用自体荧光支气管镜SAFE-3000与他拉泊芬钠的PDD可以清楚地检测到肿瘤的红色荧光,从而可以准确确定肿瘤范围[32]。遗憾的是,SAFE-3000已停止在市场上销售。Sonokawa等[5]评估了自体荧光诊断内窥镜系统用于PDD的效果。他们使用自体荧光诊断内窥镜检出肿瘤为洋红色病变,而在给予他拉泊芬钠4 h后,白光检测依然可以观察到病变组织,但自体荧光诊断内窥镜视野中的肿瘤病变没有呈现洋红色。这可能是因为肿瘤内聚集的他拉泊芬钠吸收了自体荧光诊断内窥镜系统发出的蓝光,从而产生假阴性结果。自体荧光诊断内窥镜的灵敏度很高但特异性较低,而且含有两种通道系统的内窥镜镜体更粗,使用起来较为笨重,价格也更贵,因此目前很少用于临床诊断。
3.4.2 基于PDD的新型内窥镜系统
相较于自体荧光,光敏剂产生的荧光的强度更高,且其发射光谱会向更长的波长偏移,这些因素都会增加肿瘤组织与正常组织的对比度,更有利于诊断与定位。同时,PDT过程中光敏剂不断被消耗,PDD能够根据荧光的衰减程度间接地反映肿瘤组织中剩余的光敏剂含量[33],如此一来,PDD可以通过实时检测术中的荧光强度来估计光动力治疗的效率。
日本Fujifilm公司开发了用于上消化道PDD的新型内窥镜系统Sie-P1。Sie-P1是一款具有半导体激光光源的PDD一体式内窥镜,其可在检查期间即时激发蓝光进行荧光诊断[34]。之后,该公司还开发了第二代内窥镜系统Sie-P2,该系统具有白光、窄带成像和PDD模式,克服了上一代内窥镜系统由滤光片造成的拍摄图像较暗的问题。德国Karl Storz公司研发了专门用于PDD的柔性视频膀胱镜D-Light系统,该系统基于300 W氙弧灯同时配备带通滤光片对蓝光进行传输(激发波长为375~445 nm),HOPKINS PDD目镜上集成的长通滤光片可以阻挡过多的蓝光(荧光发射波长为600~740 nm),IMAGE1 S™HX-P FI单芯片全高清摆式摄像头可在用于荧光观察的蓝光模式和用于常规观察的白光模式之间即时切换[35]。
3.5 光动力诊疗一体内窥镜
尽管荧光诊断内窥镜具有更好的可视性,但目前其还不具有对肿瘤等疾病进行治疗的功能。以往的内窥镜技术很少能同时实现PDD和PDT,使用两种内窥镜面临以下问题:1)增加了操作医生和患者的负担;2)切换内窥镜时,通过PDT内窥镜很难找到完全相同的区域;3)目前的技术无法控制激光照射的范围,可能会损伤肿瘤周围的正常组织或血管,从而导致严重的并发症。因此,实现诊断与治疗功能为一体的多功能内窥镜设备是精准化PDT的发展趋势,光动力诊疗一体有助于肿瘤病灶的准确定位、组织的靶向照射以及照射结果的检验。
上文提到的放大视频内窥镜XG-0001是基于市售EG-590ZW型内窥镜研制的,配备了405 nm锐切滤波器,不仅能够进行PDD,还能对肿瘤进行PDT。Hu等[29]研发的柔性同轴内窥镜系统不仅可以在PDD和PDT模式下捕获图像,还可以在PDT过程中准确地将激光传输至靶组织区域。上述实现PDD-PDT的一体式内窥镜中集成的蓝光皆是针对5-氨基乙酰丙酸(ALA)光敏剂开发的,因此,此类内窥镜的激发波长较为单一,且ALA仍然存在着假阳性的问题[36]。除ALA之外,卟吩姆钠、吲哚菁绿、金丝桃素等也被批准用于临床PDD,各类光敏剂的激发波长不尽相同[37]。笔者认为,研发具有多种波长激发光源的PDD-PDT一体式内窥镜有望使PDT的精准化应用更加广泛。
除了PDD之外,采用其他诊断方式的内窥镜也会对光动力诊疗一体化有所帮助。Lee等[38]设计了一种多模式智能内窥镜系统,该系统结合了透明生物电子设备与治疗性纳米颗粒;在PDT过程中,该内窥镜前端的透明生物电子设备、阻抗及pH传感器等对肿瘤进行定位并检测其pH值、温度和荧光强度等信息,同时进行实时反馈,实现了动态诊断与治疗。另外,诊断与治疗的激光光源可以整合为多波长的激光模块,使输出光耦合进同一光纤,无需内窥镜配备激光光源[39]。此类设备的研发是除内窥镜之外光动力诊疗一体化发展的另一种思路。如此一来,不仅简化了仪器的空间结构,还有助于隐匿病灶的检出以及术中治疗的精准化。总而言之,光动力诊疗一体化的实现不仅涉及激光技术与光敏剂的发展,还涉及医疗器械工程、图像处理、人工智能等技术[40],更加符合现代化智能诊疗的要求。
4 内窥镜下的光动力诊疗在腔道肿瘤中的应用
4.1 胃癌
胃癌是最常见的消化道肿瘤,大部分患者在初诊时病情已发展为局部晚期,甚至发生转移,而且晚期胃癌尤其是腹膜转移患者的预后很差。因此,胃癌的诊断是提高治愈率的关键。PDD能够有效发现微小及微转移病灶,常用的光敏剂是ALA。ALA是一种天然氨基酸衍生物,它是原卟啉IX(PpIX)的内源性底物和前体。PpIX是生物合成途径中的血红素前体,在405 nm蓝紫光激发下会发出强烈的红色荧光[41]。ALA介导的PDD能够实现术中实时荧光检测和癌细胞的特异性观察,以此判断切除肿瘤的边缘,特别是在腹膜播散和淋巴结转移的诊断方面有显著优势。Kishi等[42]对比了单纯白光检测与白光下ALA-PDD的检出率,结果显示:52例患者中有24例在白光检查中没有检测到腹膜播散,而ALA-PDD在这24例中检测到了5例有腹膜播散。这一结果表明ALA-PDD对于隐匿性转移具有更高的检测灵敏度。
Nakamura等[21]对口服5-ALA加静脉注射卟吩姆钠的5名早期浅表型胃癌患者进行了PDD与PDT。作为内镜黏膜下剥离术(ESD)的术后辅助治疗手段,PDT可以明显缩小肿瘤体积,达到71.4%(5/7)的完全缓解。基于放大视频内窥镜XG-0001对胃体大弯处的异时性浅表性早期胃癌的治疗过程如
![1例位于胃体大弯处的异时性浅表性早期胃癌ESD后的治疗过程[21]。(a)PDT前:0-Ⅱa+Ⅱc(箭头所示)和ESD后的瘢痕(圆圈);(b)使用圆柱形光纤进行EDL(准分子染料激光)照射期间;(c)PDT后一周;(d)PDT后6个月](/richHtml/zgjg/2023/50/9/0907202/img_08.jpg)
图 6. 1例位于胃体大弯处的异时性浅表性早期胃癌ESD后的治疗过程[21]。(a)PDT前:0-Ⅱa+Ⅱc(箭头所示)和ESD后的瘢痕(圆圈);(b)使用圆柱形光纤进行EDL(准分子染料激光)照射期间;(c)PDT后一周;(d)PDT后6个月
Fig. 6. Treatment course of a metachronous superficial early gastric cancer located in greater curvature of gastric body after ESD[21]. (a) Before PDT: 0-Ⅱa+Ⅱc (indicated by arrows) and a scar after ESD (circle); (b) during irradiation with an EDL using cylindrical fiber; (c) one week after PDT; (d) six months after PDT
4.2 不可切除胆管癌
胆管癌起病隐匿,切缘阴性的完全肿瘤切除是标准治愈选择唯一可能的根治性治疗方法,然而只有20%~30%的患者有机会进行根治性切除。通常情况下,对不可切除胆管癌进行PDT有两种途径:一是内镜逆行胰胆管造影(ERCP),二是经皮经肝胆道镜技术(PTCS)。ERCP是诊断和治疗胆道疾病的重要方法,实施ERCP介导的胆管癌PDT通常是借助十二指肠镜经口经乳头入路,将导丝及光纤在透视引导下送至作用部位。目前,ERCP已经是胆管癌PDT中的标准治疗方法。然而,正是X射线的透视引导,ERCP无法准确地显示纵向的扩散程度,不能精确地评估病灶对治疗的反应。PTCS介导的PDT是在胆道镜直视下进行的,可以实现更有效、均匀的靶区照射。在进行PTCS前需要实施经皮经肝胆管引流术(PTBD),PTBD引流管需要一直保留,直到最后一次PDT治疗,以便重复检测和治疗[43]。PTBD的缺点是整个手术持续时间较长,而且PTBD引流可能会导致胆汁中的癌细胞扩散。有文献报道了肝门部胆管癌术前经PTBD胆汁引流后出现了肿瘤扩散(6.3%,3/48)[44]。
另外,胆管癌PDT还可以通过经口胆道镜操作。Talreja等[45]使用SpyGlassTM胆道子镜光纤直视系统进行了单操作胆道镜(SOC)指导放置光纤的PDT;相比于ERCP-PDT,SOC-PDT可以真实地还原病灶部位的图像,突破了传统二维体外图像诊断与治疗的准确率,干预组的生存期平均增加了186 d。SOC属于第一代胆道镜。此外,研究人员还证实了使用第二代数字胆道镜对不可切除胆管癌进行治疗是可行的,图像传输质量和图像处理都有了显著提高,进一步提高了治疗效果[46-47]。在与标准PDT的疗效没有明显差异的情况下,使用胆道镜进行PDT缩短了透视时间,减少了患者与治疗医师的辐射暴露。
4.3 肺癌
根据发病部位的不同,肺癌可分为中心型和外周型两类,肿瘤细胞分别起源于支气管和肺实质。日本在1994年批准了使用卟吩姆钠的中心型早期肺癌的光动力治疗,支气管镜PDT现已成为日本中心型早期肺癌的标准治疗方案[48]。目前,PDT在肺癌的临床治疗上主要针对的是尚未扩散到肺部以外的浅表性非小细胞肺癌,尤其是借助支气管镜就很容易将治疗光纤送达至肿瘤部位的肺癌[49]。Usuda等[32]在自体荧光支气管镜SAFE-3000的引导下使用光敏剂单天冬氨酰二氢卟酚e6(NPe6)对29名中心型肺癌患者实施了PDD和PDT,PDD准确地判断了肿瘤边缘,完全缓解率为92.1%(35/38);SAFE-3000还确认了PDT后肿瘤中的NPe6都已被激发,无需额外进行激光治疗。
外周型肺癌的光动力治疗案例较少,常见的治疗方式是通过CT或超声等引导光纤经皮进入体内,进行实质PDT[50]。Allison等[51]通过磁导航支气管镜辅助放置光纤成功消融了位于外周的原发性肺肿瘤。以上经皮入路的肺癌PDT均形成了创口。Usuda等[52]设计了一种外径仅为1.0 mm的新型激光探针复合型光纤镜,如
![复合型光纤内窥镜(COF)[52]。(a)外径为1.0 mm的复合型光纤镜的尖端,红色箭头表示激光照射端口,黄色箭头表示图像传输端口,两个端口周围有许多用于传递白光的光纤;(b)复合型光纤镜的激光探头是直型探头;(c)复合型光纤镜显示的周围型肺癌病变图像(红色箭头显示肿瘤)](/richHtml/zgjg/2023/50/9/0907202/img_09.jpg)
图 7. 复合型光纤内窥镜(COF)[52]。(a)外径为1.0 mm的复合型光纤镜的尖端,红色箭头表示激光照射端口,黄色箭头表示图像传输端口,两个端口周围有许多用于传递白光的光纤;(b)复合型光纤镜的激光探头是直型探头;(c)复合型光纤镜显示的周围型肺癌病变图像(红色箭头显示肿瘤)
Fig. 7. Composite-type optical fiberscope (COF)[52]. (a) Tip of composite-type optical fiberscope with an external diameter of 1.0 mm, where the red arrows show the port of laser irradiation, the yellow arrows show the port of image transmission, and there are a lot of fibers that pass white light around the two ports; (b) composite-type optical fiberscope has a straight-type laser probe; (c) image of peripheral-type lung cancer lesion as visualized by composite-type optical fiberscope (the red arrow shows the tumor)
4.4 浅表性膀胱癌
膀胱是一个相对薄壁的空腔器官,加上可见光的穿透性有限,因此,PDT特别适用于浅表性膀胱癌的治疗。1993年,加拿大批准了将卟吩姆钠用于治疗膀胱癌,目前国内外已报道了大量膀胱癌PDT的病例。随着蓝光膀胱镜技术的出现,相较于治疗性PDT,泌尿外科更倾向于用光敏剂诱导的PDD来辅助经尿道切除术(TURBT)[36,53-54]。
蓝光膀胱镜检查使用光敏剂实施膀胱灌注,并借助能够发射蓝光的荧光膀胱镜进行肿瘤诊断。蓝光膀胱镜检查不仅可以提供良好的可视化效果,还可以在TURBT期间实现对残留肿瘤组织和原位癌的检测,从而降低复发率。目前临床上通常使用ALA及其衍生物氨基乙酰丙酸己酯(HAL)膀胱灌注引导荧光膀胱镜对肿瘤进行诊断,二者在PDD引导的TURBT中效果相当[55]。由于药理优势,HAL所需的滴注时间更短,在白光下更稳定,荧光强度更高,并于2010年被美国食品药品监督管理局批准在美国上市,用于诊断膀胱癌[56]。HAL引导的蓝光膀胱镜辅助诊断非肌肉浸润性膀胱癌已得到临床认可[57-58]。
蓝光膀胱镜可实现白光和蓝光两种模式的自由切换,以对比荧光与常规观察图像。对比时系统仅能显示一种模式的实时图像,操作者需要来回切换模式。此外,蓝光模式下活检病变区域的照明强度不足。Fukuhara等[59]将SAFE-3000处理系统与宾得EB-1970AK柔性膀胱镜相结合组成了新的PDD系统。该新系统可在同一屏幕上同时观察蓝光模式与白光模式下的实时图像。双模式不仅提供了足够的照明,还能在白光模式下获得红色荧光组织,防止病变区域的光漂白,实现肿瘤的完整切除。
另外,柔性的蓝光膀胱镜不存在传统刚性荧光膀胱镜由于观察范围有限(膀胱三角区和颈部)而使红色荧光沿切线方向增强(切向效应)从而产生假阳性的问题[59],也弥补了柔性荧光膀胱镜敏感度低的缺陷。蓝光柔性膀胱镜与刚性系统的有机结合将有助于更多适应证的诊断[60]。
5 结束语
PDT是一种基于光的无创介入治疗,具有广谱、高效、低副作用和可协同治疗等优势。通过内窥镜精准靶向治疗腔内肿瘤已成为食管癌、中央型肺癌的标准术式。在靶向肿瘤光动力治疗过程中,内窥镜作为重要的辅助设备,具有以下重要作用:1)在术前对病变组织进行精确辨别;2)在术中提供实时高清的操作视野,引导激光光纤发射治疗光覆盖肿瘤并检测其反应;3)术后评估治疗效果。随着内窥镜设备的进一步发展以及科研工作者的持续研发,辅助PDT治疗的新型内窥设备应运而生,如激光可视化内窥镜、同轴激光内窥镜及荧光诊断内窥镜等。内窥镜设备的创新发展对于光动力诊疗技术的临床实践起到了优化作用,在降低PDT操作技术难度的同时缩短了手术用时。在腔道肿瘤的临床治疗中,针对胃癌、不可切除胆管癌、外周型肺癌及浅表性膀胱癌选用放大视频内窥镜、数字胆道镜、复合型光纤内镜、蓝光膀胱镜等进行PDT可使手术更加精准化、可视化、无创化,从而使得PDT有望成为更多腔道肿瘤的重要治疗方式。
然而,内窥镜的共性问题(如成像分辨率差、荧光色彩对比不明显、受视线角度影响大等)不可忽视,仍需发展核心光学技术、图像信息处理技术等,不断升级设备[61],进一步提高PDT的手术质量。纵观国内外内窥镜研发的趋势,未来内窥镜会向着智能化、微创化、现代化方向发展,融合新兴技术衍生出功能更加强大的产品,使PDT的治疗模式更加多元化。目前,国内临床光动力诊疗大多依赖进口内窥镜,这类设备价格高昂,只有少数医院有能力开展高效率的腔道肿瘤PDT,极大地限制了国内PDT的临床应用。因此,国产化内窥镜的普及对于PDT在我国的大范围应用具有重要意义。另外,PDT的辅助治疗设备,如光源、光纤等,也正在根据不断扩大的适应证范围逐步发展。未来,光动力诊疗将在肿瘤防治方面具有更广阔的应用前景。
[1] 李黎波, 李文敏, 项蕾红, 等. 光动力疗法在中国的应用与临床研究[J]. 中国激光医学杂志, 2012, 21(5): 278-307.
Li L B, Li W M, Xiang L H, et al. Photodynamic therapy: clinical research and application in China[J]. Chinese Journal of Laser Medicine&Surgery, 2012, 21(5): 278-307.
[2] 雷曼, 逄雯, 石擘, 等. 基于核仁靶向碳点的双光子光动力疗法研究[J]. 中国激光, 2022, 49(15): 1507104.
[3] Kwiatkowski S, Knap B, Przystupski D, et al. Photodynamic therapy-mechanisms, photosensitizers and combinations[J]. Biomedicine & Pharmacotherapy, 2018, 106: 1098-1107.
[4] 王占宇, 陈刚. 空腔脏器肿瘤的光动力治疗进展[J]. 现代肿瘤医学, 2016, 24(8): 1329-1332.
Wang Z Y, Chen G. Advance in photodynamic therapy for hollow viscus tumor[J]. Journal of Modern Oncology, 2016, 24(8): 1329-1332.
[5] Sonokawa T, Matsumoto M, Takegahara K, et al. Usefulness of simultaneous type image-enhanced endoscope system in photodynamic therapy for centrally located lung cancer[J]. Photodiagnosis and Photodynamic Therapy, 2021, 35: 102345.
[6] Lam S, Kennedy T, Unger M, et al. Localization of bronchial intraepithelial neoplastic lesions by fluorescence bronchoscopy[J]. Chest, 1998, 113(3): 696-702.
[7] Allison R R, Moghissi K. Photodynamic therapy (PDT): PDT mechanisms[J]. Clinical Endoscopy, 2013, 46(1): 24-29.
[8] Allison R R. Photodynamic therapy: oncologic horizons[J]. Future Oncology (London, England), 2014, 10(1): 123-124.
[9] Reginato E, Wolf P, Hamblin M R. Immune response after photodynamic therapy increases anti-cancer and anti-bacterial effects[J]. World Journal of Immunology, 2014, 4(1): 1-11.
[10] Endlicher E, Messmann H. Photodynamic diagnosis in the gastrointestinal tract[J]. Gastrointestinal Endoscopy Clinics of North America, 2004, 14(3): 475-485.
[11] 汪长岭, 朱兴喜, 黄亚萍, 等. 内窥镜成像新技术原理及应用[J]. 中国医学装备, 2018, 15(4): 125-129.
Wang C L, Zhu X X, Huang Y P, et al. Principles and applications of new imaging technology of endoscope[J]. China Medical Equipment, 2018, 15(4): 125-129.
[12] 吕平, 刘芳, 吕坤章, 等. 内窥镜发展史[J]. 中华医史杂志, 2002(1): 10-14.
Lü P, Liu F, Lü K Z, et al. A developmental history of endoscopy[J]. China Journal of Medical History, 2002(1): 10-14.
[13] 张雯雯, 周正东, 管绍林, 等. 电子内窥镜的研究现状及发展趋势[J]. 中国医疗设备, 2017, 32(1): 93-98.
Zhang W W, Zhou Z D, Guan S L, et al. Research progress and development tendency of electronic endoscope[J]. China Medical Devices, 2017, 32(1): 93-98.
[14] 鲍玉冬, 齐东博, 魏雯, 等. 医用内窥镜装置的研究进展[J]. 哈尔滨理工大学学报, 2021, 26(5): 25-33.
Bao Y D, Qi D B, Wei W, et al. Research progress of medical endoscope device[J]. Journal of Harbin University of Science and Technology, 2021, 26(5): 25-33.
[15] 曹兴. 医用电子内镜的工作原理和使用维护[J]. 中国内镜杂志, 2010, 16(8): 894-896.
Cao X. Working principle and maintenance of medical electronic endoscope[J]. China Journal of Endoscopy, 2010, 16(8): 894-896.
[16] 张渤晗, 颛孙跃忠. 内窥镜成像系统[J]. 电子测试, 2020(2): 119-120.
Zhang B H, Zhuansun Y Z. Endoscopic imaging system[J]. Electronic Test, 2020(2): 119-120.
[17] 方萍. 电子内窥镜的技术进展[J]. 医疗卫生装备, 2003, 24(9): 20-21.
Fang P. Technical development of the electronic video endoscope system[J]. Medical Equipment Journal, 2003, 24(9): 20-21.
[18] 雷子镇. 电子内镜的工作原理及维修[J]. 医疗装备, 2017, 30(19): 87-88.
Lei Z Z. Discussion on the principle of electronic endoscope and maintenance case[J]. Medical Equipment, 2017, 30(19): 87-88.
[19] 王清泉. 基于CCD的浊度检测技术研究与应用[D]. 长沙: 长沙理工大学, 2012.
WangQ Q. The research and application of turbidity detection technology based on CCD[D]. Changsha: Changsha University of Science & Technology, 2012.
[20] 高社干, 魏洛霞, 王立东, 等. 肿瘤光动力治疗的研究现状与展望[J]. 郑州大学学报(医学版), 2008, 43(3): 405-411.
Gao S G, Wei L X, Wang L D, et al. Research status and prospect of photodynamic therapy for tumor[J]. Journal of Zhengzhou University (Medical Sciences), 2008, 43(3): 405-411.
[21] Nakamura T, Oinuma T, Yamagishi H, et al. Evaluation of a novel high-resolution magnifying videoendoscope that is capable of photodynamic diagnosis and therapy for gastric cancer[J]. Photodiagnosis and Photodynamic Therapy, 2015, 12(1): 115-122.
[22] Marijnissen J P, Boot H, Baas P. Use of sheet color filters for video-endoscopic observation during intraluminal photodynamic therapy[J]. Lasers in Surgery and Medicine, 1996, 18(1): 96-99.
[23] Mimura S, Narahara H, Murakami T, et al. A new technique for improving visualization of mucosal lesions during endoscopic photodynamic therapy[J]. Diagnostic and Therapeutic Endoscopy, 2000, 6(4): 147-152.
[24] Ikeda N, Usuda J, Kato H, et al. New aspects of photodynamic therapy for central type early stage lung cancer[J]. Lasers in Surgery and Medicine, 2011, 43(7): 749-754.
[25] 刘诗源. 基于内窥镜的图像增强及色彩矫正方法研究[D]. 保定: 河北大学, 2017.
LiuS Y. Study on enhancement and color correction method of endoscopic images[D]. Baoding: Hebei University, 2017.
[26] 邵永红, 顾瑛. 具有可视化和显示光斑边界功能的光动力治疗系统: CN107137824A[P]. 2019-07-16.
ShaoY H, GuY. A photodynamic therapy system with visualization and spot boundaries display: CN107137824A[P]. 2019-07-16.
[27] Yamanaka N, Yamanaka H, Masamune K, et al. An endoscope with 2 DOFs steering of coaxial Nd∶YAG laser beam for fetal surgery[J]. IEEE/ASME Transactions on Mechatronics, 2010, 15(6): 898-905.
[28] Hu Y, Masamune K. Flexible coaxial laser endoscope with arbitrarily selected spots in endoscopic view for photodynamic tumor therapy[J]. Applied Optics, 2016, 55(30): 8433-8440.
[29] Hu Y, Masamune K. Flexible laser endoscope for minimally invasive photodynamic diagnosis (PDD) and therapy (PDT) toward efficient tumor removal[J]. Optics Express, 2017, 25(14): 16795-16812.
[30] Elahi S F, Wang T D. Future and advances in endoscopy[J]. Journal of Biophotonics, 2011, 4(7/8): 471-481.
[31] Ikeda N, Honda H, Hayashi A, et al. Early detection of bronchial lesions using newly developed videoendoscopy-based autofluorescence bronchoscopy[J]. Lung Cancer, 2006, 52(1): 21-27.
[32] Usuda J, Tsutsui H, Honda H, et al. Photodynamic therapy for lung cancers based on novel photodynamic diagnosis using talaporfin sodium (NPe6) and autofluorescence bronchoscopy[J]. Lung Cancer, 2007, 58(3): 317-323.
[33] 李文博, 沈毅, 李步洪. 光学成像技术在光动力剂量监测中的应用进展[J]. 中国激光, 2020, 47(2): 0207006.
[34] Isomoto H, Nanashima A, Senoo T, et al. In vivo fluorescence navigation of gastric and upper gastrointestinal tumors by 5-aminolevulinic acid mediated photodynamic diagnosis with a laser-equipped video image endoscope[J]. Photodiagnosis and Photodynamic Therapy, 2015, 12(2): 201-208.
[35] Nohara T, Kamijima T, Fukuda R, et al. Variations in photodynamic diagnosis for bladder cancer due to the quality of endoscopic equipment[J]. Photodiagnosis and Photodynamic Therapy, 2022, 37: 102628.
[36] Casas A. Clinical uses of 5-aminolaevulinic acid in photodynamic treatment and photodetection of cancer: a review[J]. Cancer Letters, 2020, 490: 165-173.
[37] 李步洪, 陈天龙, 林立, 等. 光动力疗法基础研究与临床应用的新进展[J]. 中国激光, 2022, 49(5): 0507101.
[38] Lee H, Lee Y, Song C, et al. An endoscope with integrated transparent bioelectronics and theranostic nanoparticles for colon cancer treatment[J]. Nature Communications, 2015, 6: 10059.
[39] 舒展. 带有荧光诊断与光动力治疗功能的硬式内窥镜导光结构研究[D]. 天津: 天津医科大学, 2012.
ShuZ. Study on photoconductive structure of endoscopy with functions of fluorescence diagnosis and photodynamic therapy[D]. Tianjin: Tianjin Medical University, 2012.
[40] 李阳曦, 胡成全, 马龙飞, 等. 智能化精准光学诊疗技术研究进展[J]. 中国激光, 2021, 48(15): 1507002.
[41] 陈晓华. 5-氨基乙酰丙酸-光动力疗法对人食管癌效应及其机制研究[D]. 广州: 南方医科大学, 2010. 10.1007/s10103-010-0810-0
ChenX H. Effect and mechanism of 5-aminolevulinic acid-mediated photodynamic therapy in esophageal cancer[D]. Guangzhou: Southern Medical University, 2010.
[42] Kishi K, Fujiwara Y, Yano M, et al. Diagnostic laparoscopy with 5-aminolevulinic-acid-mediated photodynamic diagnosis enhances the detection of peritoneal micrometastases in advanced gastric cancer[J]. Oncology, 2014, 87(5): 257-265.
[43] Lee T Y, Cheon Y K, Shim C S. Photodynamic therapy in patients with advanced hilar cholangiocarcinoma: percutaneous cholangioscopic versus peroral transpapillary approach[J]. Photomedicine and Laser Surgery, 2016, 34(4): 150-156.
[44] Li Z Y, Jiang X F, Xiao H, et al. Long-term results of ERCP- or PTCS-directed photodynamic therapy for unresectable hilar cholangiocarcinoma[J]. Surgical Endoscopy, 2021, 35(10): 5655-5664.
[45] Talreja J P, DeGaetani M, Sauer B G, et al. Photodynamic therapy for unresectable cholangiocarcinoma: contribution of single operator cholangioscopy for targeted treatment[J]. Photochemical & Photobiological Sciences, 2011, 10(7): 1233-1238.
[46] Saumoy M, Kumta N A, Kahaleh M. Digital cholangioscopy for targeted photodynamic therapy of unresectable cholangiocarcinoma[J]. Gastrointestinal Endoscopy, 2016, 84(5): 862.
[47] Brunaldi V O, Brunaldi J E, Vollet-Filho J D, et al. Photodynamic therapy of extrahepatic cholangiocarcinoma using digital cholangioscopy[J]. Brazilian Archives of Digestive Surgery, 2020, 33(1): e1490.
[48] Wang K, Yu B X, Pathak J L. An update in clinical utilization of photodynamic therapy for lung cancer[J]. Journal of Cancer, 2021, 12(4): 1154-1160.
[49] Maziak D E, Markman B R, MacKay J A, et al. Photodynamic therapy in nonsmall cell lung cancer: a systematic review[J]. The Annals of Thoracic Surgery, 2004, 77(4): 1484-1491.
[50] Okunaka T, Kato H, Tsutsui H, et al. Photodynamic therapy for peripheral lung cancer[J]. Lung Cancer, 2004, 43(1): 77-82.
[51] Allison R R, Bansal S. Photodynamic therapy for peripheral lung cancer[J]. Photodiagnosis and Photodynamic Therapy, 2022, 38: 102825.
[52] Usuda J, Inoue T, Tsuchida T, et al. Clinical trial of photodynamic therapy for peripheral-type lung cancers using a new laser device in a pilot study[J]. Photodiagnosis and Photodynamic Therapy, 2020, 30: 101698.
[53] Stenzl A, Burger M, Fradet Y, et al. Hexaminolevulinate guided fluorescence cystoscopy reduces recurrence in patients with nonmuscle invasive bladder cancer[J]. The Journal of Urology, 2010, 184(5): 1907-1914.
[54] Juan P L, Hernández C, Solsona E, et al. Effectiveness of hexaminolevulinate fluorescence cystoscopy for the diagnosis of non-muscle-invasive bladder cancer in daily clinical practice: a Spanish multicentre observational study[J]. BJU International, 2015, 116(1): 37-43.
[55] Oude Elferink P, Witjes J A. Blue-light cystoscopy in the evaluation of non-muscle-invasive bladder cancer[J]. Therapeutic Advances in Urology, 2014, 6(1): 25-33.
[56] Daneshmand S, Schuckman A K, Bochner B H, et al. Hexaminolevulinate blue-light cystoscopy in non-muscle-invasive bladder cancer: review of the clinical evidence and consensus statement on appropriate use in the USA[J]. Nature Reviews Urology, 2014, 11(10): 589-596.
[57] Witjes J A, Babjuk M, Gontero P, et al. Clinical and cost effectiveness of hexaminolevulinate-guided blue-light cystoscopy: evidence review and updated expert recommendations[J]. European Urology, 2014, 66(5): 863-871.
[58] Hermann G G, Mogensen K, Carlsson S, et al. Fluorescence-guided transurethral resection of bladder tumours reduces bladder tumour recurrence due to less residual tumour tissue in Ta/T1 patients: a randomized two-centre study[J]. BJU International, 2011, 108(2): E297-E303.
[59] Fukuhara H, Kureishi M, Khoda T, et al. The utility of a flexible fluorescence-cystoscope with a twin mode monitor for the 5-aminolevulinic acid-mediated photodynamic diagnosis of bladder cancer[J]. PLoS One, 2015, 10(9): e0136416.
[60] Witjes J A, Moonen P M J, van der Heijden A G. Comparison of hexaminolevulinate based flexible and rigid fluorescence cystoscopy with rigid white light cystoscopy in bladder cancer: results of a prospective phase II study[J]. European Urology, 2005, 47(3): 319-322.
[61] 陈庆. 医用内窥镜关键技术的研究[J]. 中国医疗设备, 2015, 30(4): 60, 68-70.
Chen Q. Research on key technologies of the medical endoscope system[J]. China Medical Devices, 2015, 30(4): 60, 68-70.
Article Outline
赵萌, 王荣峰, 路倚文, 张晓刚, 吴荣谦, 吕毅, 庞利辉. 腔道肿瘤光动力诊疗内窥技术的发展及临床应用现状[J]. 中国激光, 2023, 50(9): 0907202. Meng Zhao, Rongfeng Wang, Yiwen Lu, Xiaogang Zhang, Rongqian Wu, Lü Yi, Lihui Pang. Development and Clinical Application of Endoscopic Techniques in Photodynamic Therapy for Luminal Tumors[J]. Chinese Journal of Lasers, 2023, 50(9): 0907202.