脉冲CO2激光诱导液体微射流动力学特性及应用研究
Currently, liquid micro-jet systems induced by pulsed lasers have been applied in surgery, which not only has the anatomical function of the traditional scalpel, but also has the characteristics of intact preservation of blood vessels. It has been used in the treatment of various organs and has rapidly developed. The laser sources of laser-induced micro?jet devices are mainly Er∶YAG, Nd∶YAG, Ho∶YAG and near-infrared (NIR) semiconductor lasers. Most jet emitters use rubber cortices for the energy transfer. However, the efficiency of the jet generated by these devices is low. According to the latest research on a 10.6 μm CO2 laser, the wavelength of the laser is close to the absorption wavelength of water, and the laser can be coupled with a zinc selenide lens, which has better performance for generating micro-jets and greatly improves the probability of jet generation. However, there are no reports on the liquid micro?jet device induced by this wavelength laser, and the influencing factors of the micro?jet generated by this wavelength laser have rarely been studied. Therefore, we designed a 10.6 μm CO2 laser-induced liquid micro-jet device, elaborated the mechanism of laser-induced micro?jet generation, explored the influence of liquid parameters and light dose parameters on laser-induced micro?jet generation, and evaluated the feasibility of the device technology for tissue-selective cutting and other aspects.
In this experiment, a 10.6 μm CO2 laser was used as the induction device for the laser-induced jet (laser power P was set to 18-25 W). Quartz glass with a length of 2 cm, cross-section diameter of 1 cm, and conical angle of 14° at the lower end was used as the jet generation chamber, and the laser beam was focused to a point in the generation chamber through a ZnSe focusing lens. In addition, in this experiment, the distance D between the laser focus and zinc selenide lens and the distance S between the nozzle and model were varied from 3 mm to 12 mm. A high-speed camera was combined with a prime lens and a digital microscope to carry out systematic research on the generation of laser-induced jets, interaction with biomimetic biological tissue, penetration depth and other three-dimensional spatial changes, and corresponding ultrafast process.
In the experiment, we observed four different jet shapes: column (CL), mushroom (MS), needle (AC), and turbulent (TS) [Fig. 3(a)-(d)]. The turbulent and needle jet velocities can reach 44.17 and 53.31 m/s, respectively[Fig. 4(a)]. The experimental results show that the diameter of the jet tip is typically in the range of 40-100 μm, and the diameter of the thicker part is usually 600-750 μm [Fig. 4(b)]. When D is fixed at 3 mm and the incident laser power P (18-25 W) is changed, the jet velocity increases monotonically with increasing laser power. The jet velocity can be fine-tuned from 10 to 50 m/s by adjusting only the incident laser power [Fig. 5(a)]. However, when the laser power is fixed (P=20 W) and D=3-7 mm, the jet velocity increases monotonically in a nonlinear form with an increase in the distance D [Fig. 5(b)], and when S is 4 mm, the depth of the hole formed is the largest [Fig. 6(c)]. In addition, under the same conditions, compared with direct laser irradiation, the micro?jet cutting accuracy is as high as 50 μm. The effect of the jet on the myocardial tissue model is more evident than that on the skin tissue model, and the radius and depth of the generated holes are smaller than those of the skin tissue model [Fig. 6(e)].
In this study, a new laser-induced micro-jet device that uses a 10.6 μm CO2 laser is designed for the first time. We have studied the generation of a 10.6 μm CO2 laser-induced liquid micro?jet and the influence of laser power, the distance D between the laser focus and zinc selenide lens, and the distance S between the nozzle and model on the jet. The experimental results show that the jet shape is related to the cavitation bubble pulsation process, and the increase in laser power or distance D can increase the velocity of the micro-jet, and the jet velocity can be effectively adjusted by laser power, distance D, and so on. In addition, the study compares the acting effect of micro-jet on agarose gel models with different elastic moduli, it is confirmed that laser-induced liquid micro?jet can cut biological tissue models with different elastic moduli to different degrees, which can achieve the selective cutting of biological tissues with high cutting accuracy and does not damage surrounding tissues. The results provide a basis for promoting the clinical application of this technology. Finally, this research found that the 10.6 μm CO2 laser-induced liquid micro?jet (especially turbulent and needle-shaped jets) is obviously unstable, and further optimization of the jet velocity control mechanism is needed.
1 引言
激光诱导液体微射流(LILJ)技术是利用激光在微腔内诱导空化效应进而产生高速微射流并作用于靶组织的一种新型医疗手段,具有切割精度高、微创、低热损伤以及对血管等弹性组织具有高度选择性等优点,在医疗领域应用中颇具优势。LILJ最早可追溯至1980年,当时,Papachristou等[1]尝试用高压驱动的水射流完成一台在不损伤肝脏内血管前提下的肝脏切除手术,开辟了水射流医学应用的新篇章,但他们所用装置的体积限制了术中所需水的供应,使得该技术并不适用于深窄处组织的外科手术。Kumabe等在体外微波冲击碎石手术中发现冲击波引起的气泡相互作用会导致周围组织损伤[2-5],从而研发出了脉冲激光诱导微射流喷射装置[6]。20世纪90年代,液体射流的产生方法得到了改进,从最初的基于气泡发生微爆炸得到射流,发展到以Ho∶YAG激光诱导空化气泡作为冲击波源,在很大程度上解决了液体流量过多阻挡手术视野、增大患者感染风险和仪器尺寸过大不便在体内狭窄处开展临床手术的问题。此后大量的研究表明,将脉冲激光诱导液体微射流系统应用于外科手术,不仅具有传统手术刀的解剖作用,还具有完整保留血管的特性。进入21世纪后,激光诱导液体微射流装置逐渐受到学术界的广泛关注,并被应用于医学治疗,包括神经外科手术[6-7]以及皮肤[8-9]、肺[10]、心血管系统[11]、肝脏[12-13]、肾脏[14-15]和脑[16-18]等组织部位的手术。随着科学技术的发展,激光诱导液体微射流装置在肿瘤切除[17-18]和无针注射[8,19-20]方面得到了较好的应用:Nakagawa等[17]利用Ho∶YAG激光诱导液体射流系统对46例不同脑占位患者进行治疗,结果显示,该系统可显著增加垂体和颅底肿瘤的切除效率,而且术中失血量和手术时间显著减少;Ogawa等[18]利用带有喷射发射器的激光诱导液体微射流装置对21例颅底肿瘤患者实施了占位切除手术,结果发现肿瘤被完整切除后其周围神经的功能没有丧失;Kwon等[9]的研究证明无针注射能够促进胶原合成;Krizek等[19]采用激光诱导液体微射流系统以超过680 m/s的速度将液体输送到高弹性组织(弹性模量E>60 kPa),揭示了该系统在无针注射方面的可行性。
目前的激光光源以Er∶YAG、Nd∶YAG、Ho∶YAG、近红外(NIR)半导体激光和CO2激光为主。近红外半导体激光器体积较大,无法集成于便携器件中;连续波激光器产生的射流速度不足13 m/s,无法穿透角质层[21];YAG类激光的电光转换效率仅为1%~3%,且容易引起热应力和热透镜效应[22]。Han等[23-24]利用橡胶皮层吸收激光能量产生的激波,使橡胶皮层隔开的相邻腔室间产生了微射流。他们使用的装置利用激光聚焦形成的压力波使橡胶皮层产生形变,进而迫使相邻腔室中的液体以射流形式转移,达到皮肤表面给药的目的。Battula等[25]基于1064 nm调Q激光开发了速度高达200 m/s的液体喷射器。然而,这些装置要么产生射流的效率较低,而且绝大多数射流前端粗钝无法穿透靶组织,要么仪器结构复杂不利于后续医疗评估。
相较之下,10.6 μm CO2激光器具有高转换率、高功率、高光束质量、低成本以及激光波长与水的吸收波长相近等优点,但目前国内外对CO2激光诱导微射流鲜有研究。硒化锌透镜可以使0.5~15 μm波长的光高效率地透过,同时,低吸收系数和高抗热震性的优点使其可以与CO2激光实现良好的耦合,大大降低了激光能量损耗,有效避免了射流转换效率低下的问题。基于本团队设计的一款10.6 μm CO2激光诱导液体微射流装置,本文阐述了激光诱导微射流产生的机制,探究了液体参数、光剂量参数等对激光诱导微射流产生的影响,评估了该装置在组织选择性切割等方面的可行性。
2 材料与方法
2.1 射流产生装置
如
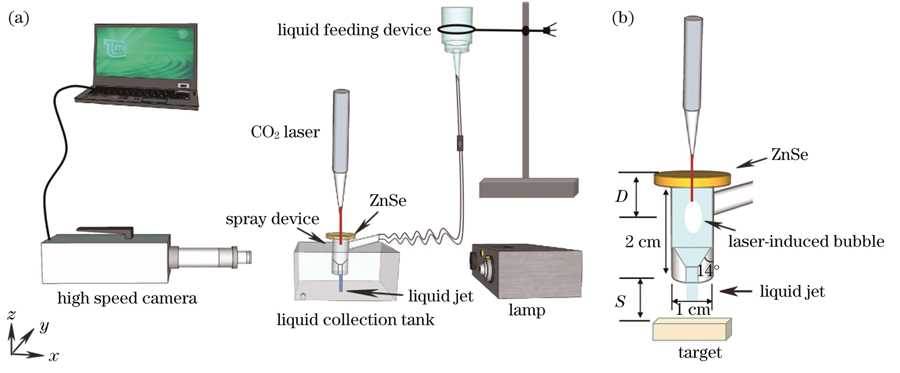
图 1. 实验装置。(a)激光诱导液体微射流系统示意图;(b)微射流装置示意图以及研究中使用的参数
Fig. 1. Experimental device. (a) Schematic of laser-induced liquid micro-jet system; (b) schematic of micro-jet device and parameters used in the study
2.2 材料准备
进行体外模型实验,以研究该装置对人体组织的穿透效果。为了模拟弹性模量为(129±88)kPa[26]人体皮肤组织以及弹性模量超过200 kPa[27]的收缩的心肌组织,制备了弹性模量分别为(83.7±15.2)kPa和(288.5±38.6)kPa[27-28]的琼脂糖凝胶。制备过程如下:称取0.5、1 g琼脂粉并分别与50 mL双蒸水混合,加热至沸腾后持续搅拌10 min,得到琼脂溶液;将琼脂溶液倒进30 mL培养皿中,冷却至室温,得到弹性模量不同的琼脂糖凝胶。室温(约25 ℃)条件下,在琼脂糖凝胶制备完成后的1 h内将纯净水微射流注入凝胶模型中。
2.3 射流高速成像
为了准确捕捉激光诱导微射流产生以及微射流与生物模型作用的过程,将高速摄像机与定焦镜头结合,构建了一台帧率为18540 frame/s、分辨率为336 pixel×468 pixel、曝光时间为1 μs的图像采集装置,如
3 结果与讨论
3.1 激光诱导微射流的机理
激光诱导微射流技术源于激光诱导液体发生的空化效应[29-30],空化气泡在狭小的微腔中吸收激光能量后迅速膨胀,然后在极短的时间内发生坍塌[23]。空化气泡坍塌时大部分能量以冲击波的形式被消耗,小部分能量则被转移至重建空化气泡[31]。由于冲击波所具备的作用力超过了液体的表面张力,冲击波将驱使末端液体的凹面发生形变,进而射出高速细长的射流,如
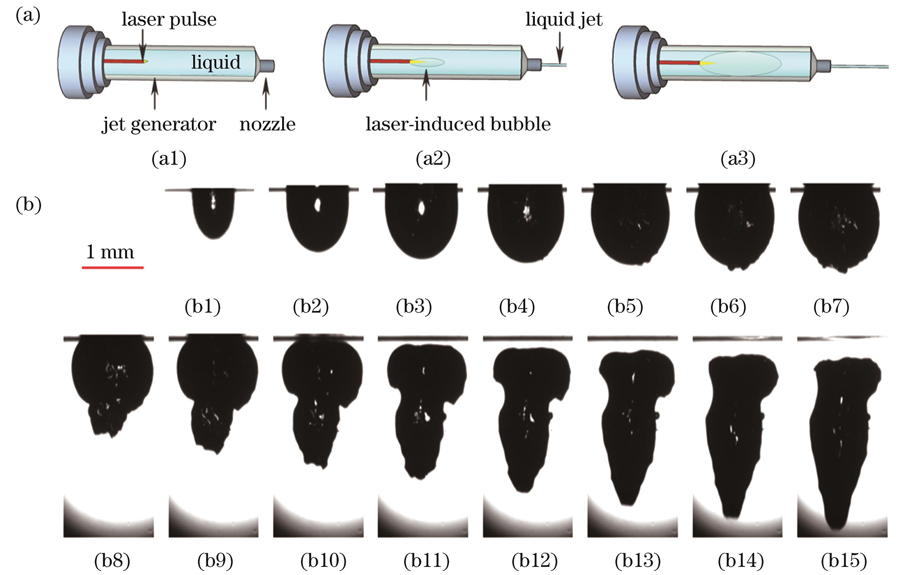
图 2. 微射流机理以及空化气泡的脉动过程。(a)激光诱导液体微射流系统的基本工作原理;(b)10.6 μm CO2激光聚焦在水中产生的空化气泡的脉动过程
Fig. 2. Micro-jet mechanism and cavitation bubble pulsation process. (a) Basic working principle of laser-induced liquid micro-jet system; (b) pulsation process of cavitation bubble generated by 10.6 μm CO2 laser focused in water
在激光诱导微射流产生过程中,空化气泡的脉动过程是微射流产生的关键步骤。如
3.2 射流形态表征
3.2.1 射流形态
如上所述,空化气泡的脉动过程以及发生腔室与射流间复杂的相互作用易导致不规则的射流形状产生。当激光峰值功率较低时,产生的射流速度不足以切开皮肤,因此实验中尽可能选用较大的峰值功率。将激光峰值功率P设定为25 W且将D设定为3 mm时,可以观察到
![4种射流喷射的动态过程[拍摄速度为18540 frame/s,图像间隔为1 frame(额外注明除外)]。(a)柱状射流(图像间隔为10 frame);(b)蘑菇状射流;(c)针状射流;(d)湍流状射流](/richHtml/zgjg/2023/50/9/0907205/img_03.jpg)
图 3. 4种射流喷射的动态过程[拍摄速度为18540 frame/s,图像间隔为1 frame(额外注明除外)]。(a)柱状射流(图像间隔为10 frame);(b)蘑菇状射流;(c)针状射流;(d)湍流状射流
Fig. 3. Dynamic process of four types of jet injections [shooting speed: 18540 frame/s; image interval: 1 frame (except otherwise indicated)]. (a) Columnar jet (image interval: 10 frame); (b) mushroom-shaped jet; (c) acicular jet; (d) turbulent state jet
3.2.2 射流的动力学特性
在P=25 W和D=3 mm的条件下,通过改变聚焦距离具体分析了不同形态射流的速度特性。蘑菇状射流的前端较为膨大,受腔壁黏性损失的影响较大,因此该射流速度显著低于湍流状和针尖状射流,其平均速度仅为13.61 m/s,如
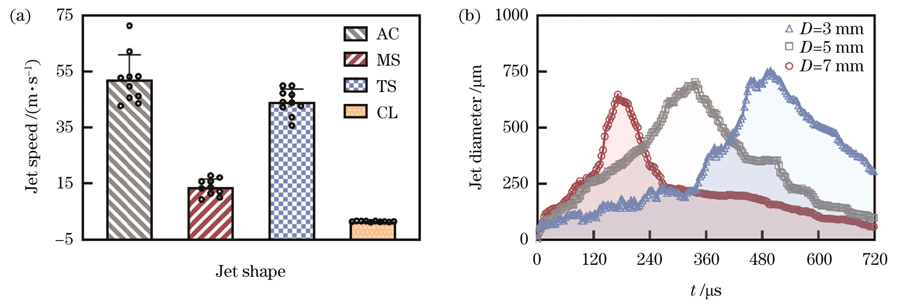
图 4. 射流的动力学特性以及射流直径随时间的变化。(a)当P=25 W且D=3 mm时,4种射流的动力学特性;(b)当D=3,5,7 mm时,激光诱导射流的直径(在喷嘴处测量)随时间的变化
Fig. 4. Dynamic characteristics of jets and jet diameter as a function of time. (a) Dynamic characteristics of four types of jets when P= 25 W and D=3 mm; (b) variation of laser-induced jet diameter (measured at nozzle) with time when D=3,5,7 mm
实验还发现射流尖端的直径通常在40~100 μm范围内,射流较粗部分的直径通常为600~750 μm。这取决于激光聚焦点与硒化锌镜片的距离D,如
3.3 射流速度的影响因素
为了进一步探究入射激光功率对射流动力学行为的影响机制,在实验中固定D为3 mm,以保证射流有较高的切割精度,通过改变入射激光功率P(18~25 W)来实现对射流速度的调控。对4种形态射流的速度进行分析后发现,随着激光功率增大,射流速度呈现单调递增的变化趋势,如
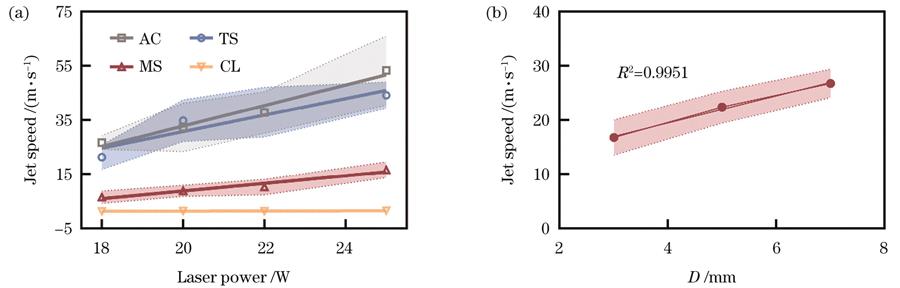
图 5. 射流速度的影响因素。(a)不同激光功率下纯净水的射流速度(D=3 mm);(b)不同D下的射流速度(P=20 W)
Fig. 5. Factors affecting jet velocity. (a) Jet velocity of pure water at different laser powers (D=3 mm); (b) jet velocity at different D values (P=20 W)
接下来固定激光功率P为20 W,研究了不同D值(3~7 mm)下的射流速度变化。分析
3.4 体外研究
为了探究激光诱导针状微射流在体外研究中的应用效果,利用可以有效模拟人体皮肤和心肌组织的琼脂糖凝胶作为体外研究模型。在激光功率(P=25 W)以及腔内焦点位置与硒化锌镜片距离(D=3 mm)恒定的条件下开展实验,并使用数码显微镜进行三维成像。为了表征模型表面的形貌特征以及探究喷嘴与模型的最佳距离,将喷嘴与琼脂糖凝胶模型的距离S设为0~7 mm,间隔1 mm。此外,在进行皮肤与心肌组织模型实验时采用恒定的距离(S=3 mm)。
通过显微镜成像可以发现,当激光诱导微射流作用于琼脂糖凝胶模型时,并未导致模型出现受热融化现象。当S<2 mm时,模型凹陷处有不规则的沟壑,周围裂纹无规则,表面粗糙同时伴有大小不等的凹坑,凹坑深度较浅,如
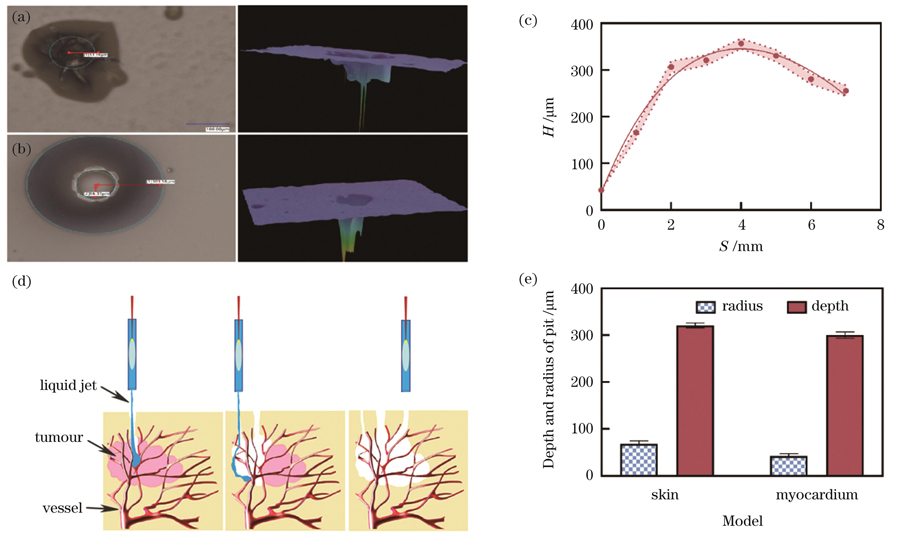
图 6. 激光作用于琼脂糖凝胶模型的效果。(a)凹坑的平面图和三维深度图(S<2 mm);(b)凹坑的平面图和三维深度图(S≥2 mm);(c)琼脂糖凝胶模型与喷嘴间的距离S对凹坑深度H的影响;(d)激光诱导微射流去除肿瘤示意图;(e)不同生物组织模型所产生的凹坑的半径和深度
Fig. 6. Effect of laser acting on agarose gel model. (a) Plan and three-dimensional depth maps of pit (S<2 mm); (b) plan and three-dimensional depth maps of pit (S≥2 mm); (c) influence of distance between agarose gel model and nozzle on pit depth; (d) schematic of tumor removal by laser-induced micro-jet; (e) radius and depth of pits produced on different biological tissue models
进一步,本文详细研究了射流对琼脂含量不同的凝胶模型的作用效果。如
4 结论
综上所述,本文开展了10.6 μm CO2激光诱导液体微射流产生以及激光功率、腔内焦点位置与硒化锌镜片距离D、喷嘴与模型间隔距离S对射流影响的研究。结果表明,射流形态与空化气泡的脉动过程有关,而激光功率的增强或激光腔内焦点位置与硒化锌镜片距离D的增加可以增大微射流的速度,而且可以通过激光功率、腔内焦点位置与硒化锌镜片距离D等对射流速度进行有效微调。此外,将射流作用于不同弹性模量的琼脂糖凝胶模型,证实了激光诱导液体微射流对不同弹性模量的生物组织模型的切割程度不同,可以实现对生物组织的选择性切割,且切割精度较高,不会对周围组织造成损伤。因此,采用微射流技术对组织进行切割是可行的,该技术在肿瘤去除方面具有广阔的应用前景。值得说明的是,基于10.6 μm CO2激光诱导产生的射流,尤其是湍流状和针尖状射流,存在明显的不稳定情况,不利于对射流速度进行精确调控,需要后续进一步优化明晰射流速度的调控机制。此外,在外科手术应用方面,需要进一步考虑待切割组织的弹性模量和药物黏度等,这对装置的调控精度等提出了更为严苛的要求。因此,未来还需要对激光诱导微射流投入大量的研究,进一步提高该系统在医学临床上的使用适配性。
[1] Papachristou D N, Barters R. Resection of the liver with a water jet[J]. British Journal of Surgery, 2005, 69(2): 93-94.
[2] Delius M, Gambihler S. Sonographic imaging of extracorporeal shock wave effects in the liver and gallbladder of dogs[J]. Digestion, 1992, 52(1): 55-60.
[3] Schelling G, Delius M, Gschwender M, et al. Extracorporeal shock waves stimulate frog sciatic nerves indirectly via a cavitation-mediated mechanism[J]. Biophysical Journal, 1994, 66(1): 133-140.
[4] Delius M, Enders G, Xuan Z, et al. Biological effects of shock waves: kidney damage by shock waves in dogs-dose dependence[J]. Ultrasound in Medicine & Biology, 1988, 14(2): 117-122.
[5] Zhong P, Zhou Y F, Zhu S L, et al. Dynamics of bubble oscillation in constrained media and mechanisms of vessel rupture in SWL[J]. Ultrasound in Medicine & Biology, 2001, 27(1): 119-134.
[6] Nakagawa A, Kumabe T, Ogawa Y, et al. Pulsed laser-induced liquid jet: evolution from shock/bubble interaction to neurosurgical application[J]. Shock Waves, 2017, 27(1): 1-14.
[7] Kawaguchi T, Nakagawa A, Endo T, et al. Ventricle wall dissection and vascular preservation with the pulsed water jet device: novel tissue dissector for flexible neuroendoscopic surgery[J]. Journal of Neurosurgery, 2016, 124(3): 817-822.
[8] Rennekampff H O, Schaller H E, Wisser D, et al. Debridement of burn wounds with a water jet surgical tool[J]. Burns, 2006, 32(1): 64-69.
[9] Kwon T R, Seok J, Jang J H, et al. Needle-free jet injection of hyaluronic acid improves skin remodeling in a mouse model[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2016, 105: 69-74.
[10] Shekarriz H, Shekarriz B, Bürk C G, et al. Hydro-jet-assisted pneumonectomy: a new technique in a porcine model[J]. Journal of Laparoendoscopic & Advanced Surgical Techniques, 2002, 12(5): 371-376.
[11] Aroussi A A, Sami I M, Leguerrier A, et al. The blower: a useful tool to complete thrombectomy of the mechanical prosthetic valve[J]. The Annals of Thoracic Surgery, 2006, 81(5): 1911-1912.
[12] Izumi R, Yabushita K, Shimizu K, et al. Hepatic resection using a water jet dissector[J]. Surgery Today, 1993, 23(1): 31-35.
[13] Rau H G, Duessel A P, Wurzbacher S. The use of water-jet dissection in open and laparoscopic liver resection[J]. HPB, 2008, 10(4): 275-280.
[14] Shekarriz B, Upadhyay J, Jewett M A S. Nerve-sparing retroperitoneal lymphadenectomy using hydro-jet dissection: initial experience[J]. Journal of Endourology, 2004, 18(3): 273-276.
[15] Shekarriz B. Hydro-Jet technology in urologic surgery[J]. Expert Review of Medical Devices, 2005, 2(3): 287-291.
[16] Terzis A J, Nowak G, Rentzsch O, et al. A new system for cutting brain tissue preserving vessels: water jet cutting[J]. British Journal of Neurosurgery, 1989, 3(3): 361-366.
[17] Nakagawa A, Ogawa Y, Amano K, et al. Pulsed laser-induced liquid jet system for treatment of sellar and parasellar tumors: safety evaluation[J]. Journal of Neurological Surgery. Part A, Central European Neurosurgery, 2015, 76(6): 473-482.
[18] Ogawa Y, Nakagawa A, Washio T, et al. Tissue dissection before direct manipulation to the pathology with pulsed laser-induced liquid jet system in skull base surgery-preservation of fine vessels and maintained optic nerve function[J]. Acta Neurochirurgica, 2013, 155(10): 1879-1886.
[19] Krizek J, Delrot P, Moser C. Repetitive regime of highly focused liquid micro‑jets for needle-free injection[J]. Scientific Reports, 2020, 10: 5067.
[20] Cu K, Bansal R, Mitragotri S, et al. Delivery strategies for skin: comparison of nanoliter jets, needles and topical solutions[J]. Annals of Biomedical Engineering, 2020, 48(7): 2028-2039.
[21] Nakagawa A, Hirano T, Kusaka Y, et al. Biological effect of shock waves on rat brain: pathological evaluation by compact Ho∶ YAG laser-induced cavitational shock wave generator[J]. Proceedings of SPIE, 2003, 4948: 263-268.
[22] 崔子浩, 付石友, 李彦玫, 等. 基于905 nm激光器的激光跟踪系统研究[J]. 激光与红外, 2010, 40(9): 950-953.
Cui Z H, Fu S Y, Li Y M, et al. Research on laser tracking system based on 905 nm laser[J]. Laser&Infrared, 2010, 40(9): 950-953.
[23] Han T H, Yoh J J. A laser based reusable micro‑jet injector for transdermal drug delivery[J]. Journal of Applied Physics, 2010, 107(10): 103110.
[24] Han T H, Hah J M, Yoh J J. Drug injection into fat tissue with a laser based micro‑jet injector[J]. Journal of Applied Physics, 2011, 109(9): 093105.
[25] Battula N, Menezes V, Hosseini H. A miniature shock wave driven micro-jet injector for needle-free vaccine/drug delivery[J]. Biotechnology and Bioengineering, 2016, 113(11): 2507-2512.
[26] 卢天健, 徐峰. 皮肤的力学性能概述[J]. 力学进展, 2008, 38(4): 393-426.
Lu T J, Xu F. Mechanical properties of skin: a review[J]. Advances in Mechanics, 2008, 38(4): 393-426.
[27] Omens J H. Stress and strain as regulators of myocardial growth[J]. Progress in Biophysics and Molecular Biology, 1998, 69(2/3): 559-572.
[28] 周志益, 赵纯亮, 陈洪, 等. 激光驱动无针注射系统研制与初步性能测试[J]. 激光杂志, 2011, 32(1): 69-70.
Zhou Z Y, Zhao C L, Chen H, et al. The development and preliminary performance test of laser-driven needle-free injection system[J]. Laser Journal, 2011, 32(1): 69-70.
[29] Zhu L, Gamez G, Schmitz T A, et al. Material ejection and redeposition following atmospheric pressure near-field laser ablation on molecular solids[J]. Analytical and Bioanalytical Chemistry, 2010, 396(1): 163-172.
[30] Musapelo T, Murray K K. Particle formation by infrared laser ablation of MALDI matrix compounds[J]. Journal of Mass Spectrometry: JMS, 2014, 49(7): 543-549.
[31] 付磊, 王萍, 王斯佳, 等. 纳秒脉冲激光诱导的水中双空泡振荡研究[J]. 中国激光, 2022, 49(4): 0407001.
[32] Peters I R, Tagawa Y, Oudalov N, et al. Highly focused supersonic micro‑jets: numerical simulations[J]. Journal of Fluid Mechanics, 2013, 719: 587-605.
[33] Tagawa Y, Oudalov N, Ghalbzouri A E, et al. Needle-free injection into skin and soft matter with highly focused micro‑jets[J]. Lab on a Chip, 2013, 13(7): 1357-1363.
[34] Padilla-Martinez J P, Ramirez-San-Juan J C, Korneev N, et al. Breaking the Rayleigh-plateau instability limit using thermocavitation within a droplet[J]. Atomization and Sprays, 2013, 23(6): 487-503.
[35] Thoroddsen S T, Takehara K, Etoh T G, et al. Spray and micro‑jets produced by focusing a laser pulse into a hemispherical drop[J]. Physics of Fluids, 2009, 21(11): 112101.
[36] Rohilla P, Marston J. Feasibility of laser induced jets in needle free jet injections[J]. International Journal of Pharmaceutics, 2020, 589: 119714.
[37] Hayasaka K, Kiyama A, Tagawa Y. Effects of pressure impulse and peak pressure of a shockwave on micro‑jet velocity in a microchannel[J]. Microfluidics and Nanofluidics, 2017, 21(11): 166.
Article Outline
吴灵锦, 吕茗萱, 薛建伟, 梁航, 张先增. 脉冲CO2激光诱导液体微射流动力学特性及应用研究[J]. 中国激光, 2023, 50(9): 0907205. Lingjin Wu, Lü Mingxuan, Jianwei Xue, Hang Liang, Xianzeng Zhang. Dynamic Characteristics and Application of Pulsed CO2 Laser Induced Liquid Micro‐Jet[J]. Chinese Journal of Lasers, 2023, 50(9): 0907205.