光学投影断层成像技术及其研究进展  下载: 1360次
下载: 1360次
1 引言
随着近年来现代生命科学和医学等研究领域对毫米至厘米量级的介观系统(如完整的胚胎、体外器官及活体模式动物等)的高精度三维结构和功能信息快速提取需求的日益增长,可应用于生物医学成像领域中的一系列介观三维成像技术发展起来了,包括微型计算机断层扫描技术(μCT)[1]、微型核磁共振成像技术(μMRI)[2]、光声断层成像技术(PAT)[3]、扩散光学断层成像技术(DOT)[4]、光学相干断层成像技术(OCT)[5]、光学投影断层成像技术(OPT)[6]以及光片成像技术[7]等。常见的μCT和μMRI分别基于电离辐射和射频辐射,可对无标记样本进行非侵入式三维成像,具有较高的空间分辨率,可达微米量级。但常见的μCT和μMRI不是光学成像技术,无法利用常见的染色/荧光标记等获取样本的丰富信息。PAT是基于光声效应的一种混合模式成像方法,通常使用激光照射成像部位,利用被吸收的光能转化的热能使组织发生相应的热弹性膨胀并发射宽带超声波,从而通过超声波探测来成像。该技术通常用于观测样本(如小模式动物的脑部、肿瘤等)的三维吸收成像[8-10],也可通过结合其他模式(如分子探针)来实现分子特异性的成像。OCT基于低相干干涉原理,可探测生物系统在不同深度方向的后向反射或散射信号,实现微米量级的三维成像,通常可应用于临床眼科、皮肤科治疗等。DOT主要利用近红外光探测高散射样本的扩散光信息来重建三维图像,但受限于扩散光测量,其空间分辨率较低、图像质量较差。
荧光成像技术具有高灵敏度和分子特异性,在生物、物理、医学、药学等领域获得广泛应用,是现代生物医学研究中重要的研究手段。常见的共聚焦显微[11]、双光子[12]和多光子[13]荧光成像受到光场和扫描速率的限制,通常只能针对厚度为几十至几百微米的微观生物样本进行三维成像,不能满足对介观尺寸内的生物系统进行成像的需求。因此,基于荧光成像的高分辨率介观三维成像技术应运而生,主要包括OPT技术和光片成像技术。DOT也可对散射生物样本进行荧光成像,受散射组织和探测方式的限制,其成像精度较低,一般在毫米量级[14]。
OPT技术针对介观样本提供了一种经济、高效、快速的三维吸收/荧光成像,将其与荧光标记、多维度荧光成像、荧光寿命成像(FLIM)[15]以及荧光共振能量转移(FRET)[16]等技术结合,还可为生物医学和药学研究提供新的研究手段。近年来,由于OPT及其扩展成像技术可提供介观生物医学样本的结构和功能信息,研究如何优化OPT成像技术及扩展其应用领域已引起了研究人员的兴趣。本文综合介绍OPT技术成像原理,技术发展历程、现状及其在生命科学、医学和药学等研究领域的广泛应用。
2 原理
2.1 OPT基本原理和实现方式
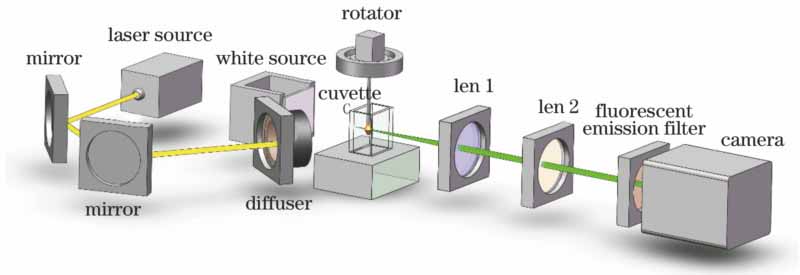
OPT是一种光学形式的计算机投影断层成像技术,通过采集一系列在不同角度下的样本的光强度二维投影图像,运用滤波反投影(FBP)算法[17]重建样本内部的三维结构信息。OPT有2种成像模式:激发式(eOPT)和透射式(tOPT)。前者是利用可见光光源宽场激发生物样本中的荧光基团来采集荧光图像,后者则是采集可见光的吸收图像。由于OPT成像中光线被近似成平行光投射,故OPT要求成像光学的景深(DOF)至少覆盖样本的一半,同时也要求样本透明。除了自身透明的样本(如斑马鱼胚胎),多数组织样本需利用光学清洗技术(如BABB[18],Sca
实现OPT成像的基本配置如
OPT系统中横向分辨率
式中

图 2. 样本切片二维函数i(x,z)和在与水平方向呈θ角度的平行光下测得的样本投影函数Pθ(r)
Fig. 2. Two-dimensional function i(x,z) of slicing sample and its parallel projection Pθ(r) measured under a set of parallel rays at angle of θ
2.2 基于平行光投影的滤波反投影重建算法
在样本三维重建算法中,针对平行光照射,最常用的算法是基于傅里叶中心切片定理的FBP算法,该算法涉及滤波和反投影两部分。前者是在对每个角度的投影图像的频域做加权;后者是将滤波后的图像在对应的每个角度进行反投影后再叠加,从而获得样本的切片信息。如
式中
3 OPT技术发展现状
近年来,优化OPT成像技术和拓展其应用领域的研究已引起研究人员的兴趣,OPT技术也得到了一定的发展,主要包括成像系统本身的改进、算法改进和结合其他新型成像技术的拓展。
3.1 系统本身的改进方法
3.1.1 焦平面扫描方法
由于OPT要求成像的景深覆盖至少样本的一半,因此在用高
3.1.2 角度复用OPT技术
传统的OPT利用单轴进行成像,Chen等[26]提出角度复用OPT技术,利用相互正交的双轴同时在分离的焦平面成像,改善了空间分辨率与景深的不平衡关系,从而提高了空间分辨率和光收集效率,进而提高采集速率、减小光通量。同时,该技术被改进后可实现对介观活体模式动物特征细胞的三维追踪[27],利用依次投影图像之间的时间延迟而非总采集时间,实现其延时分辨。相比较传统的三维定位方法,该技术大幅减少了对样本的光辐射。
3.1.3 高动态范围成像技术
传统的OPT技术在每个旋转角度采集单张投影图像时,会受到CCD相机的动态范围和曝光时间的限制,无法获得具有高异质结吸收特性的生物样本细节信息。Fei等[28]针对此问题,提出在传统OPT基础上结合高动态范围成像(HDR)技术,通过采集样本在同一角度下不同曝光时间的投影图像,利用HDR技术将同一角度多次曝光的投影图像进行融合和图像重组,得到了未进行化学透明处理的斑马鱼胚胎的吸收成像。此外,根据融合后的投影图像,可获得更清晰的图像细节。该技术优势使得OPT在高效、高分辨率的三维活体成像方向有潜在的应用[29-30]。
3.1.4 螺旋OPT技术
针对较长的生物样本(如小鼠的结肠),传统拼接OPT技术采用对样本进行分段采集重建再拼接切片图像的方法。Arranz等[31]引入螺旋的概念,提出螺旋OPT技术,解决了针对较长生物样本的三维成像。螺旋OPT通过将生物样本固定在可以同时实现垂直升降和旋转的平台上,根据从下到上螺旋旋转360°过程中生物样本所需合适的曝光时间,设定合适的垂直平移速率和旋转速率,从而可采集较长的、完整的生物样本的投影图像,该过程明显减弱了光强,避免光漂白现象,提高了采集速率。
3.1.5 流式OPT技术
Bassi等[32]引进一种流式OPT技术,实现对活体生物组织样本脉管系统的三维成像。该技术可探测细胞在血液中的流动,实现流体标记、动态分析等。该课题组证明了针对未使用任何荧光标记的、透明的以及轻微散射的活体生物样本的血管网,通过流式OPT技术可实现活体生物样本的三维光学成像。
3.1.6 角域滤波OPT技术
生物组织内不同成分的折射率不同,因此成像质量会受到散射光的影响。针对此问题, Vasefi等[33-34]提出一种在传统OPT技术基础上结合角域滤波技术来减少浑浊样本中的散射光。角域滤波OPT技术利用光束穿过生物系统的出射光中的弹道光和非弹道光在出射角度上存在差异,通过在样本后放置一个角滤波阵列(AFA),仅允许与光轴方向的夹角为0°~0.5°的光经过,从而减少了由散射引入的背景噪声。
3.2 算法改进
3.2.1 频域滤波法
在OPT成像系统中,物镜的点扩散函数存在离焦现象,而传统的FBP算法并未考虑OPT的光学特性。Walls等[35]提出一种基于正弦投影图像的频率与距离关系的频域空间滤波方式以改善传统FBP算法,通过利用点扩散函数进行反卷积,可在重组前排除正弦投影图像里高频部分的离焦数据。Chen等[36]提出利用在FBP算法过程中结合测量调制传递函数的方法来限制频率只在系统实际允许分布的范围内,以进行反投影重组,从而提高OPT投影数据的重组图像质量。该方法更适用于需要低于采样标准的快速采集实验。
3.2.2 中心校正算法
Figueiras等[37]提出一种包括照明校正和测定旋转中心的预重组算法,对于现有基于未完成重组切片最大方差值的样本旋转中心的测定方法,该课题组通过检测方差最锐利处的局部极大值来寻找样本旋转中心以改善重组图像质量。Tang等[38]提出将吸收和荧光的正弦图融合以校正样本旋转中心,从而改善重组质量。另外,也可通过模拟多焦成像的计算模型改进OPT重组算法[39]。
3.2.3 相位恢复算法
通过相位恢复插值算法可发现隐藏在复杂层面后的生物样本,当对图像进行三维重组时,可提取穿过散射层的深度信息,深度可多达几个传输平均自由程。基于此方法,Ancora等[40]提出将荧光标记植入生物样本散射层之间,结合相位恢复插值算法和FBP重建了果蝇三维图像。
3.2.4 迭代收缩/阈值算法
传统FBP算法要求用于三维重组的投影图像最少也要几百张,导致OPT系统需要一定的采集时间。为缩短采集时间,Rudin等[41]在图像重组中利用全变分(TV)法对50张或是更少的投影图像进行三维重建[42]。TV图像降噪技术是将图像降噪转化为能量函数的最小化问题,使图像抑制噪声的同时较好地保留图像的边缘细节。通过两步迭代收缩/阈值算法(TwIST)[43]实现最小化全变分。该方法实现了只采集32张投影图像即可重建斑马鱼胚胎的三维结构,使得成像速率得到较大的提高。
3.3 结合新型成像技术的拓展
3.3.1 FLIM-OPT技术
传统OPT技术通常局限于强度测量。荧光强度容易受到激发光强度、样品淬灭和荧光分子分布浓度等诸多因素的影响,通常只提供结构信息,难以对其进行定量测量。荧光寿命是指分子受到光激发后返回到基态之前在激发态停留的平均时间,其测量过程不受上述因素的影响,可提供功能信息。2008年McGinty等[44]提出将OPT技术扩展到FLIM-OPT,实现介观三维荧光寿命成像,提供了一种对介观样本进行定量测量的全新手段。该技术通过在不同角度下采集不同时间延迟的宽场时间门图像,对每个时间延迟点得到的样本强度信息进行三维重建,通过将每一重建的切片信息迭代拟合成一个单指数衰减函数以决定其荧光寿命。由于其固有比例特质,荧光寿命能有效地抵抗伪影的强度,并产生可进行定量测量的荧光信号。该课题组使用alexa-488注入抗体,以神经丝作为靶向标记的小鼠胚胎为样本,实现了三维荧光寿命成像,根据成像结果可清晰地分辨小鼠胚胎的外部标记和自发荧光,特别是从心脏到脊主动脉的部分。2011年该课题组提出将FLIM-OPT应用到活体斑马鱼胚胎[45],实现了对活体模式动物的三维荧光寿命信息的提取,拓展了活体模式动物的多维度荧光定量测量技术。
3.3.2 结合FRET的FLIM-OPT技术
FRET技术是探测在活体生物细胞内间距小于10 nm的荧光蛋白质分子之间的能量转移。Andrews等[46]将FLIM-OPT应用于FRET生物传感标记的活体转基因斑马鱼幼虫,实现对其生物结构功能的测量。在此基础上,Kumar等[47]提出将FLIM-OPT和角度复用技术结合,实现对成年斑马鱼的活体三维荧光成像。
3.3.3 OPT-选择光片照明显微成像技术
具有高分辨率的选择光片照明显微成像技术(SPIM)[6]是光片显微成像的一种实现手段。Mayer等[48]利用OPT和SPIM两种技术优势提出OPT-SPIM,通过将荧光和吸收的三维高分辨率数据集合一体化,实现了介观生物样本的更广泛功能结构信息的描述。
3.3.4 偏振灵敏型OPT技术
Fang等[49-50]实现了一种偏振灵敏型OPT技术,通过使用偏振条件可改善对肌肉纤维的探测和三维成像。提高系统的采集速率和改善处理过程,能使得肌肉纤维更清晰的显现。针对其他类似纤维状的结构(如心肌层)或其他双折射的生物组织,偏振灵敏型OPT技术都可以提供高精度的三维成像。
4 OPT的应用
随着OPT技术发展日益成熟,利用OPT及其拓展技术(如FLIM-OPT)的三维荧光成像广泛应用于组织生物学、医学解剖学、免疫组织学、神经学甚至药学等研究领域,可提取生物系统的结构甚至功能信息。部分应用如

图 3. OPT三维荧光成像。(a)野生小鼠的心脏和肺部的自发辐射荧光成像;(b)携带肿瘤组织的活体转基因受精30天后的成年斑马鱼;(c)转基因小鼠(thy1-YFP)的脑切片
Fig. 3. Three-dimensional fluorescence imaging of OPT. (a) Autofluorescence imaging of mouse heart and lung; (b) post fertilization zebrafish with tumor cells living for 30 days; (c) brain slice of transgenic mouse (thy1-YFP)
4.1 生物医学组织形态和组织病理学研究
OPT技术最初应用于解剖学研究[6,52],其研究生物样本是固定的、经光学透明处理的生物样本,如小鼠胚胎。OPT技术也可实现器官和其他生物组织样本的三维成像和可视化研究[53-57]。透射光和荧光辐射都可生成三维OPT图像。吸收对比度是由内源性发色团和外源标记或染色[如标准苏木精-伊红(H&E)染色]产生,荧光对比度是由染色、基因表达荧光蛋白的外源标记物和内源性荧光基团(如胶原蛋白、弹性蛋白等)产生的。目前已有利用OPT技术实现对小鼠胰腺的三维成像的相关报道,利用标准的基于强度的成像技术,可实现对胰腺里含胰岛素
4.2 荧光标记追踪
Colas和Sharpe的研究实现了实时对小鼠胚胎的OPT成像[61],将OPT与成熟的小鼠胚胎技术结合,提出一种荧光标记追踪的方法。通过表面外胚层的组织级别的运动,该课题组建立小鼠四肢的动态生长图像。该样本从200个角度成像,每改变1.8°成像一次,以15 min为间隔,可在透射式成像与激发式成像两种模式间相互切换,前者测量器官的整体形状,后者追踪人工标记。该方法可实时记录小鼠胚胎头部的荧光图像,并且重建得到了小鼠头部的虚拟断层图像,在体动态OPT成像方面取得了较大的进展。
角度复用拓展的OPT技术还被应用在一只具有绿色荧光蛋白标记、尾巴有炎症的斑马鱼胚胎中,通过超过25.5 min的观察,可以实现对发炎尾巴里中性线细胞的三维追踪[27]。该项追踪技术不但可用于研究在发炎刺激过程里中性线细胞迁移的表现,还可应用于任何可分辨的、具有荧光特征三维移动的、半透明的介观生物样本。
4.3 植物应用
为更深入地了解构成植物生长和发育基础的机制,不仅要求在三维形态学上量化数据,也要求基因活动在多种平台和尺度上。利用OPT技术可获得植物样本的三维结构数据[62],该技术可方便地应用在一系列如植物种子、幼苗、叶、花、根茎、植物胚胎、分生组织等多种多样的植物样本。OPT技术的最大精度是可观测到植物结构里较大的个体细胞。对于如根茎等天然的半透明植物结构,利用OPT技术可实现对植物的三维成像。利用外源基因标记技术或整体原位杂交技术,可实现基因表达的三维成像。
此外,有文献已实现将OPT技术应用于药物传输系统[63]、检测小鼠心肌梗塞[64]、量化细胞增殖过程[65]等药学和医学领域。
5 结束语
OPT作为一种介观光学成像技术,可利用常见的染色和荧光标记等手段,快速实现对完整生物系统样本的吸收/荧光的高精度三维成像。OPT可与多维度荧光成像技术结合进行多参数测量,进行对离体/活体模式动物的定性定量研究,具有传统针对微观样本(尺度小于毫米量级)的共聚焦显微、双光子荧光成像等不具备的独特技术优势。OPT自提出以来,由于其能实现厘米至毫米范围内的快速、经济、稳定的高分辨三维荧光成像,一直向更高分辨、定性定量的高维度信息(如结合FRET的OPT-FLIM技术)和更快速图像处理(如频域滤波法)的方向发展,为完整的生物系统样本的结构和功能信息提取提供了新的研究手段。OPT在基础生命科学领域中有广阔的应用前景,可通过对特定器官的靶向标记进行OPT或OPT拓展成像,达到对药物疗效评估的目的,因此在医学和药物开发领域也有很好的应用前景。
[5] Huang D, Swanson E A, Lin C P, et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181.
[9] LiabL, XiaaJ, LiaG, et al. Label-free structural photoacoustic tomography of intact mouse brain[C]. SPIE, 2015, 9323: 93230M.
[29] 王晓蕊. 基于相机阵列的光学投影断层成像装置及方法: CN104224127A[P].2014-12-24.
[30] 王洁琳, 廖日威, 曾亚光, 等. 基于线性化动态范围变换的光学投影层析三维成像[J]. 光学学报, 2017, 37(5): 0511003.
[34] VasefiF, KaminskaB, JordanK, et al. Angular domain optical projection tomography in turbid media[C]. SPIE, 2009, 7174: 71740D.
[35] Walls J R. SledJ G, Sharpe J, et al. Resolution improvement in emission optical projection tomography[J]. Physics in Medicine and Biology, 2007, 52(10): 2775-2790.
[36] ChenL, McGinty J, Taylor H B, et al. Improved OPT reconstructions based on the MTF and extension to FLIM-OPT[C]. Biomedical Optics. Optical Society of America, 2012: BTu3A. 23.
[38] TangX, VanM, HoogenboomJ, et al. Fluorescence and bright-field 3D image fusion based on sinogram unification for optical projection tomography[C]. IEEE International Conference on Bioinformatics and Biomedicine, 2017: 16604097.
[39] Koskela OH, Belay BA, Pursiainen ST, et al. Computational model for simulating multifocal imaging in optical projection tomography[C]. Mathematics in Imaging, 2017: MTu1C. 3.
[40] AncoraD, Di BattistaD, GiasafakiG, et al. Phase-retrieved optical projection tomography for 3D imaging through scattering layers[C]. SPIE, 2016, 9718: 97181B.
[47] KumarS, LockwoodN, Ramel MC, et al. In vivo multiplexed OPT and FLIM OPT of an adult zebrafish cancer disease model[C]. Cancer Imaging and Therapy. Optical Society of America, 2016: CTu4A. 2.
[50] 田捷. 光学投影断层成像的检测方法: CN104865195A[P].2015-08-26.
[51] ChenL. Development of optical projection tomography for mesoscopic 3-D biomedical imaging[D]. London: Imperial College London, 2013: 123- 140.
[60] Kirkby NS, LowL, WuJ, et al. Generation and 3-dimensional quantitation of arterial lesions in mice using optical projection tomography[J]. Journal of Visualized Experiments, 2015( 99): 50627.
[61] Colas J F, Sharpe J. Live optical projection tomography[J]. Organogenesis, 2009, 5(4): 211-216.
Article Outline
李颖超, 刘昂, 李贵叶, 刘丽娜, 胡学娟, 陈玲玲. 光学投影断层成像技术及其研究进展[J]. 中国激光, 2018, 45(3): 0307012. Li Yingchao, Liu Ang, Li Guiye, Liu Lina, Hu Xuejuan, Chen Lingling. Optical Projection Tomography Technique and Its Research Progress[J]. Chinese Journal of Lasers, 2018, 45(3): 0307012.