基于太赫兹波成像的鼠脑创伤三维重构  下载: 1475次
下载: 1475次
1 引言
外伤性脑损伤(TBI)是一种常见的公共健康疾病,由于其并发症所导致的思维、感觉、语言以及情绪上的影响与变化并不明显,因此常被称为“沉默的流行病”。根据美国政府的一份研究报告,在美国,每年有约170万人遭受TBI,其中死亡人数约为5.2万人,占所有与伤害相关死亡人数的30.5%[1]。在发展中国家以及工业化国家中,随着交通以及建筑工业的迅猛发展,TBI已成为导致疾病和残疾的最主要因素[2]。TBI发生后,脑创伤通常伴有不同程度的脑水肿[3]。在创伤组织内部及周围,脑内血流低于缺血阈值,这会导致“弥漫性半影”的缺血状态[4]。创伤和缺血共同构成了TBI的病理学过程[5]。在脑外伤手术中,脑功能区的定位以及坏死脑组织的辨认具有极大难度,会导致手术过程中额外的清创、致命的并发症和永久性的脑功能损伤。因此,精准的TBI神经外科手术在临床上具有重要意义。在外科手术中,除了医生的经验外,传统的医学成像技术,如计算机辅助层析和磁共振成像能够提供有用的信息。然而,这些技术需要使用全身成像,具有成本高、系统复杂、采集时间长等诸多缺陷。当前,迫切需要一种更有效的技术手段,来帮助医生在TBI发生后更好地进行创伤程度的评估以及手术的执行。
太赫兹波位于红外与微波波段之间,具有非电离性和无损性等优良特性。近年来,太赫兹波成像作为一种生物组织高灵敏度检测技术,被人们广泛研究[6-9]。太赫兹波成像技术在皮肤癌[10]、乳腺癌[11]、脑胶质瘤[12]以及口腔癌等[13]的检测应用方面已取得了巨大发展。鉴于脑创伤组织周围水肿区域较为明显,而太赫兹波对生物组织中细胞密度、水分分布和含水量较为敏感,因此可以尝试采用太赫兹波成像检测TBI的分布特征。
本文采用Feeney's自由落体击打方法制备颅脑创伤的大鼠动物模型,利用太赫兹波透射式成像系统对正常鼠脑和创伤鼠脑的组织切片分别进行成像,分析两者太赫兹波透过率的差异;之后进一步对不同深度的切片进行成像,并结合三维重构技术,实现了鼠脑内部创伤区域的三维空间分布检测。该结果表明,基于太赫兹波多深度切片成像的三维重构技术在疾病组织的空间分布检测方面具有一定的应用潜力。
2 实验方法
2.1 自由落体击打性颅脑创伤动物模型制备
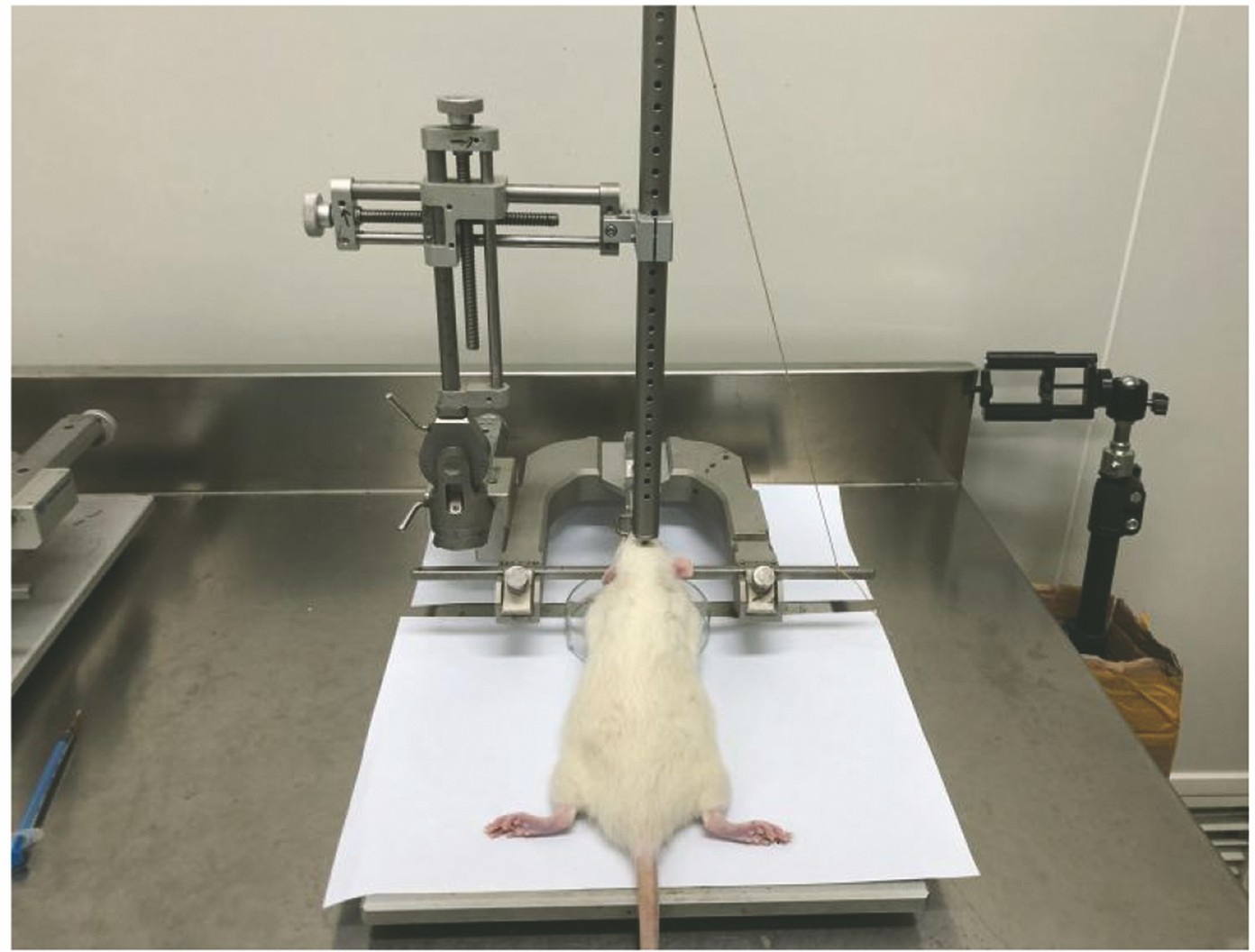
实验选用购于第三军医大学动物中心的成年雄性Sprague-Dawley大鼠,它们的质量在250~280 g之间。采用Feeney's方法建立自由落体击打性颅脑创伤动物模型[14]。首先使用戊巴比妥(质量分数为50×10-6)进行腹腔注射麻醉,并将大鼠头部固定在立体定位仪上。刮去毛皮后进行常规消毒,沿中线切开头皮,采用牙钻进行右颅骨开颅术。开颅直径为4.5 mm,开颅区域位于前囟门后侧3 mm,侧边2.5 mm处,开颅手术中避免硬脑膜撕裂伤。一个质量为30 g、半径为4.5 mm、长度为5 mm的砝码从大鼠头颅上方25 cm处自由落体,撞击裸露的硬脑膜,以此来制作颅脑创伤模型。为了能够精确撞击硬脑膜,砝码每次都从颅脑上方的空心金属管内落下,金属管上每隔1 cm开一个孔,用于减小空气阻力,实验装置如
2.2 太赫兹波成像系统
2.3 成像样品的制备
鼠脑组织于创伤24 h后取出,并放入冰冻切片机(CM1950,Leica公司,德国)中进行切片。如
3 实验结果及分析
鼠脑样品共计24例,其中6例为正常鼠脑,18例为创伤鼠脑。采用苏木素-伊红(HE)染色法分别处理正常和创伤的鼠脑组织,它们的显微图像如

图 3. 实验照片。(a)创伤鼠脑照片;(b)创伤鼠脑组织切片照片
Fig. 3. Experiment pictures. (a) Photograph of TBI rat brain; (b) photograph of sliced TBI rat brain tissue

图 4. HE染色显微图像。(a)正常鼠脑组织;(b)创伤鼠脑组织
Fig. 4. HE-stained microscopic images. (a) Normal rat brain tissue; (b) TBI rat brain tissue
为了进一步分析鼠脑组织中创伤灶的分布区域,对13例鼠脑不同深度的切片进行了太赫兹波透射式成像,然后利用三维重构技术对不同深度的图像进行三维重构,从而更直观地展示创伤区域在鼠脑内的空间分布。考虑到每个切片在石英片基底上放置的位置以及角度的差异,需要对图像进行预处理,以校正图像。预处理过程包括两个步骤:1)旋转原始灰度图像,使每张图像中鼠脑放置的角度一致(在灰度图中,亮点表示透过率低的区域,暗点表示透过率高的区域);2)将样品区域外切矩形的中心移动到图像的中心,从而使样品位于图像的正中。以

图 5. 切片成像结果。(a) 正常鼠脑组织;(b)创伤鼠脑组织
Fig. 5. Imaging results of slice. (a) Normal rat brain tissue; (b) TBI rat brain tissue

图 6. 基于太赫兹波成像的三维重构预处理过程
Fig. 6. Preprocessing of three-dimensional reconstruction based on terahertz wave imaging
在图像预处理完成后,将所有图像依次输入MATLAB程序中,绘制三维图形。三维重构结果被制成旋转动画,如

图 7. 以不同角度观察的三维模型。(a)~(d)创伤鼠脑样品;(e)~(h)正常鼠脑样品
Fig. 7. Three-dimensional models in different viewing angles. (a)-(d) TBI rat brain samples; (e)-(h) normal rat brain samples
4 结论
采用太赫兹波透射式成像系统对自由落体击打性颅脑损伤鼠脑模型进行组织切片成像,成像结果表明,相比于正常组织,鼠脑中的创伤区域对太赫兹波具有更低的透过率。通过在鼠脑的不同深度处制备切片,获取多深度切片成像图,实现正常鼠脑和创伤鼠脑的三维重构。其中创伤鼠脑的三维成像可以清楚地反映鼠脑内部创伤区域的空间分布。由于太赫兹波在新鲜生物组织中的穿透深度较低,当前较为普遍的太赫兹波成像技术通常只能获取组织表面的信息,而无法实现三维成像。这种基于多深度切片成像的三维重构技术,是一种实现生物组织太赫兹波三维成像的可行且有效的方法,有望应用于各种病变组织的病理学发展过程研究。
[1] FaulM, Xu LK, Wald MM, et al. Traumatic brain injury in the United States: emergency department visits, hospitalizations and deaths 2002—2006[R]. Atlanta: Centers for Disease Control and Prevention, 2010.
FaulM, Xu LK, Wald MM, et al. Traumatic brain injury in the United States: emergency department visits, hospitalizations and deaths 2002—2006[R]. Atlanta: Centers for Disease Control and Prevention, 2010.
[5] Greve M W, Zink B J. Pathophysiology of traumatic brain injury[J]. Mount Sinai Journal of Medicine: a Journal of Translational and Personalized Medicine, 2009, 76(2): 97-104.
Greve M W, Zink B J. Pathophysiology of traumatic brain injury[J]. Mount Sinai Journal of Medicine: a Journal of Translational and Personalized Medicine, 2009, 76(2): 97-104.
[7] ShiJ, Wang YY, Xu DG, et al. Biomedical diagnosis of cerebral ischemia with continuous-wave THz imaging[C]. International Conference on Infrared, Millimeter, and Terahertz Waves, 2016: 1- 2.
ShiJ, Wang YY, Xu DG, et al. Biomedical diagnosis of cerebral ischemia with continuous-wave THz imaging[C]. International Conference on Infrared, Millimeter, and Terahertz Waves, 2016: 1- 2.
[8] 李文军, 王天一, 周宇, 等. 多层胶接结构胶层空气缺陷的太赫兹无损检测[J]. 光学学报, 2017, 37(1): 0111002.
李文军, 王天一, 周宇, 等. 多层胶接结构胶层空气缺陷的太赫兹无损检测[J]. 光学学报, 2017, 37(1): 0111002.
[9] 李孟奇, 谭智勇, 邱付成, 等. 基于太赫兹量子级联激光器的反射式快速扫描成像[J]. 光学学报, 2017, 37(6): 0611004.
李孟奇, 谭智勇, 邱付成, 等. 基于太赫兹量子级联激光器的反射式快速扫描成像[J]. 光学学报, 2017, 37(6): 0611004.
王与烨, 陈霖宇, 徐德刚, 陈图南, 冯华, 姚建铨. 基于太赫兹波成像的鼠脑创伤三维重构[J]. 光学学报, 2019, 39(3): 0317002. Yuye Wang, Linyu Chen, Degang Xu, Tunan Chen, Hua Feng, Jianquan Yao. Three-Dimensional Reconstruction of Rat Brain Trauma Based on Terahertz Imaging[J]. Acta Optica Sinica, 2019, 39(3): 0317002.