高斯谢尔模型光束在生物组织中的光谱变化  下载: 991次
下载: 991次
1 引言
自从Maiman于1960年首次报道激光器以来,人们对激光在许多领域中的应用进行了大量研究。特别是近年来,人们对激光与生物组织相互作用的研究促进了组织光学理论的发展和应用,使激光在生物医学光谱检测、疾病诊疗等方面的研究成为热点[1-5]。1996年,Schmitt等[6]通过测量和分析多种哺乳动物组织折射率的变化特点,发现不同的动物组织具有相似的空间相关性,并采用经典的Kolmogorov模型给出了组织折射率的数学描述和哺乳动物组织的空间折射率功率谱模型,奠定了组织光学理论模型的基础。Gao等[7-11]研究了随机电磁光束在生物组织传输中的偏振和相干特性,并分析了组织结构对成像系统分辨率的影响。Jacques[12]总结了组织光学的散射、吸收特性与光波波长的依赖关系,给出了描述细胞、生物组织的光学特性与吸收、散射内在关系的通用公式。Tong等[13]利用玻恩近似讨论了随机激光经薄生物组织切片散射后的偏振情况,研究表明,散射光的远场光谱偏振度与光的统计特征、组织的关联特性相关。Wu等[14]研究了高斯谢尔模型(GSM)光束在生物组织传输中的平均光强和光束扩展,分析了部分相干性和生物组织参数对光束传输的影响,指出用平均光强和扩展特性来评估生物组织体系的性能、研究其结构是可行的。Jin等[15]研究了激光在生物组织传输中的平均光强和闪烁因子。2018年,Chen等[16]介绍了一种软生物组织功率谱模型,研究了折射率、功率谱、生物组织内外尺度对光束在软生物组织传输的影响,并指出深入开展激光在生物组织中传输特性的研究对生物组织的医学诊断和治疗具有指导意义。
光谱分析是科学研究最重要的方法之一。在该方法的使用过程中,一直暗含着一个假设,即光在自由空间传输时光谱不变。1986年,Wolf[17]指出,当在自由空间传输的光满足定标定律时,光谱保持不变,否则光源发出的光会在传输过程中发生相关诱导的光谱变化。随后各种光束在自由空间、光学系统、湍流大气、材料介质中的光谱变化受到了越来越多的关注。Pu等[18]指出,满足定标定律的光束经光栅衍射后会发生衍射诱导的光谱变化。Ji等[19]对GSM光束通过湍流大气后的光谱进行研究,结果发现,不管光源是否为准均匀光源,只要满足定标定律,光束在湍流大气中传输时,归一化光谱都与归一化源光谱相同。Tong等[20]分析了GSM光束通过各向同性介质后远场光谱的变化,并指出远场光谱的移动不依赖于光源的相干度、光谱密度和折射率。Zhu等[21]通过理论与实验研究了多色部分相干平顶光束的光谱变化,详细探讨了相对光谱移动与平顶阶数的关系,结果表明,轴上最大相对光谱位移出现在焦平面之后。然而,关于光束在不同生物组织传输过程中光谱变化的报道却很少,Zhou等[22]分析了随机电磁GSM光束在生物组织中的光谱移动,指出光谱移动取决于生物组织的分形维数、折射率起伏变化的系综平均方差及光源处的初始偏振度。
本文在广义惠更斯-菲涅耳原理的基础上,推导出GSM光束在生物组织中的光谱解析表达式,并研究了离轴距离、传输距离、生物组织样本(不同的折射率结构常数)和空间相关长度对GSM光束光谱变化的影响。
2 理论模型
在空间-频率域中,光源处GSM光束的交叉谱密度函数[23-24]为
式中:s1和s2分别为源面两点坐标矢量的大小;z为传输距离;ω为频率;S(0)为光束光源光谱;
由广义惠更斯-菲涅耳原理[25]可知,在生物组织中传输的GSM光束的交叉谱密度函数可表示为
式中:ρ1和ρ2分别为z平面内两点位置矢量的大小;k为波数,与ω的关系为k=ω/c,其中c为真空中的光速;ψ为由源平面传播到观测点球面波复杂相位的随机部分;*为复共轭;<·>为系综平均。根据Rytov相位结构函数的二次近似,湍流介质扰动引起的相位起伏<exp[ψ*(ρ1,s1)+ψ(ρ2,s2)]>可表示为[26]
其中,
式中:
为了便于计算,进行如下坐标变换:
令ρ1=ρ2=ρ,将(1)式、(3)式和(6)式代入(2)式,得
式中:S为GSM光束在生物组织中传输的光谱。
利用积分公式[27]
可得GSM光束在生物组织中传输的光谱解析表达式为
其中,
式中:ceiling(·)为向下取整函数;m=1,2,3,…;p、q、x、A均为运算过程中的参数。
当
式中:S'、ε'和A'均为当折射率结构常数为0,即光束在自由空间中传输时,为了区别(9)~(11)式的表达方式而引入的变量。
由(9)式和(12)式可知,GSM光束在生物组织和自由空间中传输时,光谱发生了变化。
要保持GSM光束在自由空间传输时的光谱不变,空间相干长度必需满足定标定律[19],则
式中:ω0为源光谱中心频率;γ为常数。
GSM光束的归一化光谱为[28]
式中:Smax(ρ,z,ωmax)为光谱S(ρ,z,ω)在点(ρ,z)处的最大值,ωmax为对应的频率。由(14)式可知,满足定标定律的GSM光束通过生物组织的归一化光谱等于归一化源光谱。
如果源光谱为
式中:S0为常数;Γ为源光谱谱宽。如果源光谱不满足定标定律,则令σ0(ω)=σ0,即σ0中不含参数ω,将(17)式代入(9)式,就可以得到光束在生物组织传输中的光谱解析表达式为
光谱最大值对应的频率ωmax由
决定。
3 数值计算与分析
研究光束在生物组织中传输时的光谱特征和变化有利于实现组织状态信息的定性或定量检测,实现不同病态组织的可视化,从而识别组织的病理状况[4]。下面讨论GSM光束在生物组织中传输时归一化光谱S(ω)随频率ω的变化,以及相对光谱位移Δω/ω0=(ωmax-ω)/ω0随离轴距离r、生物组织样本(不同的折射率结构常数
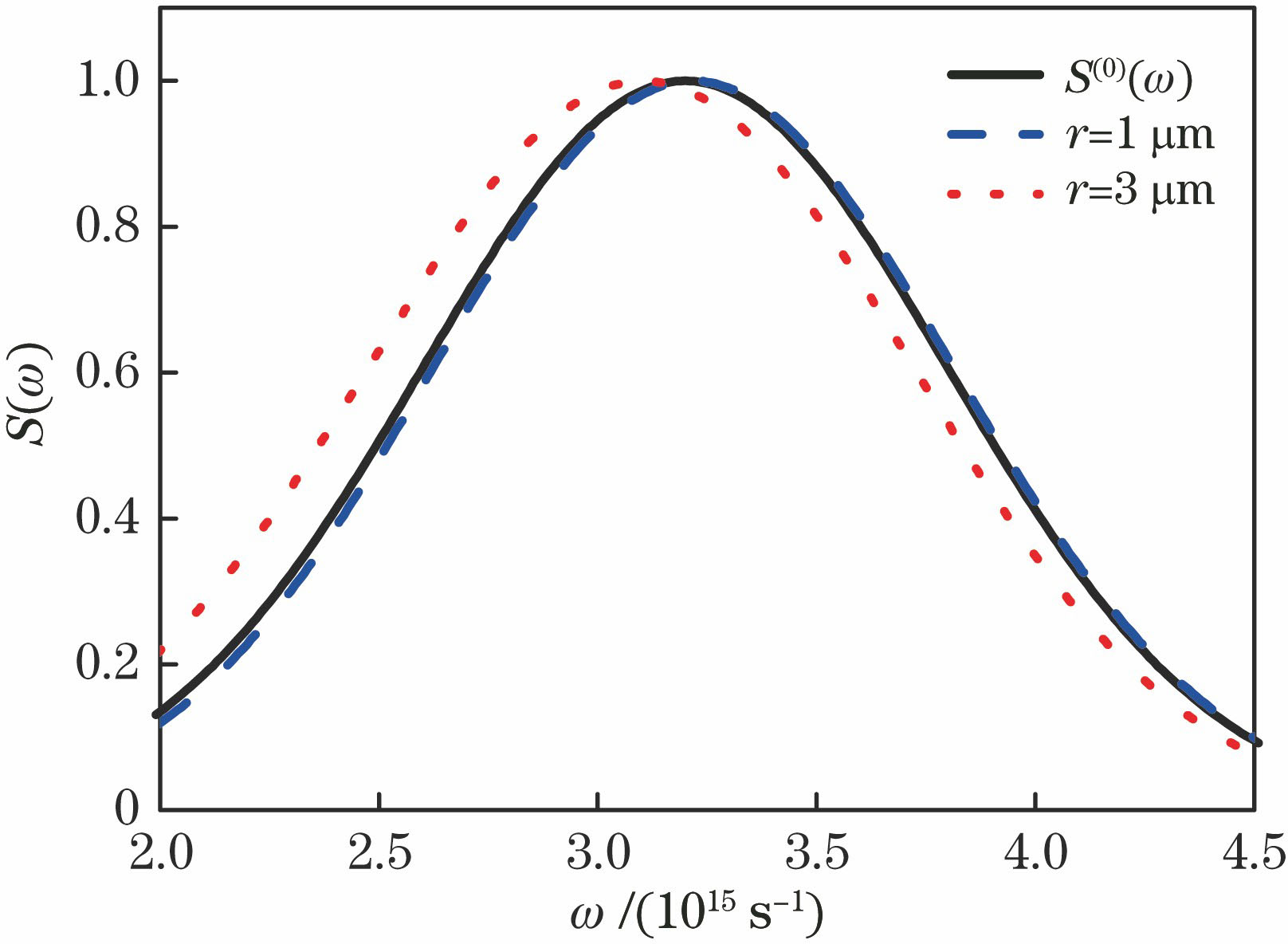
图 1. 离轴距离r取不同值时GSM光束在人体真皮组织中传输时的归一化光谱S(ω)随频率ω的变化
Fig. 1. Normalized spectrum S(ω) as a function of frequency ω of GSM beams propagating in upper dermis of human for different off-axis distances r

图 2. GSM光束在人体真皮组织中传输时不同传输距离处的相对光谱位移Δω/ω0随离轴距离r的变化
Fig. 2. Relative spectral shift Δω/ω0 as a function of off-axis distance r at different propagation distances for GSM beams propagating in upper dermis of human

图 3. GSM光束在不同的生物组织中传输时相对光谱位移Δω/ω0随传输距离z和离轴距离r的变化。(a)传输距离z;(b)离轴距离r
Fig. 3. Relative spectral shift Δω/ω0 as a function of propagation distance z and off-axis distance r for GSM beams propagating in different biological tissues. (a) Propagation distance z; (b) off-axis distance r
4 结论

图 4. 空间相关长度σ0取不同值时GSM光束在不同的生物组织中传输时的相对光谱位移Δω/ω0随传输距离z和离轴距离r的变化。(a)传输距离z;(b)离轴距离r
Fig. 4. Relative spectral shift Δω/ω0 as a function of propagation distance z and off-axis distance r for GSM beams propagating in different biological tissues with different spatial correlation lengths σ0. (a) Propagation distance z; (b) off-axis distance r
本文以广义惠更斯-菲涅耳原理为理论基础,利用推导出的GSM光束在生物组织中传输时光谱的解析表达式,研究了GSM光束在生物组织中传输时,场点离轴距离r、生物组织类型(不同的折射率结构常数
[1] 徐可欣, 高峰, 赵会娟. 生物医学光子学[M]. 北京: 科学出版社, 2011: 1- 8.
Xu KX, GaoF, Zhao HJ. Biomedical photonics[M]. Beijing: Science Press, 2011: 1- 8.
[2] 张镇西. 生物医学光子学诊断、治疗与监测[M]. 西安: 西安交通大学出版社, 2017: 3- 23.
Zhang ZX. Biomedical photonics: diagnosis, therapy and monitoring[M]. Xi'an: Xi'an Jiaotong University Press, 2017: 3- 23.
[3] 陈肖, 陆锦玲, 李鹏程. 生物组织黏弹性激光散斑检测方法研究进展[J]. 中国激光, 2018, 45(2): 0207005.
[4] 刘立新, 李梦珠, 赵志刚, 等. 高光谱成像技术在生物医学中的应用进展[J]. 中国激光, 2018, 45(2): 0207017.
[10] Gao W R. Effect of tissue structure on resolution of imaging systems[J]. Journal of Modern Optics, 2013, 60(15): 1290-1296.
[16] Chen X, Korotkova O. Optical beam propagation in soft anisotropic biological tissues[J]. OSA Continuum, 2018, 1(3): 1055-1067.
[23] 彭艳艳, 李晋红, 魏计林, 等. 非Kolmogorov大气湍流对高斯谢尔模型光束光谱变化的影响[J]. 激光与光电子学进展, 2014, 51(1): 010102.
[24] 彭艳艳. 激光大气传输中光谱变化的研究[D]. 太原: 太原科技大学, 2014: 15- 24.
Peng YY. Study on spectral changes of laser in atmospheric transmission[D]. Taiyuan: Taiyuan University of Science and Technology, 2014: 15- 24.
[25] Andrews LC, Phillips RL. Laser beam propagation through random media[M]. 2nd ed. Bellingham: SPIE, 2005: 135- 177.
[27] Gradshteyn IS, Ryzhik IM. Table of integrals, series and products[M]. New York: Academic Press, 2014: 365.
田燕男, 段美玲, 吴云光, 张永梅. 高斯谢尔模型光束在生物组织中的光谱变化[J]. 中国激光, 2019, 46(12): 1207001. Yannan Tian, Meiling Duan, Yunguang Wu, Yongmei Zhang. Changes in Spectra of Gaussian Schell-Model Beams Propagating in Biological Tissues[J]. Chinese Journal of Lasers, 2019, 46(12): 1207001.






