大鼠肾脏缺血再灌注过程的光学相干层析成像监测  下载: 1043次
下载: 1043次
1 引言
肾脏缺血再灌注(IR)是肾部分切除术、肾脏移植手术等肾脏疾病手术中不可避免的过程[1-3],该过程易引起肾脏微结构单元损伤及肾功能延迟恢复。肾脏中对缺血反应最为敏感的是出球部分的近端肾小管。急性肾小管损伤(ATN)是肾脏衰竭的一大诱因。目前,临床上评价肾脏状态的金标准是术后血肌酐和尿素氮等生化指标,或穿刺活检的病理检验。但这些手段都缺乏实时性。MRI(magnetic resonance imaging)血管造影可以观察肾小球的血流状态,但分辨率不足以观测微结构的变化;激光共聚焦扫描显微成像(TPM、MPM)可以对肾脏进行亚微米量级的高分辨率成像[4],但无法进行活体检测。因此,寻求一种可以对肾脏微结构进行无损、快速实时成像的检测新方法将有助于临床术中对肾脏缺血再灌注损伤进行评价,也有助于在肾脏移植前对移植肾的活性进行检测以及对肾源进行筛选。
光学相干层析成像(OCT)系统最早出现于20世纪90年代[5],它是一种基于干涉仪的采用低相干光光源的扫描成像系统。OCT已从时域系统(TD-OCT)发展到谱域系统(SD-OCT),其分辨率可达1~10 μm,扫描频率最高可达几百MHz[6-8]。人的肾小球直径为300~400 μm,肾小管管径约为30 μm[9]。OCT是一种能够实时评价肾脏微结构的比较理想的成像工具。Chen等[10]和Andrews[11-12]以Munich Wistar大鼠为模型,将OCT和多普勒OCT成像应用于活体肾脏,观察了肾脏缺血再灌注过程中肾小管结构和肾小球血流的变化。
已有文献采用的模型都是Munich Wistar大鼠,其肾小球位于浅表,从组织切片中可观察到与肾包膜直接接触的肾小球。该肾小球是一种较为特殊的肾单位类型[13-14]。为构建普适性肾脏疾病和肾脏移植模型,本文以标准Wistar大鼠为研究对象,对其肾脏进行二维、三维OCT活体成像,并对大鼠肾脏的肾脏缺血再灌注过程进行时序的OCT三维活体观测,探究了OCT对肾脏损伤状态评估的可行性。
2 材料与方法
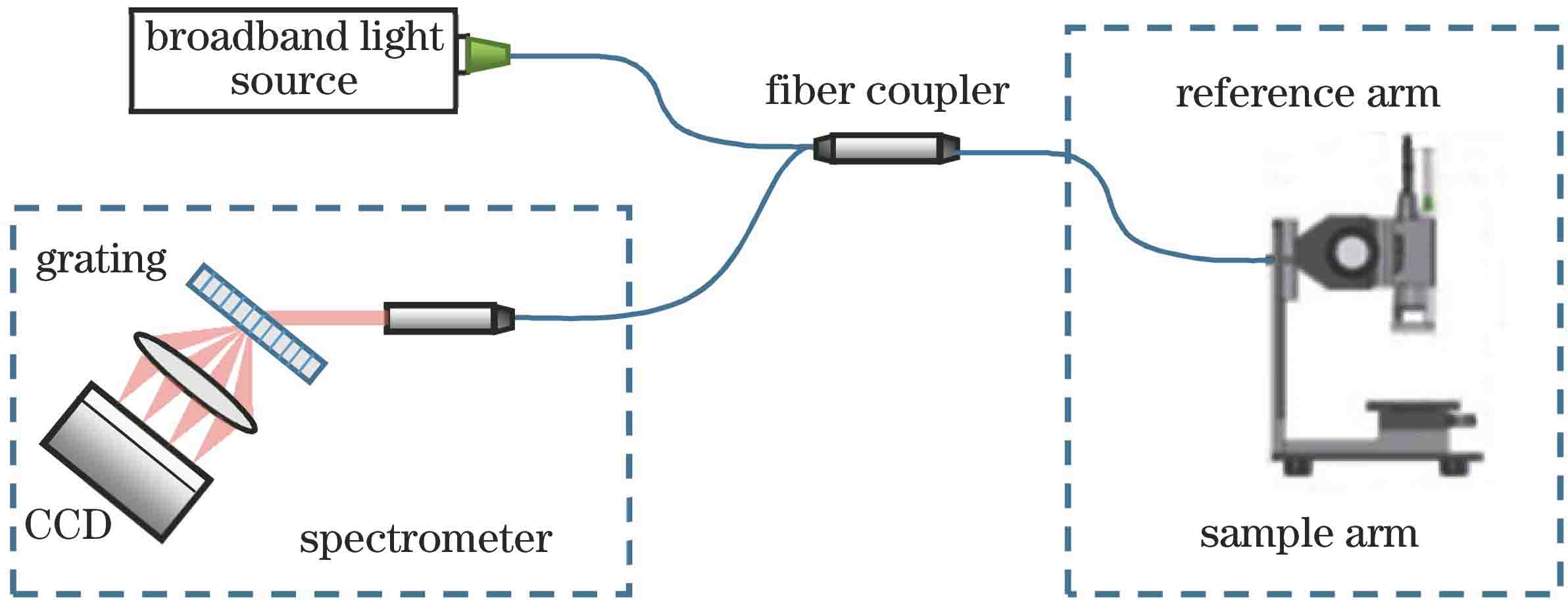
2.1 OCT系统
SDOCT(spectral-domain OCT)系统的轴向分辨率与光源的波长、SLD(superluminescent diode)的光谱谱线带宽有关。若光源的中心波长为λ0,光谱带宽为Δλ,光谱分布为高斯型,则轴向分辨率可表示为
式中:n表示样品的折射率。横向分辨率是由样品臂上物镜的光学数值孔径(NA)决定的,可以表示为
实验中采用光纤SDOCT系统对活体肾脏成像,系统装置如
2.2 动物准备
实验中使用清洁级Wistar大鼠(上海斯莱克公司),大鼠体重为(250±20) g,常规给予饲料和水。使用异氟烷对大鼠进行诱导麻醉(80%氧气,5 mL/L异氟烷)和维持麻醉(80%氧气,1.5 mL/L异氟烷)。麻醉后从左后腰处分别切开1~2 cm(长度)的皮肤与肌肉层,暴露左肾,剥离肾周脂肪和覆盖在肾脏上的筋膜,然后将肾脏固定在光学平台的支架上,并置于OCT探头正下方,如
2.3 成像与图像处理
为研究OCT图像对肾脏缺血再灌注过程的响应,在阻断血流前先对正常供血状态下的肾脏进行OCT二维和三维图像的采集,并作为正常肾脏的OCT参考图像。在缺血过程中获取完全缺血状态下的肾脏OCT图像,而后在再灌注过程中,每隔5 min采集肾脏二维、三维OCT图像。
通过旋转X振镜,使A线(轴向)沿着x轴方向完成扫描,形成一幅OCT二维图像(B-scan),即横断面图像(cross-section image),如

图 3. 大鼠肾脏的OCT图像。(a)横断面图像(x×z=3 mm×2.56 mm,dx×dz=6 μm×2.5 μm),T表示肾小管;(b)三维重构示意图;(c)肾脏的三维视图(x×y×z=1.5 mm×1.0 mm×0.2 mm,dx×dy×dz=5 μm×5 μm×2.5 μm); (d) en face图(x×z=3 mm×3 mm,dx×dy=6 μm×6 μm)
Fig. 3. OCT images of rat kidney. (a) Cross-section image (x×z=3 mm×2.56 mm, dx×dz=6 μm×2.5 μm), and the letter “T” represents kidney tubules; (b) schematic of 3D image reconstruction; (c) 3D image of kidney (x×y×z=1.5 mm×1.0 mm×0.2 mm,dx×dy×dz=5 μm×5 μm×2.5 μm); (d) en face image (x×z=3 mm×3 mm, dx×dy=6 μm×6 μm)
图像的后期处理过程包含以下几个步骤:
1) 图像预处理。主要对横断面图像进行平滑降噪处理,本实验使用3×3的中值滤波器对图像进行处理。
2) 图像配准。对连续的二维横断面图像进行配准。本文使用最小二乘配准方法对图像进行配准(Amira 5.4.3),配准后的图像消除了抖动的影响(如
3) 对配准后的图像重采样后重构三维图。
4) 对图像作插值处理及后续量化前处理,包括图像分割、微结构边缘和骨架提取等。

图 4. OCT横断面配准效果图(y-z面)。(a)未配准图像;(b)配准后图像
Fig. 4. Registration of a series of cross-section image (y-z plane). (a) Image directly reconstructed by OCT cross-section images; (b) image after registration
3 结果
3.1 肾脏病理结构的OCT图像表征

图 5. OCT与HE染色切片的对比。(a) OCT横断面图像;(b) HE染色切片(Olympus, 40×);(c)光强随深度分布的曲线(HE切片, 400×)
Fig. 5. Comparison diagram of OCT image and HE staining image. (a) Cross-section image; (b) HE staining section (Olympus, 40×); (c) distribution curve of light intensity with depth (HE staining section, 400×)
考虑到光在肾脏组织中的穿透深度,本文在
3.2 肾脏缺血再灌注过程的OCT观察
当肾脏缺血时,近端肾小管对其反应最为灵敏[20]。缺血时间过长的肾脏再灌注后,肾小管的内皮细胞肿胀,使得肾小管管腔收缩,管径变小,严重时内皮细胞会发生坏死脱落,再灌注后脱落的细胞易堵塞管腔,可能导致肾小管闭合失去功能,这可以从病理切片中观察到[15]。OCT成像速度较快,利用OCT可以实时观察活体缺血再灌注过程中这种即时的响应关系。

图 6. OCT横断面图像和en face图像。(a)再灌注10 min后;(b)再灌注15 min后;(c)再灌注20 min后;(d)再灌注30 min后
Fig. 6. OCT cross-section images and en face images. (a) 10 min after blood reperfusion; (b) 15 min after blood reperfusion; (c) 20 min after blood reperfusion; (d) 30 min after blood reperfusion
4 讨论
目前应用于临床肾脏状态评价的手段大多耗时或有损,虽然MRI或超声成像对肾脏具有较高的穿透深度,但无法对肾小管微结构成像;而激光共聚焦扫描显微镜只能检测离体样品。OCT作为一种无损的光学成像手段,其分辨率介于激光共聚焦扫描显微镜与超声成像之间,在组织中具有一定的穿透深度。目前,OCT系统的扫描频率为100 kHz左右,可对肾脏进行实时三维成像,便于快速获取诊断结果。本实验采用SDOCT系统对大鼠肾脏进行二维、三维成像,并将成像结果与HE染色切片进行了对比。
自2007年起,美国马里兰大学研究人员[9-12]就采用OCT和DOCT技术,对Munich Wistar大鼠的肾小管和肾小球进行结构和功能成像。针对本实验中的OCT成像结果,利用A扫描线光强分布计算光在肾脏中的穿透深度,并将计算结果与HE染色切片的结果进行比较,结果发现实验中该系统未能对肾小球成像。文献[ 13-14]表明,Munich Wistar大鼠的肾小球趋近于表面的肾包膜,甚至直接与肾包膜相连,包膜与第一层肾小球之间的肾皮质区缺失,而标准的Wistar大鼠与之不同。然而,就动物模型而言,标准Wistar大鼠的组织结构更具普适性,便于构建各种肾脏疾病模型,对其进行OCT研究更具有临床指导意义。
大鼠的心率约为4~5 beat/s。在对大鼠活体肾脏成像过程中,即使OCT的扫描频率达到76 kHz,采集的OCT三维图像在重构过程中仍会不可避免地产生帧与帧之间的错位,如
大鼠肾脏缺血再灌注过程的OCT监测结果表明,OCT对肾脏缺血再灌注过程响应灵敏,可以用来监测肾脏缺血前后的变化,并做出定性评价。病理学研究表明,因缺血再灌注而发生损伤的肾小管管腔会缩小或闭合。未来,可利用图像算法得到微结构的量化信息,如肾小管面密度和肾小管直径等,对缺血再灌注损伤进行定量评价。在大数据的基础上,结合深度学习的微结构自动量化有望准确快速地对肾脏的状态进行评估。
5 结论
OCT技术[5]发展至今已有近30年的历史,分辨率与扫描频率皆有较大提升[21],Full-field OCT[12-24]、超长聚焦深度[25-26]的研究以及内窥镜的结合使OCT的应用更为广泛,涉及眼、心脏、皮肤、胃肠道和肾脏等的无损成像与检测,尤其是在眼科的应用已推广至临床。本文使用中心波长为1300 nm的OCT对Wistar大鼠肾脏进行活体二维和三维成像,图像清晰地显示了肾皮质层的肾小管微结构(与肾脏组织病理学结构一致),而且OCT的扫描速度足够对肾脏状态进行实时的三维扫描观察。肾小管(特别是近端肾小管)是缺血过程中最易受损、反应最快的微结构,将OCT应用于肾脏缺血再灌注过程的监测后发现,OCT对缺血再灌注过程的响应比较灵敏:OCT图像可以直观快速地显示缺血时肾小管管腔的闭合,以及再灌注过程中管腔由于缺血时间不同而以不同的速度逐渐开放。综上所述,OCT在肾脏状态的评估方面具有广阔的应用前景。
[1] Pefanis A, Ierino F L, Murphy J M, et al. Regulated necrosis in kidney ischemia-reperfusion injury[J]. Kidney International, 2019, 96(2): 291-301.
[2] Khan T F T, Ahmad N, Serageldeen A S, et al. Implantation warm ischemia time in kidney transplant recipients: defining its limits and impact on early graft function[J]. Annals of Transplantation, 2019, 24: 432-438.
[3] Bove P, Bertolo R, Sandri M, et al. Assessing the impact of renal artery clamping during laparoscopic partial nephrectomy (LPN) for small renal masses: the rationale and design of the Clamp vs Off Clamp Kidney during LPN (CLOCK II) randomised phase III trial[J]. BJU International, 2019, 124(3): 365-367.
[4] 林宏心, 左宁, 卓双木, 等. 多光子显微技术在医学诊断中的应用[J]. 中国激光, 2018, 45(2): 0207014.
[5] Huang D, Swanson E A, Lin C P, et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181.
[6] Xue P, Fujimoto J G. Ultrahigh resolution optical coherence tomography with femtosecond Ti∶sapphire laser and photonic crystal fiber[J]. Science Bulletin, 2008, 53(13): 1963-1966.
[7] Klein T, Wieser W, Eigenwillig C M, et al. Megahertz OCT for ultrawide-field retinal imaging with a 1050 nm Fourier domain mode-locked laser[J]. Optics Express, 2011, 19(4): 3044-3062.
[8] 郭昕, 王向朝, 南楠, 等. 一种频域光学相干层析成像深度分辨率增强技术[J]. 光学学报, 2015, 35(3): 0311002.
[9] Onozato M L, Andrews P M, Li Q, et al. Optical coherence tomography of human kidney[J]. Journal of Urology, 2010, 183(5): 2090-2094.
[10] Chen Y, Andrews P M, Aguirre A D, et al. High-resolution three-dimensional optical coherence tomography imaging of kidney microanatomy ex vivo[J]. Journal of Biomedical Optics, 2007, 12(3): 034008.
[11] Andrews P M, Chen Y, Onozato M L, et al. High-resolution optical coherence tomography imaging of the living kidney[J]. Laboratory Investigation, 2008, 88(4): 441-449.
[13] Hackbarth H, Büttner D, Jarck D, et al. The distribution of glomeruli in the renal cortex of Munich Wistar (MW) rats[J]. Pflügers Archiv-European Journal of Physiology, 1982, 394(S1): R24.
[14] Shea S, Raskova J. Glomerular morphometry in the Munich-Wistar rat[J]. Microcirculation, Endothelium, and Lymphatics, 1985, 2(5): 499-515.
[15] Hesketh EE, CzopekA, ClayM, et al. Renal ischaemia reperfusion injury: a mouse model of injury and regeneration[J]. Journal of Visualized Experiments, 2014( 88): e51816.
[16] Wei J. WangY L, Zhang J, et al. A mouse model of renal ischemia-reperfusion injury solely induced by cold ischemia[J]. American Journal of Physiology-Renal Physiology, 2019, 317(3): F616-F622.
[17] 沈毅, 陈志彦, 邱建榕, 等. 并行谱域光学相干层析成像技术的研究进展[J]. 中国激光, 2018, 45(2): 0207004.
[18] GanY, YaoW, Myers KM, et al. An automated 3D registration method for optical coherence tomography volumes[C]∥36th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, August 26-30, 2014. Chicago, IL. New York: IEEE, 2014: 3873- 3876.
[19] Ughi G J. Automatic three-dimensional registration of intravascular optical coherence tomography images[J]. Journal of Biomedical Optics, 2012, 17(2): 026005.
[20] Yin M. Kurvers H A J M, Tangelder G J, et al. Ischemia-reperfusion injury of rat kidney relates more to tubular than to microcirculatory disturbances[J]. Renal Failure, 1996, 18(2): 211-223.
[21] Hartl I, Li X D, Chudoba C, et al. Ultrahigh-resolution optical coherence tomography using continuum generation in an air-silica microstructure optical fiber[J]. Optics Letters, 2001, 26(9): 608-610.
[22] Latour G, Echard J P, Soulier B, et al. Structural and optical properties of wood and wood finishes studied using optical coherence tomography: application to an 18th century Italian violin[J]. Applied Optics, 2009, 48(33): 6485-6491.
[23] Latour G, Moreau J, Elias M, et al. Micro-spectrometry in the visible range with full-field optical coherence tomography for single absorbing layers[J]. Optics Communications, 2010, 283(23): 4810-4815.
[24] Xiao P, Mazlin V, Grieve K, et al. In vivo high-resolution human retinal imaging with wavefront-correctionless full-field OCT[J]. Optica, 2018, 5(4): 409-412.
[25] Grulkowski I, Liu J J, Potsaid B, et al. High-precision, high-accuracy ultralong-range swept-source optical coherence tomography using vertical cavity surface emitting laser light source[J]. Optics Letters, 2013, 38(5): 673-675.
Article Outline
方玉宏, 龚玮, 杨德圆, 郑莉琴, 谢树森. 大鼠肾脏缺血再灌注过程的光学相干层析成像监测[J]. 中国激光, 2020, 47(6): 0607002. Fang Yuhong, Gong Wei, Yang Deyuan, Zheng Liqin, Xie Shusen. Monitoring of Ischemia-Reperfusion Process of Rat Kidney Using Optical Coherence Tomography[J]. Chinese Journal of Lasers, 2020, 47(6): 0607002.