基于数字全息术的近场成像与应用  下载: 2938次特邀综述
下载: 2938次特邀综述
1 引言
当一束光波照射到物体上时,会在物体表面发生散射,其散射光场可分为两部分:一部分是场分布沿垂直于物体表面方向呈指数衰减的倏逝波;另一部分是由物体表面自由传播到空间无限远处的辐射波[1-2]。其中,倏逝波的纵向深度仅有百纳米量级,因而仅存在于物体表面附近亚波长范围内的近场区域[3]。近年来,随着纳米技术的迅猛发展,人们对位于近场区域的光场行为及其应用的研究愈加深入,并逐渐形成一门新的学科分支——近场光学[4]。近场光学技术可以突破传统光学衍射极限的限制,而且位于近场区域的光场对外部环境变化的响应灵敏度很高,因而近场光学技术可被应用于超分辨成像、生物表征与诊断、环境参量感知和微量气体探测等领域[5-13]。近场光学成像与测量有许多实现途径,本文主要讨论基于全内反射(TIR)和表面等离子体共振(SPR)原理的近场成像和测量方法。
利用基于TIR的近场测量方法可对处于物体表面近场区域的样品进行高分辨成像和动态监测,现已成为分析化学、生物学、医药学等领域的重要测量手段之一。其中,TIR荧光显微术(TIRFM)利用TIR产生的倏逝波照明位于近场区域的生物样品,使样品荧光团分子受激发而产生荧光,再利用远场探测装置收集荧光,最终得到携带样品精细信息的光学图像[14-19]。此外,发生TIR时,由于反射光波的反射相移与位于TIR近场区域介质样品的折射率之间存在量化关系,因此根据利用外差干涉技术测量的TIR条件下反射光波两个正交偏振分量的相位差可反推出介质样品的折射率[20]。相移干涉技术利用相移方法解调发生TIR时反射光波的相移,可以实现对介质样品折射率的宽场甚至动态测量[21-22]。
虽然利用上述基于TIR原理的近场测量方法可获得位于近场区域介质样品的折射率和相关参量,并且测量范围较大,但是其测量灵敏度有限,在表征近场区域样品物性的微小变化时遇到了瓶颈。相对而言,基于SPR原理的近场测量方法具有探测灵敏度高、光学信号强等优点,并且相比TIR荧光显微测量方法,其对生物的毒性更低,因而在生物化学等领域具有独特优势[23]。利用SPR效应实现近场测量的基本原理如下:当一束振动方向平行于入射面的p偏振单色平面光波以一定角度入射到金属表面上时,在一定条件下,金属表面近场区域将会发生SPR,此时位于金属表面近场区域的介质样品的折射率和相关参量的微小变化将引起反射光波复振幅(振幅和相位)发生变化,于是,通过测量发生SPR时反射光波复振幅分布的变化,即可对样品折射率等参量的分布及其微小变化进行高灵敏度感知[24]。按照测量对象的不同,可将相应的测量方法分为两种:一种是基于反射光波强度的测量,包括反射光波的强度反射率、SPR激发角,以及SPR光谱测量等[25-32];另一种是基于反射光波相位的测量[33-39]。前者的优势是测量范围大,后者的优势则是探测灵敏度非常高[40],可以说,这两种测量方法正好优势互补。除了进行传感测量外,基于SPR原理的成像系统——表面等离子体显微镜(SPM)利用表面等离子体波(或表面等离激元)作为照明光源,可对位于近场区域的介质样品进行高衬比度、高分辨率成像[41]。其中,棱镜耦合的SPM系统最早被提出,其结构简单,易搭建,可用来对薄膜、势能波、混合液滴和小分子等多种样品进行成像[42-46]。然而,该系统存在数值孔径小、放大倍率受限、图像畸变严重等不足。基于此,研究者进一步提出了高数值孔径油浸物镜(以下简称物镜)耦合的SPM系统,其特点是通过匹配油使镀有金属膜的盖玻片与物镜耦合,以在金属膜表面近场区域激发SPP,从而可以突破上述局限,在提高放大倍率的同时又不致引起图像畸变,在生物化学等领域具有广阔的应用前景[47-58]。
综上,由于位于近场区域的倏逝波衰减迅速,通常难以在远场收集,因此需要发展一种新的测量方法,从而能够在远场对近场区域的样品进行高衬比度成像和高精度表征。数字全息术是一种基于传统光学全息术原理,采用电荷耦合器件(CCD)等光电成像器件记录全息图,并利用计算机数值模拟其衍射过程,实现物光波复振幅数值重建的光场成像技术[59-68]。全息像或物光波复振幅的数值重建是数字全息术的核心:首先,利用数字图像处理手段对数字全息图进行必要的预处理,以消除数字全息图中的随机噪声;其次,根据标量衍射理论,利用计算机模拟光波经全息图衍射后的传播过程,实现物光波复振幅分布的数值重建,进而从中获得待测物场的强度像或相位像。将数字全息术与基于TIR/SPR原理的近场测量方法相结合,利用数字全息术获得TIR/SPR过程中反射光波在远场的复振幅分布,即可实现对近场区域样品折射率和相关物性参量的全场、动态、无标记、高衬比度、高精度的测量与表征。例如,Hu等[69-70]将TIR/SPR与数字全息术结合,实现了对生物细胞膜和葡萄糖溶液强度和相位分布的同时成像;Mandracchia等[71]利用物镜耦合SPM系统,引入数字全息干涉光路,实现了对光刻胶阵列结构的形貌测量和对液滴挥发过程的动态监测。本文主要介绍利用数字全息术与TIR/SPR相结合实现近场成像的方法,及相关应用的研究进展。
2 基于TIR数字全息术的近场成像
2.1 TIR数字全息术原理
2.1.1 反射相移与近场区域电介质折射率的关系
当一束平面光波自光密介质进入光疏介质时,若入射角大于TIR临界角,则光波能量全部自两种介质的分界面反射回光密介质。然而,在分界面处光疏介质一侧仍存在着相位沿界面传播、振幅沿界面法线方向呈指数衰减的倏逝波,其穿透深度大约在波长量级,故而称为近场区域。
由(1)式可以看出,若已知入射光波的入射角θ、棱镜介质的折射率n1,以及反射光波中s/p偏振分量对应的反射相移φs/φp分布,就可以计算出位于TIR近场区域内电介质的折射率n2及其分布。
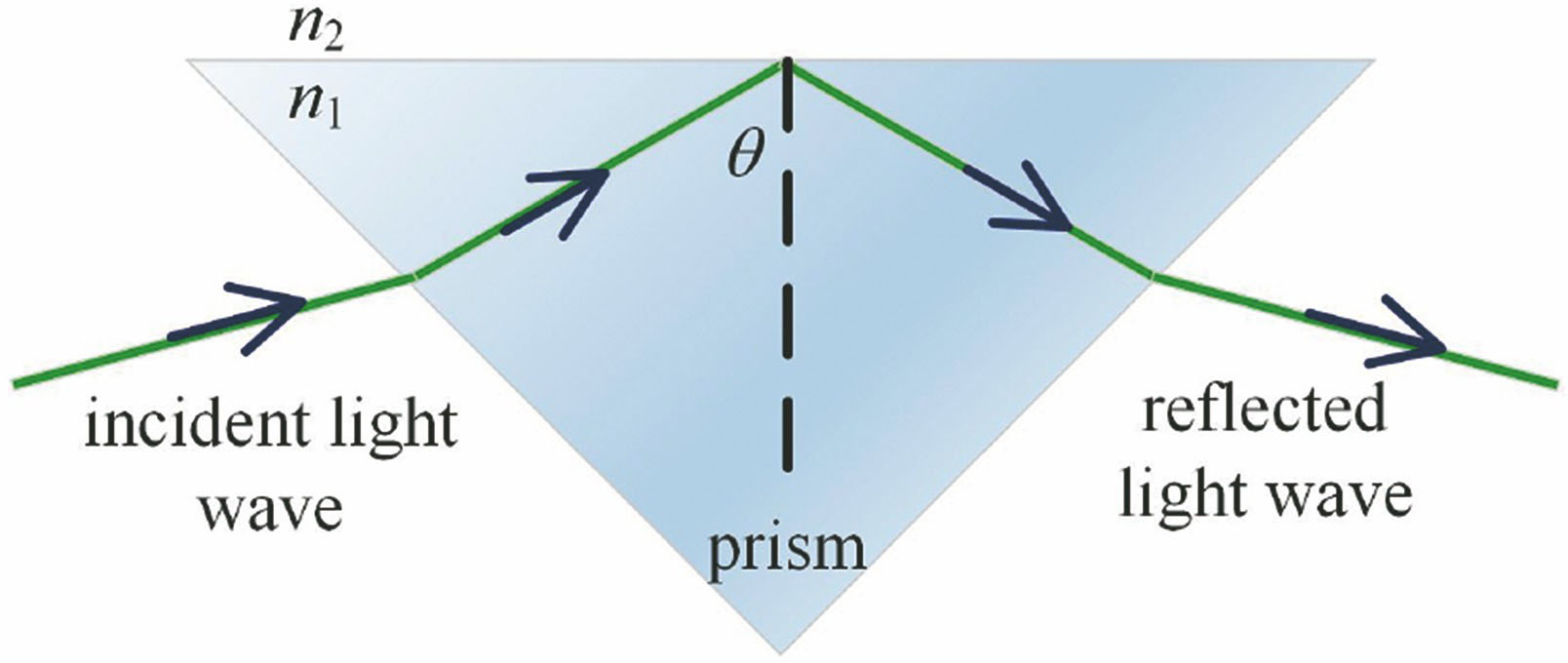
图 1. 直角棱镜-电介质界面处的全反射
Fig. 1. TIR on the interface of rectangular prism anddielectric layer

图 2. TIR相移φ随电介质折射率n2变化的理论曲线
Fig. 2. Theoretical curves of TIR phase shift φ varying with dielectric refractive index n2
2.1.2 TIR数字全息干涉术
利用数字全息术测量出发生TIR时反射光波的反射相移,即可定量获得位于棱镜表面近场区域电介质的折射率分布。实际应用中常采用二次曝光全息干涉术,即在放置样品前记录一幅背景全息图(设此时电介质为空气,n2=1),放置样品后再记录一幅含有样品信息的全息图,利用计算机基于两幅数字全息图数值重建出相应的反射光波复振幅,并由此得到相应的反射光波相位分布,进而结合相位相减算法计算出消除了背景噪声的两重建反射光波的相位差分布,此相位差正好等于发生TIR时反射光波的反射相移差。最后,根据(1)式获得电介质折射率分布n2(x,y)的定量测量结果,其中,x和y分别表示两个方向正交的坐标参量[72]。
2.2 基于TIR数字全息术的近场成像与测量应用
2.2.1 电介质折射率的测量
2.2.2 电介质折射率和几何厚度的同时测量
在利用TIR数字全息术测量电介质样品折射率n2(x,y)的基础上,进一步引入透射式数字全息显微术(DHM),利用介质对透射光波相位的调制原理,还可同时获得待测介质的几何厚度h(x,y)[73],可表示为
式中:Δϕ(x,y)为经待测介质和环境介质调制的透射光波的相位差分布;λ为透射光波的波长;n0为周围环境介质的折射率(当环境介质为空气时,n0=1)。
![基于马赫-曾德尔干涉仪的TIR数字全息测量光路[72]](/richHtml/gxxb/2020/40/1/0111008/img_3.jpg)
图 3. 基于马赫-曾德尔干涉仪的TIR数字全息测量光路[72]
Fig. 3. Experimental setup for TIR digital holography based on Mach-Zehnder interferometer[72]
![不同质量分数的甘油-水混合溶液引起的反射光波的相位差分布实验测量结果[72]。(a) 40%;(b) 60%;(c) 75%](/richHtml/gxxb/2020/40/1/0111008/img_4.jpg)
图 4. 不同质量分数的甘油-水混合溶液引起的反射光波的相位差分布实验测量结果[72]。(a) 40%;(b) 60%;(c) 75%
Fig. 4. Experimental results of phase difference distribution of reflected light wave induced by glycerol-water mixtures with different mass fractions[72]. (a) 40%; (b) 60%; (c) 75%
表 1. 甘油-水混合溶液的折射率测量结果[72]
Table 1. Measurement results of refractive index of glycerol-water mixtures[72]
|
3 基于SPR全息显微术的近场成像
3.1 SPR全息显微术的基本原理
3.1.1 SPR
一束振动面平行于入射面的线偏振(即p偏振)光波入射到金属-电介质界面时,在特定波长和入射角度条件(即满足波矢匹配条件)下,会在金属表面附近激发出沿界面传播的有序电子疏密振动——SPR,伴随产生的表面等离子体波表现为一种振幅沿界面法线方向迅速衰减的倏逝波,因而仅存在于金属表面近场区域。SPR的发生导致入射光波的反射率达到最小。这里将可以激发SPR的特定入射角度称为SPR激发角。
![具有不同折射率和几何厚度的液滴阵列的实验测量结果[73]。(a)二维和(b)一维折射率分布;(c)三维和(d)一维几何厚度分布](/richHtml/gxxb/2020/40/1/0111008/img_6.jpg)
图 6. 具有不同折射率和几何厚度的液滴阵列的实验测量结果[73]。(a)二维和(b)一维折射率分布;(c)三维和(d)一维几何厚度分布
Fig. 6. Experimental results of droplet array with different refractive indexes and geometrical thicknesses[73]. (a) Two-dimensional and (b) one-dimensional profiles of refractive index; (c) three-dimensional and (d) one-dimensional profiles of geometrical thickness
根据实际情况的不同,在金属表面的近场区域内,可能存在多层介质,此时激发SPR的Kretschmann结构为SPR多层结构模型。
利用发生SPR时反射光波在远场的变化可反推出位于近场区域介质样品相关参量的变化。其中,反射光波相对于入射光波的复振幅反射系数r可通过菲涅耳公式计算得出[74],具体计算式为
式中:i表示第i层介质;θ表示光波的入射角;ri,i+1与ri+1,N分别为光波在相邻两种介质之间和第i+1与第N层介质之间的复振幅反射系数;di+1表示第i+1层的厚度;εi表示第i层的介电常数;kzi与kz(i+1)分别为第i层与第i+1层介质中透射光波沿z方向的波数;λ表示光波的波长。进一步地,反射光波相对于入射光波的强度反射率和反射相移可以分别表示为
以SPR三层结构模型为例,当发生SPR且第三层电介质的折射率发生微小变化时,在SPR动态范围内,反射光波的强度反射率会迅速下降,产生一个“低谷”。相应地,反射相移曲线的斜率迅速增大,如

图 8. SPR过程中反射光波的强度和相移随介质折射率变化的理论曲线
Fig. 8. Theoretical curves of intensity and phase shift of reflected light wave varying with dielectric refractive index during SPR
3.1.2 SPR全息显微术
将SPR原理与DHM相结合,可得到一种新的近场成像与测量技术——SPR全息显微术(SPRHM),其特点是利用DHM获得发生SPR时携带样品信息的反射光波的强度和相位图像,进而结合SPR理论曲线,可进一步计算出样品的折射率和相关特征参量。与TIR数字全息干涉术类似,SPRHM同样采用二次曝光全息干涉术,在样品放置前后分别记录一幅背景全息图和携带样品信息的全息图,并根据这两幅数字全息图计算得到相应反射光波的相位分布,通过相位相减操作最终得到消除了背景噪声的反射物光波的相位差分布,即发生SPR时反射光波的反射相移差分布。
相较于发生SPR过程中反射光波的强度测量方式,相位测量方式具有更高的探测灵敏度。以下介绍的工作主要围绕SPR发生过程中反射光波的相位探测展开[40]。
3.2 基于SPR全息显微术的近场成像与应用
SRPHM主要采用棱镜耦合和物镜耦合两种SPR激发方式,产生SPR的薄膜可以是金膜,也可以是其他金属良导体或拓扑绝缘体薄膜。
3.2.1 基于棱镜耦合的SPR全息显微测量系统
从研究对象角度可将棱镜耦合SPRHM测量系统的应用分为4个方面,分别是电介质折射率微小变化的高灵敏度测量、生物组织的复振幅(强度、相位)成像、二维材料复折射率的测量,及电介质折射率和几何厚度的同时测量。
1) 电介质折射率微小变化的高灵敏度测量
利用SPRHM可测得发生SPR时反射光波的反射相移差Δφ,当SPR三层结构中其他参量已知时,Δφ只和位于金属膜(大多数实验中均为金膜)表面近场区域样品的折射率有关。为了结合SPR理论曲线计算出待测介质样品的折射率n3,提出了一种对SPR反射相移理论曲线进行多项式拟合的方法来得到曲线的多项式表达[75]:
式中:各项系数分别为p1=-9.593×10-12,p2=-6.151×10-10,p3=1.243×10-8,p4=9.017×10-7,p5=-3.45×10-5,p6=1.3340。相应的拟合曲线如
![电介质折射率n3随反射相移差Δφ的变化[75]](/richHtml/gxxb/2020/40/1/0111008/img_9.jpg)
图 9. 电介质折射率n3随反射相移差Δφ的变化[75]
Fig. 9. Refractive index of dielectric n3 versus reflection phase shift difference Δφ [75]
利用
![乙醇-水混合溶液测量结果[75]。(a)反射相移差随时间的变化;(b)折射率随时间的微小变化](/richHtml/gxxb/2020/40/1/0111008/img_11.jpg)
图 11. 乙醇-水混合溶液测量结果[75]。(a)反射相移差随时间的变化;(b)折射率随时间的微小变化
Fig. 11. Experiment results of alcohol-water mixture[75]. (a) Reflection phase shift difference versus time; (b) tiny variation of refractive index with time
虽然基于反射光波相位探测的SPRHM测量灵敏度高,但SPR的动态范围较小,其对于介质折射率变化范围较大的动态过程的测量仍面临困难。为拓宽SPRHM系统的动态测量范围,并保持高的测量灵敏度,可采用波长复用技术。如
![632.8 nm和660 nm激发波长下反射相移差Δφ随介质折射率n3的变化关系[76]](/richHtml/gxxb/2020/40/1/0111008/img_12.jpg)
图 12. 632.8 nm和660 nm激发波长下反射相移差Δφ随介质折射率n3的变化关系[76]
Fig. 12. Reflection phase shift difference Δφ versus dielectric refractive index n3 at wavelengths of 632.8 nm and 660 nm[76]
2) 生物组织的相位成像
利用棱镜耦合SPRHM实验系统不仅可以对位于近场区域的电介质样品折射率的微小变化进行高灵敏度的动态测量,也可以对具有低折射率衬比度的生物样品进行清晰的相位成像。
![乙醇-水混合溶液挥发过程中其对660 nm光波的折射率的微小变化[76]。(a)直接对660 nm光波进行测量的结果;(b)由632.8 nm光波的测量值换算到660 nm光波的折射率](/richHtml/gxxb/2020/40/1/0111008/img_13.jpg)
图 13. 乙醇-水混合溶液挥发过程中其对660 nm光波的折射率的微小变化[76]。(a)直接对660 nm光波进行测量的结果;(b)由632.8 nm光波的测量值换算到660 nm光波的折射率
Fig. 13. Tiny variation of refractive index of alcohol-water mixture for 660 nm light wave during volatilization process[76]. (a) Result of direct measurement for 660 nm light wave; (b) refractive index of 660 nm light wave converted from measured value of 632.8 nm light wave
![利用单波长SPRHM实验系统得到的洋葱组织相位图像[75]。(a)数字全息图;(b)重建的相位图像](/richHtml/gxxb/2020/40/1/0111008/img_14.jpg)
图 14. 利用单波长SPRHM实验系统得到的洋葱组织相位图像[75]。(a)数字全息图;(b)重建的相位图像
Fig. 14. Phase image of onion tissue obtained by single-wavelength SPRHM experimental setup[75]. (a) Digital hologram; (b) reconstructed phase image
![利用双波长SPRHM实验系统得到的洋葱组织相位图像[76]。(a)数字全息图;(b)激发波长为660 nm时的相位图像;(c)激发波长为632.8 nm时的相位图像](/richHtml/gxxb/2020/40/1/0111008/img_15.jpg)
图 15. 利用双波长SPRHM实验系统得到的洋葱组织相位图像[76]。(a)数字全息图;(b)激发波长为660 nm时的相位图像;(c)激发波长为632.8 nm时的相位图像
Fig. 15. Phase images of onion tissue obtained by two-wavelength SPRHM experimental setup[76]. (a) Digital holograms; (b) phase images at the wavelength of 660 nm; (c) phase images at the wavelength of 632.8 nm
3) 二维材料复折射率的测量
二维材料由于其原子量级的厚度而具有不同于体块材料的优异光电特性,被广泛应用于光电探测器、场效应管,以及柔性电子器件等领域[77-79]。因此,无论是从基础研究还是从应用角度考虑,对其物性参量进行测量表征均具有重要意义。对于折射率为复数的二维材料,上述方法只能测量出其复折射率的实部,无法同时解调出虚部。要利用SPRHM实验系统同时测量复折射率的实部和虚部,可采用一种最小二乘拟合方法[80]。以SPR 5层结构模型[棱镜-铬层(黏附层)-金层-待测介质层-已知折射率的电介质层]为例,进行反射相移差Δφ的测量,结果如
![不同待测介质对应的反射相移差Δφ随电介质折射率n5变化的理论曲线[80]。(a)实部n4不同;(b)虚部k4不同](/richHtml/gxxb/2020/40/1/0111008/img_16.jpg)
图 16. 不同待测介质对应的反射相移差Δφ随电介质折射率n5变化的理论曲线[80]。(a)实部n4不同;(b)虚部k4不同
Fig. 16. Theoretical curves of reflection phase shift difference Δφ corresponding to different tested films versus refractive index of dielectric layer
假设待测介质为二维材料薄膜,利用SPRHM实验系统,测得不同电介质折射率下反射光波的反射相移差,并引入最小二乘方法将理论曲线和实验数据进行拟合,则可计算出二维材料的复折射率
式中:m表示第m种电介质;M表示电介质总数;Δφ'和Δφ分别表示实验测量和理论计算的反射相移差。基于上述原理及
![不同层数石墨烯薄膜对应的反射相移差测量结果和最小二乘拟合曲线[80]](/richHtml/gxxb/2020/40/1/0111008/img_17.jpg)
图 17. 不同层数石墨烯薄膜对应的反射相移差测量结果和最小二乘拟合曲线[80]
Fig. 17. Measurement results and least-square fitting curves of the reflection phase shift difference for graphene films with different numbers of layers[80]
表 2. 石墨烯样品复折射率的测量结果[80]
Table 2. Measured complex refractive indices of graphene specimens[80]
|
4) 电介质折射率和几何厚度的同时测量
在棱镜耦合SPRHM实验系统基础上,集成反射式DHM,可实现对位于近场区域处电介质的折射率和几何厚度(或形貌)的同时测量。对于反射式DHM,一束光波垂直穿过电介质样品到达其底部金膜表面,经金膜反射后再次穿过样品,自样品出射的反射光波的相位变化Δϕ2(x,y)与样品的折射率n3(x,y)、厚度h(x,y)、周围介质的折射率n0(x,y)和入射光波长λ有关[81]:
假设周围环境介质为空气[n0(x,y)=1],利用反射式DHM测得该反射光波的相位变化Δϕ2(x,y),利用棱镜耦合SPRHM实验系统测得电介质样品的折射率n3(x,y),则样品的厚度h(x,y)可以直接由下式计算得到[81]:
借助偏振和角度复用技术将反射式DHM与SPRHM实验系统相集成,可以实现电介质样品折射率和厚度的同时测量,光路如
![集成棱镜耦合SPRHM与反射式DHM的实验光路[81]](/richHtml/gxxb/2020/40/1/0111008/img_18.jpg)
图 18. 集成棱镜耦合SPRHM与反射式DHM的实验光路[81]
Fig. 18. Experimental optical paths of integrated prism coupling SPRHM and reflection-type DHM[81]
![乙醇-水混合溶液(初始体积比为1∶2)挥发过程的测量结果[81]。(a) Δ?1随时间的变化;(b) Δ?2随时间的变化;(c) n3随时间的变化;(d) hmax随时间的变化](/richHtml/gxxb/2020/40/1/0111008/img_19.jpg)
图 19. 乙醇-水混合溶液(初始体积比为1∶2)挥发过程的测量结果[81]。(a) Δ?1随时间的变化;(b) Δ?2随时间的变化;(c) n3随时间的变化;(d) hmax随时间的变化
Fig. 19. Measurement results of volatilization process of alcohol-water mixture with initial volume ratio of 1∶2[81]. (a) Δ?1 versus time; (b) Δ?2 versus time; (c) n3 versus time; (d) hmax versus time
3.2.2 基于物镜耦合的SPR全息显微测量系统
上述棱镜耦合SPRHM实验系统的SPR激发结构简单,但放大倍率较小,并且成像存在畸变,于是又发展出了物镜耦合SPRHM实验系统,其SPR激发结构如
![基于共路干涉仪的物镜耦合SPRHM实验系统[82]](/richHtml/gxxb/2020/40/1/0111008/img_21.jpg)
图 21. 基于共路干涉仪的物镜耦合SPRHM实验系统[82]
Fig. 21. Objective-coupling SPRHM experimental setup based on common-path interferometer[82]
![ZnO薄膜样品的实验测量结果[82]。(a)强度反射率;(b)反射相移差;(c)三维厚度分布;(d)一维厚度分布](/richHtml/gxxb/2020/40/1/0111008/img_22.jpg)
图 22. ZnO薄膜样品的实验测量结果[82]。(a)强度反射率;(b)反射相移差;(c)三维厚度分布;(d)一维厚度分布
Fig. 22. Experimental measurement results of ZnO thin film[82]. (a) Intensity reflectivity; (b) reflection phase shift difference; (c) 3D thickness distribution; (d) 1D thickness distribution
3.2.3 基于拓扑绝缘体的SPR数字全息术
以上SPR激发结构装置均采用金膜产生SPR,其缺点是所需激发角较大,导致动态测量范围偏小。研究表明,采用拓扑绝缘体材料(Sb2Te3)替代贵金属金,同样可以实现可见光波段的SPR激发;而且,相比于基于镀金膜的SPR激发结构,基于拓扑绝缘体薄膜的SPR激发结构具有更小的SPR激发角和更宽的动态测量范围。
![基于Sb2Te3拓扑绝缘体的SPR数字全息共路干涉仪[83]](/richHtml/gxxb/2020/40/1/0111008/img_23.jpg)
图 23. 基于Sb2Te3拓扑绝缘体的SPR数字全息共路干涉仪[83]
Fig. 23. SPR digital holographic common-path interferometer based on Sb2Te3 topological insulator[83]
![超纯水及乙醇-水混合溶液的实验测量结果[83]。(a)待测样品为超纯水时反射光波的强度反射率随入射角的变化;(b)待测样品为乙醇-水溶液时反射光波的强度反射率和相位随时间的变化;(c)~(e)液滴在不同时刻的全息图、重建的相位图和强度图](/richHtml/gxxb/2020/40/1/0111008/img_24.jpg)
图 24. 超纯水及乙醇-水混合溶液的实验测量结果[83]。(a)待测样品为超纯水时反射光波的强度反射率随入射角的变化;(b)待测样品为乙醇-水溶液时反射光波的强度反射率和相位随时间的变化;(c)~(e)液滴在不同时刻的全息图、重建的相位图和强度图
Fig. 24. Experimental measurement results of ultrapure water and ethanol-water mixture[83]. (a) Reflectivity of reflected light versus incident angle when tested sample is ultrapure water; (b) reflectivity and phase of reflected light versus time when tested sample is ethanol-water mixture; (c)-(e) holograms, reconstructed phase images, and intensity images at different time
4 结束语
近场光学测量因不受衍射极限的限制、探测灵敏度高而成为近年来光学成像与测量领域的研究热点之一。基于TIR和SPR原理的近场成像与测量方法可在远场对近场区域样品的相关物性参量进行高灵敏度的测量与表征。利用数字全息术,可在远场对TIR/SPR过程中反射光波的复振幅实时地进行高精度数值重建,并从中获得TIR/SPR过程中位于近场区域介质样品的强度和相位图像,进而实现对介质样品相关物理参量,如复折射率等的测量和表征。相较于TIR方法,SPR方法具有更高的探测灵敏度。棱镜耦合SPRHM测量系统的SPR激发结构简单,但物镜耦合SPRHM测量系统不受成像畸变影响,并且有较大的放大倍率。此外,采用拓扑绝缘体等新型薄膜材料替代金膜可以使系统具有更小的SPR激发角和更大的动态测量范围。
未来的研究可进一步聚焦于:1)将角度复用/波长扫描技术引入到SPRHM中,以拓宽SPR的测量范围;2)发展新的数据解调方法以实现对介质薄膜厚度和介电常数等多参量的同时解调;3)优化SPRHM实验系统,最终探索其在生物样品折射率和微弱作用过程的动态测量、二维材料相关参量测量,及物性表征等方面的应用。
[1] Courjon D, Bainier C. Near field microscopy and near field optics[J]. Reports on Progress in Physics, 1994, 57(10): 989-1028.
[2] Girard C, Dereux A. Near-field optics theories[J]. Reports on Progress in Physics, 1996, 59(5): 657-699.
[3] Taitt C R, Anderson G P, Ligler F S. Evanescent wave fluorescence biosensors: advances of the last decade[J]. Biosensors and Bioelectronics, 2016, 76: 103-112.
[4] KawataS. Near-field optics and surface plasmon polaritons[M]. Berlin, Heidelberg: Springer, 2001.
[5] Dunn R C. Near-field scanning optical microscopy[J]. Chemical Reviews, 1999, 99(10): 2891-2928.
[6] Ma C B, Liu Z W. A super resolution metalens with phase compensation mechanism[J]. Applied Physics Letters, 2010, 96(18): 183103.
[7] Lu D, Liu Z W. Hyperlenses and metalenses for far-field super-resolution imaging[J]. Nature Communications, 2012, 3: 1205.
[8] Barbry M, Koval P, Marchesin F, et al. Atomistic near-field nanoplasmonics: reaching atomic-scale resolution in nanooptics[J]. Nano Letters, 2015, 15(5): 3410-3419.
[9] Khorasaninejad M, Chen W T, Devlin R C, et al. Metalenses at visible wavelengths: diffraction-limited focusing and subwavelength resolution imaging[J]. Science, 2016, 352(6290): 1190-1194.
[10] Jiang R H, Chen C, Lin D Z, et al. Near-field plasmonic probe with super resolution and high throughput and signal-to-noise ratio[J]. Nano Letters, 2018, 18(2): 881-885.
[11] Masson J F. Surface plasmon resonance clinical biosensors for medical diagnostics[J]. ACS Sensors, 2017, 2(1): 16-30.
[12] Notcovich A G, Zhuk V, Lipson S G. Surface plasmon resonance phase imaging[J]. Applied Physics Letters, 2000, 76(13): 1665-1667.
[13] Balistreri M L M, Korterik J P, Kuipers L, et al. Local observations of phase singularities in optical fields in waveguide structures[J]. Physical Review Letters, 2000, 85(2): 294-297.
[14] Axelrod D, Thompson N L, Burghardt T P. Total internal reflection fluorescent microscopy[J]. Journal of Microscopy, 1983, 129(1): 19-28.
[15] Kobitski A Y, Heyes C D, Nienhaus G U. Total internal reflection fluorescence microscopy: a powerful tool to study single quantum dots[J]. Applied Surface Science, 2004, 234: 86-92.
[16] Gumpp H, Stahl S W, Strackharn M, et al. Ultrastable combined atomic force and total internal fluorescence microscope[J]. Review of Scientific Instruments, 2009, 80(6): 063704.
[17] Chan C U, Ohl C D. Total-internal-reflection-fluorescence microscopy for the study of nanobubble dynamics[J]. Physical Review Letters, 2012, 109(17): 174501.
[18] Roostaie N, Sheykhi E, Japelaghi F, et al. A thin layer imaging with the total internal reflection fluorescence microscopy[J]. Journal of Optoelectronical Nanostructures, 2017, 2(3): 47-54.
[19] Song D, Yang R, Wang H L, et al. Development of dual-color total internal reflection fluorescence biosensor for simultaneous quantitation of two small molecules and their affinity constants with antibodies[J]. Biosensors and Bioelectronics, 2019, 126: 824-830.
[20] Chiu M H, Lee J Y, Su D C. Complex refractive-index measurement based on Fresnel's equations and the uses of heterodyne interferometry[J]. Applied Optics, 1999, 38(19): 4047-4052.
[21] Jian Z C, Hsieh P J, Hsieh H C, et al. A method for measuring two-dimensional refractive index distribution with the total internal reflection of p-polarized light and the phase-shifting interferometry[J]. Optics Communications, 2006, 268(1): 23-26.
[23] Hinman S S. McKeating K S, Cheng Q. Surface plasmon resonance: material and interface design for universal accessibility[J]. Analytical Chemistry, 2018, 90(1): 19-39.
[24] Kretschmann E, Raether H. Notizen: radiative decay of non radiative surface plasmons excited by light[J]. Zeitschrift Für Naturforschung A, 1968, 23(12): 2135-2136.
[25] Nylander C, Liedberg B, Lind T. Gas detection by means of surface plasmon resonance[J]. Sensors and Actuators, 1982, 3: 79-88.
[26] Homola J, Yee S S, Gauglitz G. Surface plasmon resonance sensors: review[J]. Sensors and Actuators B: Chemical, 1999, 54(1/2): 3-15.
[27] Green R J, Frazier R A, Shakesheff K M, et al. Surface plasmon resonance analysis of dynamic biological interactions with biomaterials[J]. Biomaterials, 2000, 21(18): 1823-1835.
[28] Steiner G. Surface plasmon resonance imaging[J]. Analytical and Bioanalytical Chemistry, 2004, 379(3): 328-331.
[29] Yih J N, Chien F C, Lin C Y, et al. Angular-interrogation attenuated total reflection metrology system for plasmonic sensors[J]. Applied Optics, 2005, 44(29): 6155-6162.
[30] Huang Z H, Wang X P, Zhan S Y, et al. Contrast-enhancing polarization control method for surface plasmon imaging sensor[J]. Optical Engineering, 2012, 51(9): 094402.
[31] Lan G Q, Liu S G, Zhang X R, et al. A simplified high figure-of-merit prism-free surface plasmon resonance refractive index sensor based on self adaptive angular interrogation[J]. Review of Scientific Instruments, 2015, 86(2): 025006.
[32] Wu L M, Guo J, Wang Q K, et al. Sensitivity enhancement by using few-layer black phosphorus-graphene/TMDCs heterostructure in surface plasmon resonance biochemical sensor[J]. Sensors and Actuators B: Chemical, 2017, 249: 542-548.
[33] Nikitin P I, Beloglazov A A, Kochergin V E, et al. Surface plasmon resonance interferometry for biological and chemical sensing[J]. Sensors and Actuators B: Chemical, 1999, 54(1/2): 43-50.
[34] Lee J Y, Shih H C, Hong C T, et al. Measurement of refractive index change by surface plasmon resonance and phase quadrature interferometry[J]. Optics Communications, 2007, 276(2): 283-287.
[35] Patskovsky S, Meunier M, Prasad P N, et al. Self-noise-filtering phase-sensitive surface plasmon resonance biosensing[J]. Optics Express, 2010, 18(14): 14353-14358.
[36] Huang Y H, Ho H P, Wu S Y, et al. Phase sensitive SPR sensor for wide dynamic range detection[J]. Optics Letters, 2011, 36(20): 4092-4094.
[39] Bera M, Banerjee J, Ray M. Experimental surface plasmon resonance modulated radially sheared interference imaging using a birefringent lens[J]. Applied Physics Letters, 2014, 104(25): 251104.
[40] Kabashin A V, Patskovsky S, Grigorenko A N. Phase and amplitude sensitivities in surface plasmon resonance bio and chemical sensing[J]. Optics Express, 2009, 17(23): 21191-21204.
[41] Rothenhäusler B, Knoll W. Surface-plasmon microscopy[J]. Nature, 1988, 332(6165): 615-617.
[42] Berger C E H, Kooyman R P H, Greve J. Resolution in surface plasmon microscopy[J]. Review of Scientific Instruments, 1994, 65(9): 2829-2836.
[43] Flätgen G, Krischer K, Pettinger B, et al. Two-dimensional imaging of potential waves in electrochemical systems by surface plasmon microscopy[J]. Science, 1995, 269(5224): 668-671.
[44] Brockman J M, Nelson B P, Corn R M. Surface plasmon resonance imaging measurements of ultrathin organic films[J]. Annual Review of Physical Chemistry, 2000, 51(1): 41-63.
[45] Kim I, Kihm K D. Measuring near-field nanoparticle concentration profiles by correlating surface plasmon resonance reflectance with effective refractive index of nanofluids[J]. Optics Letters, 2010, 35(3): 393-395.
[47] Huang B, Yu F, Zare R N. Surface plasmon resonance imaging using a high numerical aperture microscope objective[J]. Analytical Chemistry, 2007, 79(7): 2979-2983.
[48] Tan P S, Yuan X C, Lin J, et al. Surface plasmon polaritons generated by optical vortex beams[J]. Applied Physics Letters, 2008, 92(11): 111108.
[49] Su Y D, Chiu K C, Chang N S, et al. Study of cell-biosubstrate contacts via surface plasmon polariton phase microscopy[J]. Optics Express, 2010, 18(19): 20125-20135.
[50] Wang S, Shan X, Patel U, et al. Label-free imaging, detection, and mass measurement of single viruses by surface plasmon resonance[J]. Proceedings of the National Academy of Sciences, 2010, 107(37): 16028-16032.
[51] Wang Y X, Shan X N, Cui F J, et al. Electrochemical reactions in subfemtoliter-droplets studied with plasmonics-based electrochemical current microscopy[J]. Analytical Chemistry, 2015, 87(1): 494-498.
[52] Toma K, Kano H, Offenhäusser A. Label-free measurement of cell-electrode cleft gap distance with high spatial resolution surface plasmon microscopy[J]. ACS Nano, 2014, 8(12): 12612-12619.
[53] Peterson A W, Halter M, Tona A, et al. High resolution surface plasmon resonance imaging for single cells[J]. BMC Cell Biology, 2014, 15: 35.
[54] Chen Z X, Shan X N, Guan Y, et al. Imaging local heating and thermal diffusion of nanomaterials with plasmonic thermal microscopy[J]. ACS Nano, 2015, 9(12): 11574-11581.
[55] Yang Y Z, Yu H, Shan X N, et al. Label-free tracking of single organelle transportation in cells with nanometer precision using a plasmonic imaging technique[J]. Small, 2015, 11(24): 2878-2884.
[56] Shan X N, Chen S, Wang H, et al. Mapping local quantum capacitance and charged impurities in graphene via plasmonic impedance imaging[J]. Advanced Materials, 2015, 27(40): 6213-6219.
[57] Chao Y C, Shan X N, Tao N J. Appling plasmonics based electrochemical microscopy to thin-layer electrochemistry[J]. Journal of Electroanalytical Chemistry, 2016, 781: 161-165.
[58] Kreysing E, Hassani H, Hampe N, et al. Nanometer-resolved mapping of cell-substrate distances of contracting cardiomyocytes using surface plasmon resonance microscopy[J]. ACS Nano, 2018, 12(9): 8934-8942.
[59] Kim MK. Digital holographic microscopy[M]. New York, NY: Springer, 2011: 1- 8.
[60] Di J L, Zhao J L, Jiang H Z, et al. High resolution digital holographic microscopy with a wide field of view based on a synthetic aperture technique and use of linear CCD scanning[J]. Applied Optics, 2008, 47(30): 5654-5659.
[61] 邸江磊, 赵建林, 范琦, 等. 数字全息显微术中重建物场波前的相位校正[J]. 光学学报, 2008, 28(1): 56-61.
[62] Di J L, Zhao J L, Sun W W, et al. Phase aberration compensation of digital holographic microscopy based on least squares surface fitting[J]. Optics Communications, 2009, 282(19): 3873-3877.
[63] Di J L, Li Y, Xie M, et al. Dual-wavelength common-path digital holographic microscopy for quantitative phase imaging based on lateral shearing interferometry[J]. Applied Optics, 2016, 55(26): 7287-7293.
[64] Di J L, Yu Y, Wang Z M, et al. Quantitative measurement of thermal lensing in diode-side-pumped Nd∶YAG laser by use of digital holographic interferometry[J]. Optics Express, 2016, 24(25): 28185-28193.
[65] Ma C J, Li Y, Zhang J W, et al. Lateral shearing common-path digital holographic microscopy based on a slightly trapezoid Sagnac interferometer[J]. Optics Express, 2017, 25(12): 13659-13667.
[66] Li Y, Di J L, Ma C J, et al. Quantitative phase microscopy for cellular dynamics based on transport of intensity equation[J]. Optics Express, 2018, 26(1): 586-593.
[67] Xi T L, Di J L, Li Y, et al. Measurement of ultrafast combustion process of premixed ethylene/oxygen flames in narrow channel with digital holographic interferometry[J]. Optics Express, 2018, 26(22): 28497-28504.
[68] Dou J Z, Xi T L, Ma C J, et al. Measurement of full polarization states with hybrid holography based on geometric phase[J]. Optics Express, 2019, 27(6): 7968-7978.
[69] Hu C Y, Zhong J G, Weng J W. Digital holographic microscopy by use of surface plasmon resonance for imaging of cell membranes[J]. Journal of Biomedical Optics, 2010, 15(5): 056015.
[70] Li S P, Zhong J G. Simultaneous amplitude-contrast and phase-contrast surface plasmon resonance imaging by use of digital holography[J]. Biomedical Optics Express, 2012, 3(12): 3190-3202.
[71] Mandracchia B, Pagliarulo V, Paturzo M, et al. Surface plasmon resonance imaging by holographic enhanced mapping[J]. Analytical Chemistry, 2015, 87(8): 4124-4128.
[72] Zhang J W, Di J L, Li Y, et al. Dynamical measurement of refractive index distribution using digital holographic interferometry based on total internal reflection[J]. Optics Express, 2015, 23(21): 27328-27334.
[73] Zhang J W, Ma C J, Dai S Q, et al. Transmission and total internal reflection integrated digital holographic microscopy[J]. Optics Letters, 2016, 41(16): 3844-3847.
[74] Xiao C D, Sui S F. Characterization of surface plasmon resonance biosensor[J]. Sensors and Actuators B: Chemical, 2000, 66(1/2/3): 174-177.
[75] Zhang J W, Dai S Q, Ma C J, et al. Common-path digital holographic microscopy for near-field phase imaging based on surface plasmon resonance[J]. Applied Optics, 2017, 56(11): 3223-3228.
[76] Zhang J W, Dai S Q, Zhong J Z, et al. Wavelength-multiplexing surface plasmon holographic microscopy[J]. Optics Express, 2018, 26(10): 13549-13560.
[80] Dai S Q, Lu H, Zhang J W, et al. Complex refractive index measurement for atomic-layer materials via surface plasmon resonance holographic microscopy[J]. Optics Letters, 2019, 44(12): 2982-2985.
[81] Dai S Q, Zhang J W, Lu H, et al. Integrated digital holographic microscopy based on surface plasmon resonance[J]. Optics Express, 2018, 26(19): 25437-25445.
[82] Zhang J W, Dai S Q, Ma C J, et al. Compact surface plasmon holographic microscopy for near-field film mapping[J]. Optics Letters, 2017, 42(17): 3462-3465.
[83] Lu H, Dai S Q, Yue Z J, et al. Sb2Te3 topological insulator: surface plasmon resonance and application in refractive index monitoring[J]. Nanoscale, 2019, 11(11): 4759-4766.
Article Outline
戴思清, 豆嘉真, 张继巍, 邸江磊, 赵建林. 基于数字全息术的近场成像与应用[J]. 光学学报, 2020, 40(1): 0111008. Siqing Dai, Jiazhen Dou, Jiwei Zhang, Jianglei Di, Jianlin Zhao. Digital Holography Based Near-field Imaging and Its Application[J]. Acta Optica Sinica, 2020, 40(1): 0111008.

![透射-TIR集成式DHM实验系统[73]](/richHtml/gxxb/2020/40/1/0111008/img_5.jpg)

![共路型SPRHM实验系统[75]](/richHtml/gxxb/2020/40/1/0111008/img_10.jpg)






