基于光声相关谱法的血液流速测量  下载: 951次
下载: 951次
1 引言
血液的主要功能之一是输送营养物质,其流动速度与机体的新陈代谢、心率以及不同器官类型密切相关。当人体出现疾病或组织循环障碍时,血液的正常流动或组织灌注就会发生变化,因此通过监测血液流速的变化可以探查组织器官的病变及受伤害等情况,这对血管痉挛、贫血等疾病的治疗和病理研究具有重要意义[1-2]。
目前,测量血液流速的方法主要有多普勒光学相干层析成像(DOCT)[3]、超声成像(US)[4]、激光散斑成像(LSI)[5]、扩散相关谱(DCS)[6]、正电子发射型计算机断层成像(PET)[7]、核磁共振(MRI)[8]、计算机断层扫描(CT)[9]等。DOCT通过多普勒效应来测量血液流速,主要方式有相位解析DOCT[10]、多普勒微血管造影[11]等,但只能测量出血液沿入射光束传播方向的运动速度,若要计算血液的绝对运动速度则需要预先知道多普勒角[12]。有研究者在DOCT中利用多光束探测多普勒频移,该方法虽然可以在多普勒角未知的情况下测量血液的绝对流速,但实验装置复杂,需要调整硬件,并进行光学对准[13-14]。US常用于无损伤的血流测量,但该方法易受杂波的影响,分辨率较低[15]。LSI利用样品的漫反射光随时间的变化来测量血液流速,可实时成像,但仅限于对样品的浅表层成像[16]。DCS拥有高的空间分辨率和较好的成像深度,但需要考虑光学探头对样品的压迫作用[17]。PET是研究脑血液动力学的标准技术之一,需要注入放射性示踪剂[18]。MRI设备昂贵。CT依赖于电离辐射,对人体有一定的伤害。
光声显微成像(PAM)是一种基于探测激光诱导超声波的成像方法,具有高光学对比度、高分辨率等优点[19]。近年来,利用光声效应对血液流速进行测量的研究受到了广泛关注,主要有多普勒法[20]、密度追踪法[21]、渡越时间法[22]、振幅编码法[23]等。光声相关谱法(PACS)是渡越时间法中的一种,它通过分析光声信号幅度的变化来测量血管中血液的流速[24]。由于激光重复频率和采集卡的数据采集速率有限,目前的PACS能够测量的最大血液流速为21 mm/s[25]。人体内不同血管中的血液流速不同,如毛细血管中血液的平均流速约为1 mm/s,而小动脉中血液的平均流速约为50 mm/s[26]。若利用PACS监测人体小动脉中血液流速的变化情况,则需要扩大PACS能够测量的血液流速范围。同时,目前的PACS方法没有考虑血液流动方向与入射激光传播方向的夹角对血液流速测量的影响,这会给血液流速的测量带来误差。
本文利用PACS测量了模拟血管样品中去纤维新生牛血的流速。通过提高激光的重复频率,增大了PACS能够测量的血液流速的范围,分析了重复频率对血液流速测量的影响;此外,还分析了利用PACS方法测量血液流速过程中,血液流动方向与入射激光传播方向之间的夹角对血液流速测量的影响。
2 原理
PACS类似于荧光相关谱(FCS)技术,当血红细胞穿越激光照射区域时,血红细胞吸收脉冲激光的能量,并产生光声信号。利用超声换能器采集光声信号,可以得到光声信号强度
式中:
式中:
聚焦的探测光束强度在垂直于传播方向上(
式中:
式中:
利用(5)式对
式中:
PACS测得的结果是垂直于入射激光传播方向的血液流速。
3 实验与分析
对血液流速进行测量的光声实验系统示意图如

图 2. 测量血液流速的光声实验系统示意图
Fig. 2. Schematic of the experimental system for measuring velocity of blood flow

图 3. 基于PACS方法的血液流速测量结果。(a)模拟血管中血液的图像;(b)归一化的P(t)信号;(c) P(t)自相关数据及拟合曲线
Fig. 3. Blood flow velocity measured by PACS method. (a) Photoacoustic image of blood flow phantom; (b) normalized P(t) signal; (c) calculated and fitted autocorrelation curves of P(t)

图 4. 在重复频率为2 kHz及不同血液流速下测得的P(t)的自相关数据及拟合曲线。(a) 1 mm/s;(b) 2 mm/s;(c) 3 mm/s;(d) 4 mm/s;(e) 5 mm/s;(f) 6 mm/s
Fig. 4. Calculated autocorrelation data and fitted curves at repetition frequency of 2 kHz and different velocities of blood flow. (a) 1 mm/s; (b) 2 mm/s; (c) 3 mm/s; (d) 4 mm/s; (e) 5 mm/s; (f) 6 mm/s

图 5. 在2 mm/s血液流速及不同激光重复频率下测得的P(t)的自相关数据及拟合曲线。(a) 0.5 kHz;(b) 1 kHz;(c) 2 kHz;(d) 3 kHz;(e) 4 kHz;(f) 5 kHz
Fig. 5. Calculated autocorrelation data and fitted autocorrelation curves at velocity of blood flow of 2 mm/s and different laser repetition frequencies. (a) 0.5 kHz; (b) 1 kHz; (c) 2 kHz; (d) 3 kHz; (e) 4 kHz; (f) 5 kHz
系统光源为意大利Bright Solutions公司生产的Wedge HF 532脉冲激光器,激光波长为532 nm,最大
3.1 激光重复频率对血液流速测量的影响
利用PACS对已知流速的血液样品进行测量。探测光束垂直向下入射,模拟血管样品放置在一个水槽中,血液流动方向与探测光束传播方向垂直。在激光重复频率为10 kHz、血液流速为2 mm/s的条件下,测量结果如
在设定重复频率为2 kHz不变的条件下,利用PACS方法分别对设定流速为1,2,3,4,5,6 mm/s的血液的流速进行测量。
在设定血液流速为2 mm/s不变的条件下,当激光重复频率分别为0.5,1,2,3,4,5 kHz时,利用PACS方法对血液流速进行测量。

图 6. (a)渡越时间随设定流速的变化及(b)测量流速与实际流速
Fig. 6. (a) Dependence of the flow time on the designed velocity and (b) the measured velocities versus the actual velocities
实验结果表明,在利用PACS方法测量血液流速时,需要采集足够多的有效数据来确保数据拟合的准确性。血液流速越快,所需要的激光重复频率越高。当需要测量小动脉中的血液流速时,激光重复频率应大于10 kHz。对于实验系统中的脉冲激光光源,当重复频率大于10 kHz时,单脉冲激光束的能量随重复频率的增大而减小,无法产生信噪比较高的光声信号。因此,当激光的重复频率大于10 kHz时,为了产生具有较高信噪比的光声信号,需要增大激光器的输出能量。当激光器工作在其最高重复频率100 kHz时,通过增大输出能量也能产生信噪比较高的光声信号。
3.2 血液流速计算
为了计算血液流速,需要获得不同已知流速的自相关数据,并由此校准探测区域激光光束的有效半径。
通过改变激光的重复频率可以评估系统利用PACS方法测量血液流速的有效范围。当激光重复频率为100 kHz时,系统所能测量的最短的血红细胞渡越时间为0.055 ms,根据方程
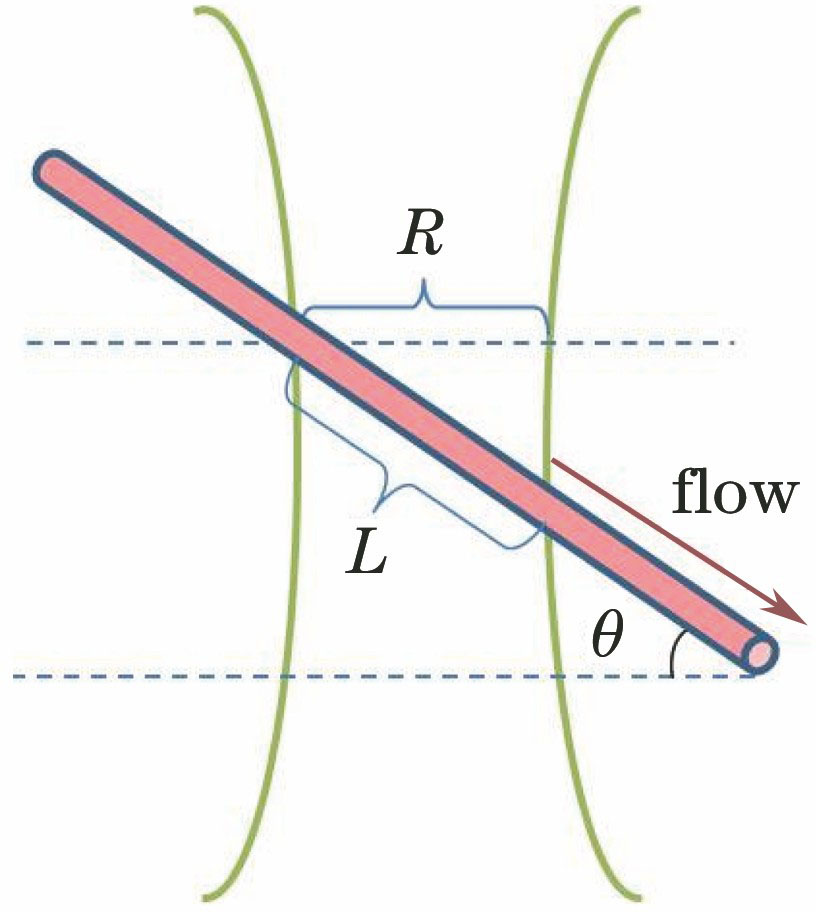
3.3 样品倾斜角度对血液流速测量的影响
为了提高血液流速测量的准确性,验证血流方向与入射激光传播方向的夹角对血液流速测量的影响。将血流方向与垂直于入射激光传播方向的夹角定义为样品倾斜角度,针对同一流速的血液样品,在-75°~75°的倾斜角度范围内,每隔15°测量一次血液流速,测量结果如

图 7. 不同倾斜角度下测量血液流速与实际血液流速的比值
Fig. 7. Ratio between the measured flow velocity and the actual flow velocity at different tilt angles
4 结论
研究了激光重复频率和样品倾斜角度对基于PACS方法测量血液流速结果的影响。结果表明:血液流速越快,所需要的激光重复频率越高。通过调节激光重复频率和激光输出能量,得到系统可以测量的血液流速范围为0.059~92.3 mm/s,测得的血液流速与实际血液流速的相关系数为0.992。测得的血液流速与实际血液流速的比值与样品倾斜角度呈余弦关系,说明PACS方法更适用于测量垂直于入射激光传播方向的血液流速。该研究有望应用于生物组织中绝对血流速度的测量。
[3] 姚辛励, 季琨皓, 刘桂鹏, 等. 基于散斑方差和多普勒算法的光学相干层析术血流成像[J]. 激光与光电子学进展, 2017, 54(3): 031702.
[5] 李晨曦, 陈文亮, 蒋景英, 等. 激光散斑衬比血流成像技术研究进展[J]. 中国激光, 2018, 45(2): 0207006.
[23] Sheinfeld A, Eyal A. Photoacoustic thermal diffusion flowmetry[J]. Biomedical Optics Express, 2012, 3(4): 800-813.
潘柳华, 张向阳, 李中梁, 南楠, 步扬, 陈艳, 王瑄, 王向朝. 基于光声相关谱法的血液流速测量[J]. 中国激光, 2018, 45(11): 1107001. Pan Liuhua, Zhang Xiangyang, Li Zhongliang, Nan Nan, Bu Yang, Chen Yan, Wang Xuan, Wang Xiangzhao. Measuring Velocity of Blood Flow Based on Photoacoustic Correlation Spectroscopy[J]. Chinese Journal of Lasers, 2018, 45(11): 1107001.