光学相干断层成像术评估细菌诱导性炎症  下载: 924次特邀研究论文
下载: 924次特邀研究论文
1 引言
炎症通常是由某类有害的刺激(如病原体、受损细胞或者外源刺激物)施加在生物组织体上而造成的免疫血管反应,一般涉及免疫细胞、血管和分子介质[1]。对炎症进行实时监测和评估可以更好地理解各种疾病的病因,如心脏病、癌症、慢性呼吸道疾病、中风、阿尔茨海默病、糖尿病、肺炎、肾脏疾病和流感,等等,这些疾病都已被证实其早期发病的病理机制与炎症有着千丝万缕的关系[2-11]。截至目前,许多非侵入性成像技术,如磁共振成像(MRI)、超声和电子计算机断层扫描(CT),常被用作临床上研究炎症生物学机制的工具[12]。在现有的成像模式中,光学相干断层扫描成像技术(OCT)是一种可以在分子和细胞水平上对疾病机制进行研究的临床化手段[13],具有超高的分辨率。OCT设备可以清晰地显示出组织和血管的细微的形态特征。光学相干断层血管造影术(OCTA)是近年来被引入临床的一种眼科成像技术,已成为研究微血管和微循环的重要工具。在原理上,OCTA是通过检测血管内动态散射信号来对血管进行成像的,而这些信号主要来源于红细胞的运动。因而,红细胞的数量和运动速度决定了OCT的信号强度。迄今为止,OCT已经被成功运用于皮肤性疾病、眼科疾病和病理学等方面的研究,如老年性黄斑、视网膜病变、浅表的肿瘤和组织切片等[14-20]。
本研究小组采用感染性细菌诱导小鼠的耳朵形成小鼠炎症模型[21],然后利用高分辨率和高灵敏度的OCT对小鼠耳朵炎症进行实时检测和监测。结果发现:OCT能够提供细菌诱导性炎症过程中小鼠耳朵免疫血管反应诱发的微血管网络密度差异、血管形态变化和微循环异常;细菌诱导的血管发炎使得血管中的红细胞增多,从而增强了OCT信号。鉴于OCT在临床应用上的广泛性,本文也获取了健康被试者手掌处的高密集血管网络图像,证明了OCTA用于临床上评估炎症和其他疾病的可能性。该方法有助于进一步认识炎症及其他疾病的病理机制,为临床评估炎症开辟了新途径。
2 方法和材料
2.1 大肠杆菌的制备及动物模型的建立
将大肠杆菌置于37 ℃的经过灭菌处理的Luria-Bertani (LB)液体培养基(3 mL)中培养,同时将培养大肠杆菌的液体LB培养基放入转式恒温振荡培养箱中培养10~12 h,设置转速为200 r/min,温度为37 ℃。此外,用磷酸盐缓冲盐水(PBS)清洗一遍细菌,使其悬浮于装有PBS的培养基中,然后重复用PBS进行三次细菌洗涤,将其完全悬浮在不同浓度的PBS中,用于后期建立动物模型。
使用6~8周大的裸鼠进行实验,并且实验完全按照澳门大学动物伦理委员会制定的动物研究规则指引进行。用麻醉机麻醉小鼠后,用30号针头配备1 L注射器将50 mL浓度为108 CFU/mL(CFU:Colony-Forming Units)细菌注射到小鼠耳朵内,诱导感染炎症反应。在注射后6 h到一周的时间内,采用OCT系统对小鼠耳朵进行检测和监测。
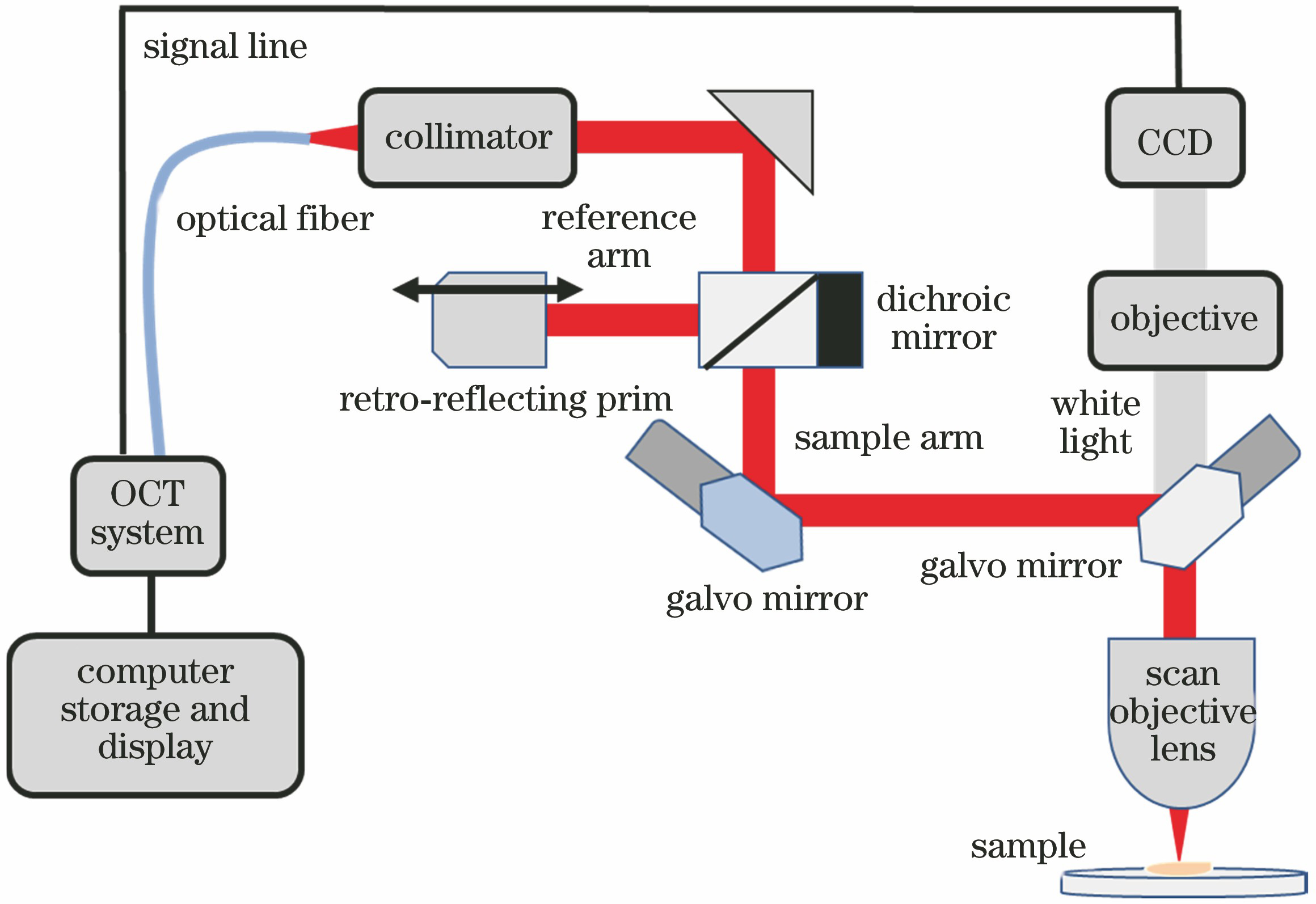
2.2 OCT成像技术
3 结果与讨论

图 2. 小鼠耳朵被细菌感染后的OCT成像结果。(a) 1号小鼠耳朵血管监测结果,红色方框为扫描区域(4 mm×4 mm),白色圆圈为细菌感染区域;(b) 2号小鼠耳朵监测结果;(c)小鼠耳朵扫描区域OCT信号强度随感染时间的变化,**表示P<0.01, ***表示P<0.001;(d) 归一化血管网络密度随感染时间的变化;(e)小鼠耳朵健康区域和感染区域的OCT信号随深度变化的衰减曲线
Fig. 2. OCT imaging of two mice with the ear infected by bacteria. (a) Imaging of ear of mouse 1, the red box stands for the scanning area (4 mm×4 mm), while the white circle is the infected area; (b) imaging results of mouse 2; (c) variation of OCT intensity in scanning area with infection time, **represents P<0.01, and ***represents P<0.001; (d) variation of normalized angiogram vessel density (AVD) with infection time; (e) OCT signal attenuation curves with depth in normal and inflamed

图 3. 健康被试者手掌处的OCT高密集血管网络系统,红色方框为扫描区域(4 mm×4 mm)
Fig. 3. OCT microvascular networks of palm from healthy subject, and the red box stands for scanning areas (4 mm×4 mm)
4 结论
本文采用高分辨率和高灵敏度的OCT成像系统对接种了大肠杆菌的小鼠耳朵进行成像,被感染的小鼠耳朵是研究炎症发病机制的强有力的动物模型。基于OCT成像可以明确地确定三维的精密组织结构,同时也可以重构出高密集性血管网络图。通过OCT信号强度和血管网络密集度以及对比感染区域和非感染区域的OCT信号衰减曲线,可以初步区分正常组织和感染组织之间的边界。此外,本文初步论证了细菌本身或者细菌感染后的炎症反应,会使血管内的红细胞增多,从而对周围血管起到OCT造影的效果。可见,使用OCT成像可以提高检测和监测炎症的敏感性,为临床评估炎症提供了可行性。
[1] Ferrero-Miliani L, Nielsen O H, Andersen P S, et al. Chronic inflammation: importance of NOD2 and NALP3 in interleukin-1β generation[J]. Clinical and Experimental Immunology, 2006, 147(2): 227-235.
[2] Mantovani A. Inflammation by remote control[J]. Nature, 2005, 435(7043): 752-753.
[3] Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3[J]. Nature Reviews Cancer, 2009, 9(11): 798-809.
[4] Seemungal T, Harper-Owen R, Bhowmik A, et al. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease[J]. American Journal of Respiratory and Critical Care Medicine, 2001, 164(9): 1618-1623.
[5] Sevenoaks M J, Stockley R A. Chronic obstructive pulmonary disease, inflammation and co-morbidity——a common inflammatory phenotype?[J]. Respiratory Research, 2006, 7(1): 70.
[6] Huang J, Upadhyay U M, Tamargo R J. Inflammation in stroke and focal cerebral ischemia[J]. Surgical Neurology, 2006, 66(3): 232-245.
[7] Emsley H C A, Tyrrell P J. Inflammation and infection in clinical stroke[J]. Journal of Cerebral Blood Flow & Metabolism, 2002, 22(12): 1399-1419.
[8] Akiyama H. Inflammation and Alzheimer's disease[J]. Neurobiology of Aging, 2000, 21(3): 383-421.
[9] Navarro J F, Mora C. Diabetes, inflammation, proinflammatory cytokines, and diabetic nephropathy[J]. The Scientific World Journal, 2006, 6: 908-917.
[10] Peper R L, van Campen H. Tumor necrosis factor as a mediator of inflammation in influenza A viral pneumonia[J]. Microbial Pathogenesis, 1995, 19(3): 175-183.
[11] Rainsford K D. Influenza (“Bird Flu”), inflammation and anti-inflammatory/analgesic drugs[J]. Inflammopharmacology, 2006, 14(1/2): 2-9.
[12] Hammoud D A. Molecular imaging of inflammation:current status[J]. Journal of Nuclear Medicine, 2016, 57(8): 1161-1165.
[13] Oldenburg AL, Applegate BE, Izatt JA, et al. Molecular OCT contrast enhancement and imaging[M] ∥Optical Coherence Tomography. Berlin, Heidelberg: Springer Berlin Heidelberg, 2008: 713- 756.
[14] Fleckenstein M, Issa P C, Helb H M, et al. High-resolution spectral domain-OCT imaging in geographic atrophy associated with age-related macular degeneration[J]. Investigative Opthalmology & Visual Science, 2008, 49(9): 4137-4144.
[15] Jaffe G J, Caprioli J. Optical coherence tomography to detect and manage retinal disease and glaucoma[J]. American Journal of Ophthalmology, 2004, 137(1): 156-169.
[16] Yeoh J, Rahman W, Chen F, et al. Choroidal imaging in inherited retinal disease using the technique of enhanced depth imaging optical coherence tomography[J]. Graefe's Archive for Clinical and Experimental Ophthalmology, 2010, 248(12): 1719-1728.
[17] Nguyen F T, Zysk A M, Chaney E J, et al. Intraoperative evaluation of breast tumor margins with optical coherence tomography[J]. Cancer Research, 2009, 69(22): 8790-8796.
[18] Bechara F G, Gambichler T, Stucker M, et al. Histomorphologic correlation with routine histology and optical coherence tomography[J]. Skin Research and Technology, 2004, 10(3): 169-173.
[19] Deegan A J, Talebi-Liasi F, Song S Z, et al. Optical coherence tomography angiography of normal skin and inflammatory dermatologic conditions[J]. Lasers in Surgery and Medicine, 2018, 50(3): 183-193.
[20] Deegan A J, Wang W, Men S J, et al. Optical coherence tomography angiography monitors human cutaneous wound healing over time[J]. Quantitative Imaging in Medicine and Surgery, 2018, 8(2): 135-150.
[21] Liu Y B, Fu L, Xu M Z, et al. Dual-modal in vivo fluorescence/photoacoustic microscopy imaging of inflammation induced by GFP-expressing bacteria[J]. Sensors, 2019, 19(2): 238.
[22] 于飞, 张浪, 梁青, 等. 佐剂性关节炎大鼠的血常规[J]. 中国比较医学杂志, 2014, 24(1): 5-7.
Yu F, Zhang L, Liang Q, et al. Blood routine of adjuvant arthritis rats[J]. Chinese Journal of Comparative Medicine, 2014, 24(1): 5-7.
Article Outline
刘玉滨, 陈智毅, 袁振. 光学相干断层成像术评估细菌诱导性炎症[J]. 中国激光, 2020, 47(2): 0207034. Liu Yubin, Chen Zhiyi, Yuan Zhen. Assessment of Bacterial Inflammation Based on Optical Coherence Tomography Angiography[J]. Chinese Journal of Lasers, 2020, 47(2): 0207034.