具不同碱基数单链核酸的光致发光特性  下载: 1109次
下载: 1109次
1 引言
核酸是构成生命的基本物质之一,早在1953年Watson和Crick就提出了核酸的双螺旋结构[1],之后Langridge等[2]也通过理论模型证明了这种结构的正确性。至今已经发现核酸有
目前对核酸的研究分析方法主要有电学和光学两类。与毛细管电泳法[9-10]、阳极溶出伏安法[9,11]等电学方法相比,光学方法能提供高效的非接触测量,且能反映更丰富的物质组分和分子结构等信息,故在核酸探测中被广泛采用。常见的光学方法包括紫外分光光度法[9,12-14]、共振光散射法[12]、荧光共振能量转移技术[5]以及固体基质室温磷光法[9,15-16]等。为了提高探测灵敏度,增大测量范围,这些方法往往需要加入特定的荧光剂、试剂或探针,从而带来了样品污染、环境毒性和成本增高等问题。
众所周知,标准光荧光技术广泛应用于物理和材料的分析中,具有灵敏度高、选择性好、成本低和操作简便等优点[17-19]。为了探索上述问题的解决途径以及研究短链和长链核酸单链样品光致发光特性的差别,本文使用标准光荧光方法,在不加入探针或荧光、磷光染料的情况下,测量了56个和29个碱基的两种核酸单链样品的光致发光特性。该方法可以通过改变抽运光的波长、强度来测量核酸样品的发光特性,不会对样品造成破坏或污染。由于核酸上的碱基功能团(具共轭双键结构)与核酸结构(由五碳糖、碱基、磷酸形成的核苷酸构成)耦合,形成了独特的电子能级结构,在抽运光场作用下会产生光致发光,其发光谱的峰位和宽度与系统的电子能级结构、本征载流子和光生载流子浓度密切相关。实验结果显示,当激发波长在310~410 nm区间时,能够在410~480 nm波长区间观测到明显的光致发光峰。两种样品的发光峰位置随抽运波长的红移而红移,并且发光峰的强度随激发波长的增加而先增强后减弱。更重要的是,实验发现具有两种不同碱基数和序列的核酸样品显示不同的光致发光谱宽特性,原理上可以用于甄别两种不同的核酸材料。这些结果将在单链核酸样品的无损、无标记快速检测和鉴别中具有潜在应用。
2 实验方法
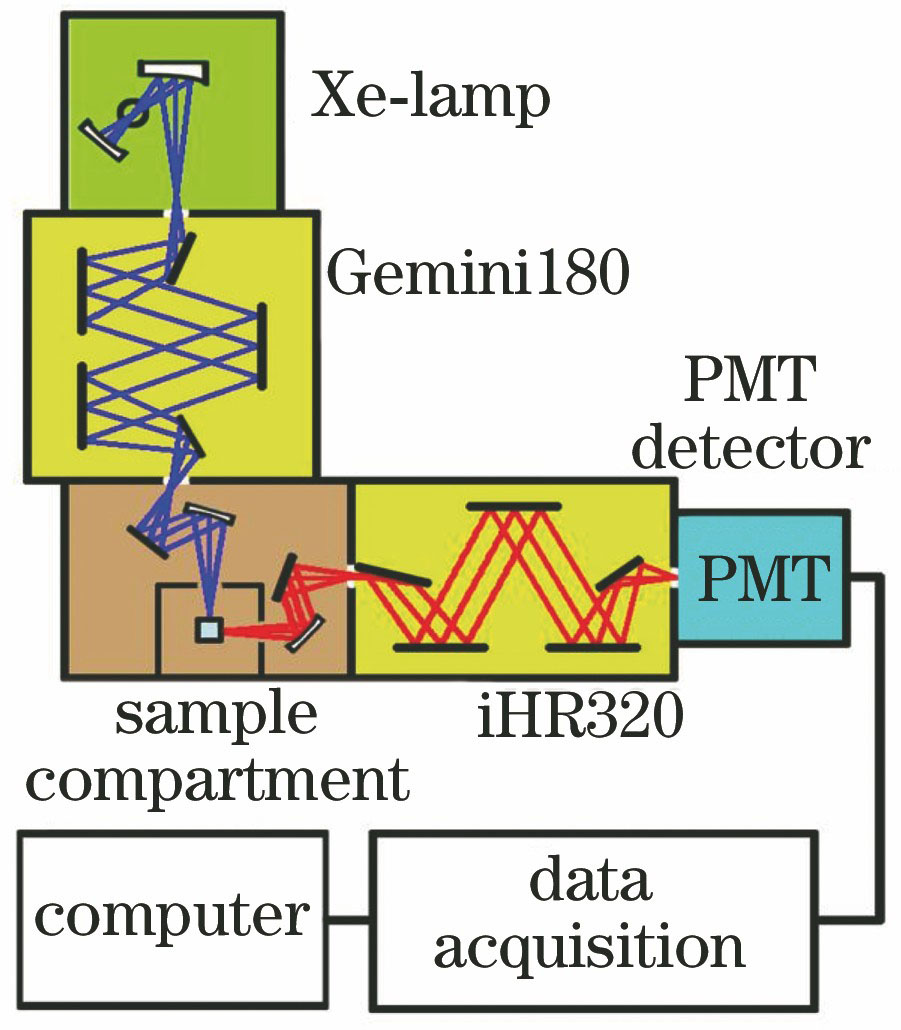
在常规的核酸单链研究及应用中,通常合成小于60个碱基的核酸,这是因为过长的核酸链会使核酸变得不稳定,容易因为理化环境的波动而发生变质。基于此,实验中分别制备了含有56个和29个碱基的核酸单链,用于研究长链和短链核酸样品光致发光特性的差别。由于本实验的主要目的是证明在不加入探针或荧光、磷光染料的情况下,光致发光谱中的某些特性可用于鉴别不同的核酸单链,因此,为了增大样品的任意性并避免人为选择因素的干扰,实验采用了具有不同碱基序列和长度的核酸单链。将核酸单链用双蒸水配制成浓度相同的溶液,并装入石英比色皿,具体参数如
表 1. 核酸样品的属性
Table 1. Properties of nucleic acid samples
|
Note: PAGE represents polyacrylamide gel electrophoresis. 为了保证实验结果的可靠性,对样品组(61191和61192)和对照组(空比色皿,比色皿中加入双蒸水(ddwater))都使用了三次测量后取平均值的方法进行数据处理。当抽运光(或称激发光)波长

图 2. 两种核酸样品溶液和双蒸水的发光光谱
Fig. 2. Fluorescence spectra of two nucleic acid sample solutions and double distilled water
3 实验结果及讨论
当抽运光(或称激发光)波长

图 3. 两种核酸样品的发光光谱。(a) 61191样品;(b) 61192样品
Fig. 3. Fluorescence spectra of two nucleic acid. (a) Sample 61191; (b) sample 61192
基于

图 4. (a)核酸样品荧光峰峰位与激发波长的关系;(b)核酸样品荧光峰强度与激发波长的关系
Fig. 4. (a) Relationship between fluorescence peak position and the excitation wavelength; (b) relationship between fluorescence peak intensity and the excitation wavelength

图 6. 两种核酸样品最强荧光峰峰位的激发谱
Fig. 6. Excitation spectra of highest intensity fluorescence peak of two nucleic acid samples
实验中测得激发光波长
4 结论
采用标准光荧光方法分别测量了具有56个和29个碱基的两种核酸单链样品的光致发光特性,测量中未加入探针或荧光、磷光染料,不会对样品造成污染和破坏。结果显示,当抽运光波长在310~410 nm区间变化时,能够在410~480 nm波长区间观测到显著的光致发光峰。两种样品的
本研究初步证明了在不加入探针或荧光、磷光染料的情况下,通过测量样品的光致发光特性可以间接得到单链核酸的能带结构和不同能态电子浓度的信息,从而鉴别出单链核酸的种类。若能通过实验测量建立一整套不同单链核酸样品的
[3] 张今, 张红樱, 李青山, 等. 核酸结构与动力学导论[M]. 北京: 科学出版社, 1995.
[4] 林祥潮, 张秀春. 核酸人工合成的研究进展[J]. 福州师专学报(自然科学版), 1999, 19(3): 49-50.
Lin X C, Zhang X C. The newest study about the artificial synthesis of RNA and DNA[J]. Journal of Fuzhou Teachers College (Natural Science Edition), 1999, 19(3): 49-50.
[8] FangR. Label-free detection of deoxyribonucleic acid (DNA) hybridisation on 2D materials: Graphene and MoS2[D]. Taiwan: Chiao Tung University, 2014.
[9] 张敏, 赵虎, 吕庆銮, 等. 核酸水解产物中腺嘌呤的荧光猝灭法测定及机理研究[J]. 分析测试学报, 2008, 27(3): 263-265.
Zhang M, Zhao H, Lü Q L, et al. Studies on the determination of adenine in DNA hydrolyzate based on the fluorescence quenching of evans blue and its mechanism[J]. Journal of Instrumental Analysis, 2008, 27(3): 263-265.
[10] 徐祥云, 彭君, 何志坤. 浅谈毛细管电泳的基本原理及相关技术[J]. 宁夏农林科技, 2012, 53(11): 91-92, 95.
Xu X Y, Peng J, He Z K. Basic principle of capillary electrophoresis and related technology[J]. Ningxia Journal of Agriculture and Forestry Science and Technology, 2012, 53(11): 91-92, 95.
[11] 印得澈, 任伯帜, 侯保林. 阳极溶出伏安法在线测定有色金属矿区雨水径流中铅和镉[J]. 湖南工程学院学报(自然科学版), 2012, 22(2): 69-72.
Yin D C, Ren B Z, Hou B L. Online determination of lead and cadmium in nonferrous metal mining area rain runoff by anodic stripping voltammetry[J]. Journal of Hunan Institute of Engineering (Natural Science Edition), 2012, 22(2): 69-72.
[12] 冯硕, 李正平, 张淑红, 等. 红共振光散射技术测定核酸的研究进展[J]. 光谱学与光谱分析, 2004, 24(12): 1676-1680.
Feng S, Li Z P, Zhang S H, et al. Recent advance of resonance light scattering technique for the determination of nucleic acids[J]. Spectroscopy and Spectral Analysis, 2004, 24(12): 1676-1680.
[13] 戢太云, 徐鲁荣, 周培. 核酸荧光探针检测铅离子的研究[J]. 分析测试学报, 2010, 29(1): 51-54.
Ji T Y, Xu L R, Zhou P. Study on nucleic acid fluorescent probe detection of lead ion[J]. Journal of Instrumental Analysis, 2010, 29(1): 51-54.
[14] 高颜, 李军生, 李蔚仑, 等. 茜草色素蒽棕与DNA的相互作用机理研究[J]. 光学学报, 2015, 35(2): 0230003.
[15] 冯小花, 麦洋, 董川, 等. 纸基质室温磷光法测定痕量腺嘌呤[J]. 福州大学学报(自然科学版), 1999, 27(s1): 131-133.
Feng X H, Mai Y, Dong C, et al. Determination of trace adenine by paper-substrate room temperature phosphorescence[J]. Journal of Fuzhou University (Natural Science Edition), 1999, 27(s1): 131-133.
[16] 徐文婷. 固体基质室温磷光法新基质的研究与应用[D]. 北京: 首都师范大学, 2008.
[17] 刘雪平, 常伟华. 荧光光谱在核酸分析中的应用[J]. 河南化工, 2005, 22(3): 41-42.
Liu X P, Chang W H. Application of fluoresence spectra on analysis of nucleic acid[J]. Henan Chemical Industry, 2005, 22(3): 41-42.
[18] 王书涛, 陈东营, 王兴龙, 等. 荧光分析法和ABC-BP神经网络相结合的多环芳香烃的检测[J]. 中国激光, 2015, 42(11): 1115001.
[19] 王书涛, 陈东营, 魏蒙, 等. 荧光光谱法和PSO-BP神经网络在山梨酸钾浓度检测中的应用[J]. 中国激光, 2015, 42(5): 0515004.
[20] 彭采尔, 高洛维娜, 罗诺夫, 等. 分子发光分析法(荧光法和磷光法)[M]. 祝大昌, 陈剑鋐, 朱世盛, 译. 上海: 复旦大学出版社, 1985: 1- 20.
梁昌能, 张杰, 徐文, 丁岚, 钱伟, 李旋. 具不同碱基数单链核酸的光致发光特性[J]. 激光与光电子学进展, 2018, 55(3): 033004. Changneng Liang, Jie Zhang, Wen Xu, Lan Ding, Wei Qian, Xuan Li. Photoluminescence Properties of Single-Stranded Nucleic Acids with Different Base Sequences[J]. Laser & Optoelectronics Progress, 2018, 55(3): 033004.