黄渤海浮游植物种群比吸收光谱的确定及其应用  下载: 1250次
下载: 1250次
1 引言
浮游植物吸收系数(aph(λ),λ为波长)是水体固有光学特性之一,同时也是引起近岸水体光学性质变化的重要因素[1],可通过现场原位测量和高光谱海洋水色遥感反演获得[2-3]。浮游植物吸收光谱是海洋高光谱水色遥感的重要生物光学参数之一,可以通过比吸收系数(
一般来说,aph(λ)是细胞中所含色素的吸收系数总和,因此与浮游植物种群特征相关的色素组成和浓度对其的影响较大[8-9]。一个特定的浮游植物种群,其色素组成稳定,色素浓度随生理状态的不同而发生改变[10-11]。虽然所有浮游植物种群都显示出高度一致的吸收光谱趋势,不同种群的浮游植物吸收光谱仍具有显著的特征差异,如在400~500 nm波段范围内,甲藻、定鞭藻在435 nm和465 nm处存在双吸收峰特征,硅藻在蓝光波段的吸收峰位于435 nm附近。因此,这种浮游植物吸收特征的差异性可以作为区分浮游植物种群的依据[12]。利用不同浮游植物种群色素的合成数据集,开发了化学分析软件CHEMTAX[13]。该软件通过构建色素比例矩阵,实现不同藻种浓度的分离,进而描述浮游植物种群结构。
近年来,很多学者对世界各海域水体的浮游植物吸收分解模型和比吸收求解方法进行了大量研究,取得了许多重要成果。Moisan等[14]使用非负最小二乘法(NNLS)、奇异值分解(SVD)和非线性最小二乘法(MRQMIN),结合色素浓度数据,计算得到18种色素的比吸收光谱,从而实现高光谱遥感反演色素浓度。Wo
针对黄渤海水体,本文利用浮游植物吸收系数和藻类浓度数据,建立了基于种群结构的浮游植物吸收分解模型,得到了优势藻种的比吸收系数。同时分析了不同浮游植物种群对总吸收的吸收贡献,探讨了种群吸收贡献率的空间分布特征。
2 研究区域与数据处理
2.1 研究区域
研究区域位于黄海和渤海,现场实测数据采集于2016年国家自然科学基金委员会夏季黄渤海共享航次,包括浮游植物吸收系数数据和色素数据共计66个。渤海是我国半封闭的内海,三面环陆,水深较浅。黄河、滦河、大清河等多条河流常年流入渤海,故盐度较低,径流携带大量营养盐,促进了浮游植物的生长。黄海为太平洋西部的半封闭浅海,海底平缓,含有大量泥沙。淮河、鸭绿江、汉江等携带大量的营养物质、泥沙、淡水注入黄海,为黄海的浮游生物提供良好的生存条件[19]。
2.2 浮游植物吸收
浮游植物吸收系数测量主要是采用定量滤膜技术(QFT)。将一定体积(0.8~4.0 L)的海水样本过滤到直径为25 mm,孔径为0.7 μm的 玻纤滤膜(Whatman公司,GF/F,英国)上,随即放入-80 ℃液氮罐中保存。实验室测量浮游植物吸收系数主要是通过散射-透射法,先测量得到总颗粒物吸收系数ap(λ),然后将滤膜放置在质量分数约为90%的甲醇溶液中浸泡24~48 h,萃取样品膜上的有机物,再通过散射-透射法测得非色素颗粒物吸收系数ad(λ)[20]。浮游植物吸收光谱aph(λ)可表示为ap(λ)与ad(λ)的差值[21]。
2.3 浮游植物种群浓度
浮游植物色素样品采集是使用直径为40 mm,孔径为0.7 μm的GF/F玻璃纤维滤膜过滤一定体积(1~4 L)水样,并立即将滤膜保存于液氮容器中,并通过高效液相色谱法(HPLC)测得色素浓度[22]。用于CHEMTAX分析的色素以及对应的藻类信息如
表 1. 用于CHEMTAX分析的色素以及对应的藻类信息
Table 1. Pigments for CHEMTAX analysis and corresponding algae informations
|
通过CHEMTAX矩阵因子程序将色素浓度转化为种群浓度[23]。用于CHEMTAX分析的初始特征色素矩阵如
表 2. 用于CHEMTAX分析的初始特征色素矩阵
Table 2. Initial characteristic pigment matrix for CHEMTAX analysis
|
表 3. 用于CHEMTAX分析的最终特征色素矩阵
Table 3. Final characteristic pigment matrix for CHEMTAX analysis
|
2.4 吸收分解模型
根据浮游植物吸收光谱的可加性,浮游植物总吸收系数aph(λ)可表示为各个浮游植物种群的吸收之和[11, 30]:
式中:
在回归分析中,如果因变量受两个或两个以上的自变量影响,就称为多元回归,本文中浮游植物吸收系数为因变量,各藻类浓度为自变量,并且自变量与因变量之间为线性关系,则多元线性回归模型为
式中:aph,j=n(λ)为第j个样本的吸收系数(m-1);Ci,j是第i种藻类第j个样本的浓度(质量浓度,全文同,mg·m-3);
在特定波长处,多元线性回归模型的回归参数为
理论上,m(m=8)个未知数至少需要m个方程即m个样本的实测数据来计算求取。本文采用留一法,依次取出一个样本,剩余样本使用最小二乘法来计算得到八类藻的
2.5 精度评价指标
利用数学软件MATLAB以及统计分析软件SPSS对数据进行统计分析与建模,求解最优吸收分解模型参数。并采用留一法(LOO-CV)评估新建模型的稳定性。选择决定系数(R2)、平均绝对百分误差(MAPE)和方均根误差(RMSE)作为评价指标。
式中:ERMSE为方均根误差;EMAPE为平均绝对百分误差(%);xk和
3 结果
3.1 浮游植物种群浓度的统计分布特征
通过CHEMTAX软件求解得到8种浮游植物种群浓度。
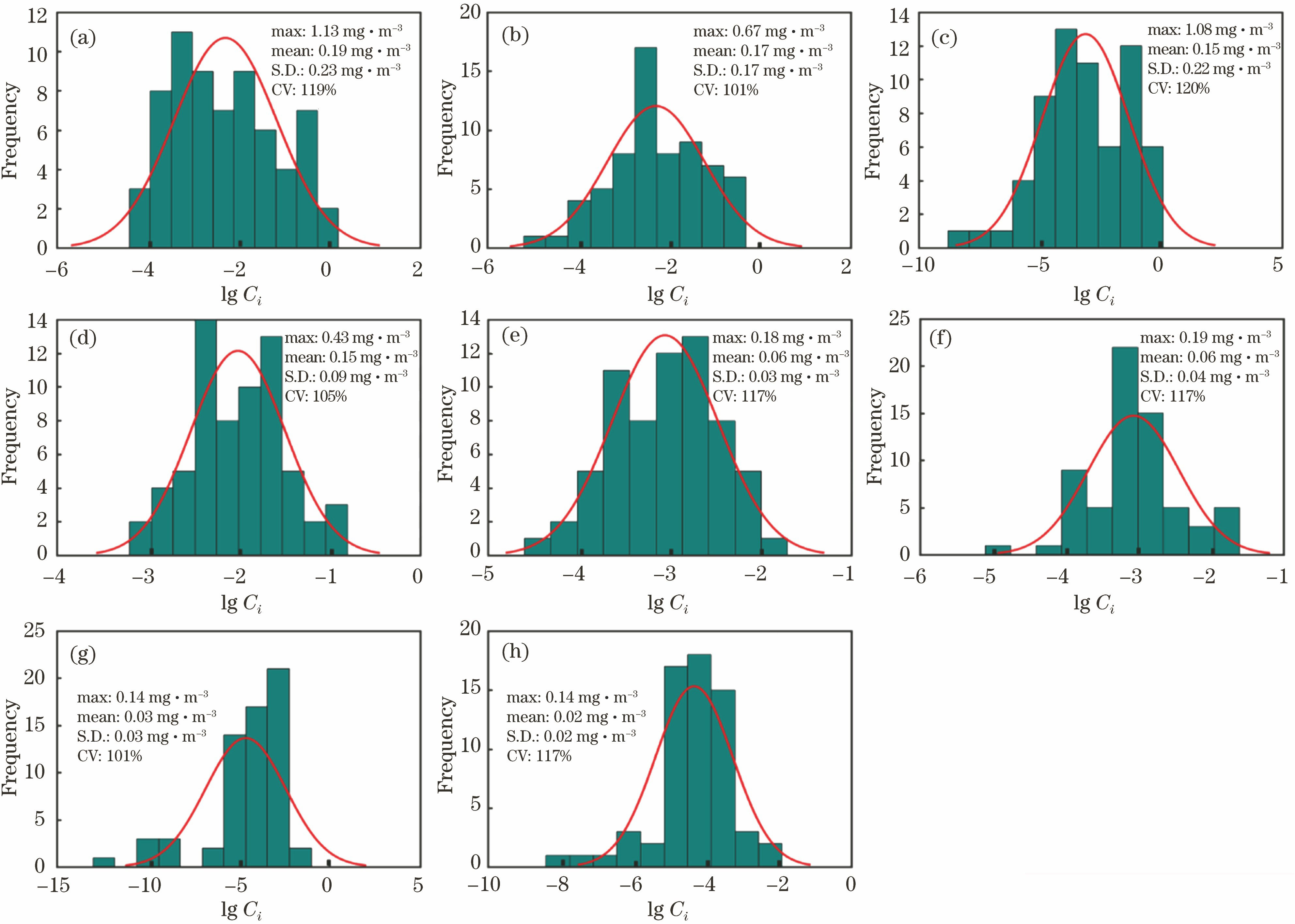
图 1. 8种藻类的浓度频数分布图(曲线为正态分布曲线)。(a)硅藻;(b)青绿藻;(c)隐藻;(d)定鞭藻;(e)绿藻;(f)金藻;(g)甲藻;(h)蓝藻
Fig. 1. Frequency-concentration of eight alga species (curve is normal distribution). (a) Diatoms; (b) Prasinophytes; (c) Cryptophytes; (d) Prymnesiophytes; (e) Chlorophytes; (f) Chrysophytes; (g) Dinoflagellates; (h) Cyanobacteria
3.2 浮游植物种群比吸收系数
3.2.1 种群比吸收系数的计算
基于aph(λ)与Ci数据,通过吸收分解模型,由留一法反演获得8藻的66条比吸收光谱

图 2. 留一法中8个优势藻类的比吸收光谱及其平均值
Fig. 2. Specific absorption spectra and mean values of 8 dominant alga species in LOO-CV
3.2.2 种群比吸收系数验证
基于留一法每次反演得到的比吸收光谱

图 3. 吸收系数反演误差分布图(虚线为误差曲线,实线为平均值)。(a) R2;(b) MAPE;(c) RMSE
Fig. 3. Error distribution of retrieved absorption coefficient (dotted line is error curve, and solid line is average curve). (a) R2; (b) MAPE; (c) RMSE
3.2.3 浮游植物吸收系数不同波段检验分析
为了进一步对比分析吸收系数反演结果的精确性,选取6个波段(412,443,490,555,660,680 nm)的aph(λ)反演结果与实测值的散点图,如

图 4. 不同波段处反演结果与实测值的散点图(实线为1∶1线)。(a) 412 nm; (b) 443 nm; (c) 490 nm; (d) 555 nm; (e) 660 nm; (f) 680 nm
Fig. 4. Scatter diagrams of retrieved results and measured values at different wavebands (solid line is 1∶1 line). (a) 412 nm; (b) 443 nm; (c) 490 nm; (d) 555 nm; (e) 660 nm; (f) 680 nm
3.3 各藻类吸收对总吸收贡献的空间分布规律
浮游植物各种群比吸收系数是描述浮游植物种群吸收特性,研究水下光场环境变化的重要参数。通过不同藻类的比吸收系数与浓度数据,探究黄渤海水体中不同藻类吸收系数(ai)对总浮游植物吸收(aph)的贡献(以下简称ATA),即ai/aph。青绿藻、甲藻、隐藻、绿藻、蓝藻、硅藻金藻和定鞭藻在2016年夏季黄渤海443 nm处的吸收贡献空间分布不同。隐藻ATA高值区域分布于渤海近岸地区以及山东半岛附近,且离岸越远越小;定鞭藻整个区域ATA在30%~70%范围内,极大值点出现在渤海东部和黄海南部(ai/aph>50%),近岸ATA小于离岸海域;硅藻在黄海近岸区域有较大的ATA值;而绿藻在渤海中部出现ATA高值区(ai/aph>60%);金藻高吸收比例主要集中在黄海;蓝藻的高ATA值分布在整个渤海以及黄海近岸区域,离岸地区ATA较低。此外,青绿藻和甲藻在整个研究区域具有相似的分布,ATA值最小(ai/aph<30%)。总的来说,定鞭藻对浮游植物吸收贡献最大,蓝藻次之。
4 讨论
结合浮游植物种群浓度与吸收光谱的线性分解模型依赖于各藻种比吸收光谱。在已知比吸收系数的前提下,依据(1)式,可以估算浮游植物种群吸收。该模型需要测得各个种群的比吸收光谱,然而实验室中培养藻类的比吸收光谱是在受控条件下测得的,与海洋中种群比吸收的测量值相差较大。此外,浮游植物种群的比吸收光谱可能会随环境条件(如光和养分)的改变而变化[33,36]。因此,实验室中测得的活体藻类的比吸收光谱只能作为观察本文中获得的种群比吸收特征的辅助手段,无法直接验证比吸收光谱。本文选取周虹丽等[18]、王瑜[17]测得的小球藻(Chlorella,绿藻门)、裸甲藻(Gymnodinium aerucyinosum Stein,甲藻门)、铜绿微囊藻(Microcystis aeruginosa,蓝藻门)、梅尼小环藻(Cyclotella meneghiniana,硅藻门)、卵形隐藻(Cryptomons ovata,隐藻门)的比吸收光谱进行对比分析,在440 nm处的归一化比吸收光谱曲线如

图 5. 不同浮游植物种群440 nm处归一化的比吸收光谱曲线对比图
Fig. 5. Comparison of normalized specific absorption coefficient of different phytoplankton species at 440 nm waveband
本文中的比吸收光谱是一个种群下的总的比吸收光谱,与实验室具体藻种比吸收光谱存在一定差异。为了比较不同类别下的比吸收光谱形状特征,将所有比吸收系数都除以440 nm处的比吸收系数,再进行对比,如
5 结论
通过吸收分解模型,计算得到2016年夏季黄渤海八种浮游植物种群的比吸收系数。该方法的关键步骤是确定各个浮游植物种群的比吸收光谱。使用CHEMTAX软件,结合色素浓度数据,计算得到各优势种群浓度。利用吸收分解模型,求解得到各个种群的比吸收光谱最优解,并通过重建浮游植物吸收光谱对比吸收系数进行检验。该方法的模型评估显示出良好的性能,蓝、红光波段的吸收系数反演精度较高,R2大于0.85,MAPE小于30%,蓝光波段RMSE小于0.0105 m2·mg-1,红光波段RMSE小于0.005 m2·mg-1。将各优势种群比吸收系数用于分析吸收系数贡献比例,发现定鞭金藻在443 nm波段处对浮游植物总吸收的贡献最大。同时发现各优势种群的吸收系数贡献比例在空间分布上呈现出不同的分布特征。在已知研究区域的aph(λ)情况下,通过浮游植物种群比吸收系数监控各优势种群浓度变化还需要进一步验证与探索。
[1] Roy S, Sathyendranath S, Bouman H, et al. The global distribution of phytoplankton size spectrum and size classes from their light-absorption spectra derived from satellite data[J]. Remote Sensing of Environment, 2013, 139: 185-197.
[2] Sosik H M, Mitchell B. Light absorption by phytoplankton, photosynthetic pigments and detritus in the California Current System[J]. Deep Sea Research Part I: Oceanographic Research Papers, 1995, 42(10): 1717-1748.
[3] 环宇. 近海水体浮游植物粒径等级的遥感反演及时空变异研究[D]. 南京: 南京信息工程大学, 2018.
HuanY. Remote sensing algorithm and spatiotemporal distribution of phytoplankton size classes in coastal waters[D]. Nanjing: Nanjing University of Information Science and Technology, 2018.
[4] 孙德勇, 李云梅, 王桥, 等. 太湖水体中悬浮颗粒物的比吸收光谱特性及其参数化分析[J]. 环境科学学报, 2009, 29(9): 1820-1829.
Sun D Y, Li Y M, Wang Q, et al. Specific absorption characteristics of suspended particles in Lake Taihu and parameter analysis[J]. Acta Scientiae Circumstantiae, 2009, 29(9): 1820-1829.
[5] Berthon J F, Morel A. Validation of a spectral light-photosynthesis model and use of the model in conjunction with remotely sensed pigment observations[J]. Limnology and Oceanography, 1992, 37(4): 781-796.
[6] 叶虎平. 二类水体吸收系数精确校正及其遥感反演研究[D]. 北京: 中国科学院大学, 2017.
Ye HP. A study on the accurate correction of case Ⅱ water absorption coefficient and its remote sensing inversion[D]. Beijing: University of Chinese Academy of Sciences, 2017.
[7] Timmermann A. 29(23): 19-1-19-4[J]. Jin F F. Phytoplankton influences on tropical climate. Geophysical Research Letters, 2002.
[8] Hoepffner N, Sathyendranath S. Determination of the major groups of phytoplankton pigments from the absorption spectra of total particulate matter[J]. Journal of Geophysical Research Atmospheres, 1993, 98(C12): 22789.
[9] Bricaud A. Natural variability of phytoplanktonic absorption in oceanic waters: Influence of the size structure of algal populations[J]. Journal of Geophysical Research Atmospheres, 2004, 109(C11): C11010.
[10] Xi H Y, Hieronymi M, Röttgers R, et al. Hyperspectral differentiation of phytoplankton taxonomic groups: a comparison between using remote sensing reflectance and absorption spectra[J]. Remote Sensing, 2015, 7(11): 14781-14805.
[11] Hoepffner N, Sathyendranath S. Effect of pigment composition on absorption properties of phytoplankton[J]. Marine Ecology Progress Series, 1991, 73: 11-23.
[12] MacKey M D, MacKey D J, Higgins H W, et al. CHEMTAX-a program for estimating class abundances from chemical markers: application to HPLC measurements of phytoplankton[J]. Marine Ecology Progress Series, 1996, 144: 265-283.
[13] Ficek D, Kaczmarek S. Spectra of light absorption by phytoplankton pigments in the Baltic; conclusions to be drawn from a Gaussian analysis of empirical data[J]. Oceanologia, 2004, 46(4): 581-598.
[14] Moisan J R, Moisan T A, Matthew A L. An inverse modeling approach to estimating phytoplankton pigment concentrations from phytoplankton absorption spectra[J]. Journal of Geophysical Research Oceans, 2011, 116(C9): C09018.
[15] Dera J, Dariusz F, et al. Modelling the influence of acclimation on the absorption properties of marine phytoplankton[J]. Oceanology, 1999, 41(2): 187-210.
[16] 王桂芬, 曹文熙, 许大志, 等. 南海北部水体浮游植物比吸收系数的变化[J]. 热带海洋学报, 2005, 24(5): 1-10.
Wang G F, Cao W X, Xu D Z, et al. Variations in specific absorption coefficients of phytoplankton in northern South China Sea[J]. Journal of Tropical Oceanography, 2005, 24(5): 1-10.
[17] 王瑜. 基于吸收光谱的太湖铜绿微囊藻比例估算研究[D]. 南京: 南京师范大学, 2014.
WangY. Study on estimation of microcystis aeruginosa proportion in Taihu lake based on optical absorption spectra[D]. Nanjing: Nanjing Normal University, 2014.
[18] 周虹丽, 朱建华, 韩冰, 等. 几种典型藻种吸收光谱特性的比较[J]. 海洋技术, 2010, 29(3): 78-81, 92.
Zhou H L, Zhu J H, Han B, et al. Comparison of spectral absorption characteristics of several typical algae[J]. Ocean Technology, 2010, 29(3): 78-81, 92.
[19] 冯士筰. 海洋科学导论[M]. 北京: 高等教育出版社, 1999.
Feng SZ. An introduction to marine science[M]. Beijing: Higher Education Press, 1999.
[20] 王桂芬, 周雯, 林俊芳, 等. 南海北部海区浮游植物粒级结构生物光学反演模型的验证与评价[J]. 激光生物学报, 2014, 23(6): 502-515.
[21] Cleveland J S, Weidemann A D. Quantifying absorption by aquatic particles: a multiple scattering correction for glass-fiber filters[J]. Limnology and Oceanography, 1993, 38(6): 1321-1327.
[22] Thingstad T F, Zweifel U L, Rassoulzadegan F. P limitation of heterotrophic bacteria and phytoplankton in the northwest Mediterranean[J]. Limnology and Oceanography, 1998, 43(1): 88-94.
[23] Wright S W. Phytoplankton community structure and stocks in the East Antarctic marginal ice zone (BROKE survey, January-March 1996) determined by CHEMTAX analysis of HPLC pigment signatures[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2000, 47(12/13): 2363-2400.
[24] 徐青娜. 基于浮游植物吸收光谱的有害赤潮藻类信息提取方法[D]. 青岛: 中国海洋大学, 2011.
Xu QN. Information extraction technique for harmful red tide phytoplankton based on absorption properties[D]. Qingdao: Ocean University of China, 2011.
[25] Higgins H. MacKey D. Algal class abundances, estimated from chlorophyll and carotenoid pigments, in the western Equatorial Pacific under El Niño and non-El Niño conditions[J]. Deep Sea Research Part I: Oceanographic Research Papers, 2000, 47(8): 1461-1483.
[26] Aguirre-Gomez R, Weeks A R, Boxall S R. The identification of phytoplankton pigments from absorption spectra[J]. International Journal of Remote Sensing, 2001, 22(2/3): 315-338.
[27] 张前前, 王磊, 类淑河, 等. 浮游植物吸收光谱特征分析[J]. 光谱学与光谱分析, 2006, 26(9): 1676-1680.
Zhang Q Q, Wang L, Lei S H, et al. Characteristics of absorption spectra of phytoplankton[J]. Spectroscopy and Spectral Analysis, 2006, 26(9): 1676-1680.
[28] 张亭禄, 杜祥之, 徐青娜, 等. 一维小波分析在浮游植物吸收光谱有害赤潮藻类检测中的应用[J]. 光谱学与光谱分析, 2009, 29(10): 2743-2747.
[29] Furuya K, Hayashi M, Yabushita Y, et al. Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2003, 50(2): 367-387.
[30] 邹晓阁. 北黄海浮游藻类的光学特性和遥感反演研究[D]. 大连: 大连海事大学, 2012.
Zou XG. Study on the optical characteristic of phytoplankton and remote sensing inversionin north Yellow Sea[D]. Dalian: Dalian Maritime University, 2012.
[31] Chase A P, Boss E. Cetini c' I, et al. Estimation of phytoplankton accessory pigments from hyperspectral reflectance spectra: toward a global algorithm[J]. Journal of Geophysical Research: Oceans, 2017, 122(12): 9725-9743.
[32] 孔凡洲. 长江口赤潮区浮游植物的粒级结构、种类组成和色素分析[D]. 北京: 中国科学院, 2012.
Kong FZ. Size-fraction structure, species component and pigments analyses of phytoplankton in the bloom zone near Changjiang estuary[D]. Beijing: Chinese Academy of Sciences, 2012.
[33] 张晋芳. 长江口南部邻近海域浮游植物的吸收特性及其参数化研究[D]. 上海: 华东师范大学, 2013.
Zhang JF. Parameterization and variability of phytoplankton absorption properties in south adjacent coastal ocean of the Yangtze estuary[D]. Shanghai: East China Normal University, 2013.
[34] 张小玲, 殷高方, 赵南京, 等. 基于加权平均法的活体藻类三维荧光标准光谱构建[J]. 光学学报, 2018, 38(7): 0730001.
[35] Sathyendranath S, Lazzara L, Prieur L. Variations in the spectral values of specific absorption of phytoplankton[J]. Limnology and Oceanography, 1987, 32(2): 403-415.
[36] Nair A, Sathyendranath S, Platt T, et al. Remote sensing of phytoplankton functional types[J]. Remote Sensing of Environment, 2008, 112(8): 3366-3375.
Article Outline
李楠, 孙德勇, 环宇, 王胜强, 张海龙, 丘仲锋, 何宜军. 黄渤海浮游植物种群比吸收光谱的确定及其应用[J]. 光学学报, 2020, 40(6): 0601004. Nan Li, Deyong Sun, Yu Huan, Shengqiang Wang, Hailong Zhang, Zhongfeng Qiu, Yijun He. Determination and Application of Specific Absorption Spectra of Phytoplankton Species in Yellow Sea and Bohai Sea[J]. Acta Optica Sinica, 2020, 40(6): 0601004.






