基于多波长透射光谱的水体细菌生长阶段特征参数反演研究  下载: 910次
下载: 910次
1 引言
细菌是引起水体污染的重要污染物之一。掌握细菌的生长变化,估算细菌在生长过程中浓度、结构、化学组分等信息的变化,无论是对微生物学研究,还是对水体细菌微生物在线监测,都具有十分重要的意义。
目前,在细菌生长过程中进行多参数测量是识别水体细菌的重要方法之一,也是微生物学家长期以来研究的方向之一。测量水体细菌微生物浓度、大小的平板计数法、滤膜法、显微镜法等[1-4],具有准确率较高的特点,但操作复杂,耗时长,不适合对水体细菌微生物进行实时采集和检测。细胞内大分子组分含量测量方法,如显微荧光光度法,具有检测速度快的特点,但需要荧光试剂辅助,容易污染环境[5]。流式细胞术法具有操作简单、快速等优点,但仪器价格昂贵,不适于现场检测[6]。
多波长透射光谱产生于光与被测样品之间的相互作用,通过光谱分析可以获得样品结构和化学组分等特征信息,多波长透射光谱技术具有测试简单、无损伤、精度高、单次确定样品多个参数等优点。一些学者已经利用该技术在生物领域开展了相关研究工作,Callahan等[7]通过测量隐孢子虫卵囊悬浮液的透射光谱得到了隐孢子虫卵囊的大小等参数;Mattley等[8]测量了人体血小板的透射光谱,利用光散射理论分析了细胞的数量和粒径分布;Katz等[9]利用高斯散射理论和反常衍射理论分析了3种不同细菌的透射光谱,得到了不同细菌的平均大小。国内基于光谱学技术进行细菌微生物检测的研究较少,陶站华等[10] 利用光镊拉曼光谱技术研究了不同环境因素对葡萄球菌黄素合成的影响;卜敏等[11]研究了白细胞对偏振光的散射特性,结果表明散射分布规律和细胞模型的形体参量、光学参量具有相关性;王久悦等[12]研究了细菌对可见光的散射特性,获得了细胞大小和数量参数,但未得到细菌内化学组分的信息。
本课题组以水体常见细菌——大肠杆菌为研究对象,用紫外-可见分光光度计采集其各生长阶段的多波长透射光谱,分析了不同波段的光谱特征。基于Mie散射理论和Lambert-Beer定律,对测量的透射光谱进行解析,得到了大肠杆菌生长过程中细胞浓度、大小和核酸含量的变化信息。
2 基本原理
水体细菌特征参数的反演计算主要依据Mie散射理论和Lambert-Beer定律。细菌细胞结构分为两部分:外部结构和内部结构。外部结构由细胞质和细胞壁构成;内部结构由不吸收大分子(蛋白质、多糖、脂肪等)的细胞器构成,具有特殊的折射率增量。根据Mie散射理论,在240~900 nm波段范围内,细菌悬浮液整体散射光谱的光密度表达式为[12]
式中
细菌中每部分的散射系数的表达式为[16]
式中
式中
细菌吸收部分的特征参数反演可根据Beer-Lambert 定律得到。当一束强度为
式中
3 实验分析
3.1 细菌培养及制备
实验使用的大肠埃希氏菌购自中国工业菌种保藏管理中心。取大肠埃希氏菌斜面菌种1支,用接种环取菌苔,接入牛肉膏蛋白胨培养液中,静止培养18 h左右,获得细菌培养液(“种子”培养液)。吸取0.2 mL细菌培养液,接种于盛有20 mL的牛肉膏蛋白胨培养基的锥形瓶内。将已接种好的锥形瓶置于摇床上振荡,温度为25 ℃,振荡频率为每分钟150次,同批培养7个样品,按标记好的培养时间取出锥形瓶,并立刻放入冰箱(4 ℃)中贮存。摇动培养瓶,分别吸取3 mL不同生长时间的细菌培养液,加入离心管中,以12000 r·min-1的速度离心5 min。吸取其上清液,加入去离子水,以此方法清洗三遍,最后一次加入去离子水,得到细菌悬浮液。
3.2 试剂与仪器
实验所用牛肉膏、蛋白胨、氯化钠均购于国药化学试剂有限公司。实验仪器包括紫外-可见分光光度计(UV2550型)、智能培养箱(HP400G型)、无菌操作台(SW-CJ-ID型)、高速冷冻离心机(H-1650R型)、组合式光照振荡培养箱(MQP-B3G型)、石英比色皿(光程为10 mm)。
3.3 光谱测定
大肠杆菌悬浮液制备完成后,调节紫外-可见分光光度计波长为240~900 nm,采样间隔为1 nm,以去离子水作为对照,测定不同培养时间的大肠杆菌菌液的光密度,对每个悬浮液测量3次,取其平均值。在光谱采集前,需要用去离子水校正分光光度计的零点,以消除杂散光的影响。
3.4 细菌浓度的测定
将不同培养时间的大肠杆菌菌液用10倍稀释法进行一系列稀释,再用无菌吸管吸取1 mL不同稀释度的菌液(10-5、10-6、10-7)于无菌平皿中,然后在平皿中分别倒入45 ℃的营养琼脂培养基。轻轻转动平皿,使菌液与培养基混合均匀,冷凝倒置,然后置于培养箱中培养(37 ℃/24 h),直至长出菌落,即可对不同平皿中的细菌进行计数。最后根据取样接种量和稀释倍数即可计算出样品中的细菌数。
3.5 细菌大小的测定
取干净的载玻片,用无菌吸管吸取少量大肠杆菌的浓菌液,制成薄涂面;涂片经酒精灯火焰固定后,依次经过如下处理:结晶紫初染1 min,水洗,碘液水洗1 min,脱色液脱色约1 min,复染液复染30 s,最后用吸水纸轻轻吸干。利用光学显微镜(CX41型)观察细菌的大小。
4 结果与讨论
4.1 细菌在培养期间透射光谱的动态变化
以细菌菌液的培养时间为横坐标,以各时间点稀释液测得的光密度(波长为600 nm)为纵坐标,得到大肠杆菌的生长动态曲线,如
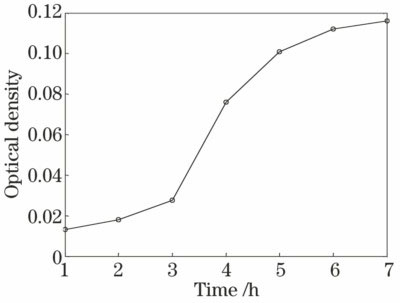
图 1. 水体大肠杆菌在600 nm波长处随时间变化的光密度
Fig. 1. Optical density of Escherichia coli in water at 600 nm versus time
菌液浓度在测量过程中难以控制,为了使不同培养阶段的透射光谱对应的样品浓度相等,首先对原谱线进行总和归一化处理。

图 2. 大肠杆菌菌液在不同生长时间的归一化光谱
Fig. 2. Normalized spectra of Escherichia coli suspension at different growth stages
4.2 细菌在培养期间大小的变化
在400~900 nm波段,透射光谱主要表现为细菌微生物的整体粒径和内部所含细胞器的散射作用,反映了细菌粒径大小以及结构等相关信息[10]。根据(1)式,利用非线性最小二乘算法对归一化透射谱进行迭代拟合,直到误差小于10-8,即可计算出菌液的散射光谱。 根据光谱拟合结果可以得到不同培养时期细菌的宏观结构、内部结构平均大小的动
态变化,如

图 3. 水体大肠杆菌不同生长时间下细胞平均大小、内部结构平均大小的变化趋势
Fig. 3. Changes of average size and the internal average size of Escherichia coli cells in water versus time
利用显微镜观察得到了不同生长时间点具有代表性的细菌菌体大小的变化图,如

图 4. 不同生长时间下大肠杆菌显微镜图。(a) 1 h;(b) 2 h;(c) 3 h;(d) 4 h;(e) 5 h;(f) 6 h;(g) 7 h
Fig. 4. Micrographs of Escherichia coli cells at different growth stages. (a) 1 h; (b) 2 h; (c) 3 h; (d) 4 h; (e) 5 h; (f) 6 h; (g) 7 h
4.3 细菌在培养期间的浓度变化
根据(1)式拟合得到的细菌宏观结构、内部结构平均粒径大小以及内外结构的消光比例可计算出400~900 nm波段的透射光谱,与原始测量光谱进行线性回归,可得出细菌浓度。
4.4 细菌在培养期间核酸含量的变化
大肠杆菌干物质的主要化学组分是蛋白质与核酸,几乎占整体的80%[18]。大肠杆菌对紫外光的吸收能力主要来自于细菌内的化学组分(核酸、发色团氨基酸)。细菌微生物中核酸、发色团氨基酸和吡啶二羧酸的吸收系数与波长的关系如
![细菌微生物中总核酸、发色团氨基酸和吡啶二羧酸的吸收系数[19]](/richHtml/zgjg/2018/45/2/0207023/img_6.jpg)
图 6. 细菌微生物中总核酸、发色团氨基酸和吡啶二羧酸的吸收系数[19]
Fig. 6. Absorption coefficients of total nucleic acid, chromophoric amino acids, and dipicolinic acid (DPA) in microorganism[19]
在生物体中组成蛋白质的氨基酸大约有20种,这些天然氨基酸在230~310 nm波长范围内大都没有吸收,只有芳香族氨基酸——酪氨酸、苯丙氨酸和色氨酸在250~300 nm波段均有吸收峰,其最大吸收系数对应的波长为280 nm。核酸中的核糖和磷酸在紫外区没有吸收,但嘌呤、嘧啶碱基具有共轭双键系统,对250~280 nm波段的紫外光具有强烈的吸收作用。选择细菌中发色团氨基酸和核酸吸收系数最大的波段(250~300 nm)的吸光度进行分析。
已知细菌浓度、粒径大小等参数,根据(1)式可以将散射光谱扩展到240~400 nm波段范围,从而得到整个测量波段范围内的散射光谱,然后用测量所得的透射光谱减去计算所得的散射光谱,就可以得到细菌的吸收光谱。根据Lambert-Beer定律可知,某一波长处的吸光度与各组分含量呈线性关系,但在大肠杆菌细胞中,除了核酸、发色团氨基酸对光有吸收外,还有其他成分的浓度及基线等因素影响吸光度。将大肠杆菌紫外吸收光谱
式中
计算得到了大肠杆菌在不同培养时间下细胞群体核酸含量的变化,如
由单位体积的核酸含量和细菌浓度的比值可以得到单个大肠杆菌细胞内的核酸含量,如

图 7. (a)大肠杆菌悬浮液总核酸含量随时间的变化趋势;(b)单个大肠杆菌平均核酸含量随时间的变化趋势
Fig. 7. (a) Total content of nucleotides in suspensions of Escherichia coli versus time; (b) average content of nucleotides per cell of Escherichia coli versus time
5 结论
采用分光光度法测定大肠杆菌在生长过程中紫外-可见光波段的透射光谱。根据Mie散射理论,对水体大肠杆菌在400~900 nm波段的散射光谱进行解析,得到了细菌在生长过程中细胞结构特征、浓度信息的变化。根据Lambert-Beer定理,采用吸光系数法计算出了不同生长阶段中大肠杆菌核酸的含量变化,与文献[ 20]的数据具有较好的一致性。综上所述,基于多波长透射光谱技术可以准确获取大肠杆菌结构特征和化学组分特征参数的动态变化,为水体细菌的在线快速检测和识别提供了技术支持,也为细胞多参数测量提供了一种新方法。
[3] ShenP, Chen XD. Microbiology[M]. 8th ed. Beijing: Advanced Education Press, 2016: 38- 39.
[4] 罗祎, 赵晋府, 周尔明, 等. 微生物检测国标法和滤膜法的比较[J]. 食品工业科技, 1999, 20(6): 54-56.
[5] 李素文, 霍满鹏, 成汝萱, 等. 对同一细胞内DNA、RNA和蛋白质含量相关测定的显微荧光光度法[J]. 生物物理学报, 1987, 3(4): 420-423.
[10] 陶站华, 柯珂, 师德强, 等. 利用光镊拉曼光谱分析环境因素对葡萄球菌黄素生物合成的影响[J]. 激光与光电子学进展, 2017, 54(12): 123001.
[11] 卜敏, 胡双双, 陶兆禾, 等. 偏振光下白细胞散射特征及其与细胞结构关系的分析[J]. 中国激光, 2017, 44(10): 1007002.
Bu M, Hu S S, Tao Z H, et al. Relationship between scattering behavior and structure of leukocytes with polarized light incidence[J]. Chinese Journal of Lasers, 2017, 44(10): 1007002.
[12] 王久悦, 赵南京, 段静波, 等. 水体细菌微生物多波长散射光谱快速定量检测[J]. 光谱学与光谱分析, 2017, 37(2): 333-337.
[16] Bohren CF, Huffman DR. Absorption and scattering of light by small particles[M]. New York: John Wiley & Sons, 1983: 228- 338.
[17] CooperS. Bacterial growth and division[M]. San Diego: Academic Press, 1991: 5.
[18] Churchward G, Bremer H, Young R. Macromolecular composition of bacteria[J]. Journal of Theoretical Biology, 1982, 94(3): 651-670.
[19] Murrell WG. Chemical composition of spores and spore structures, in the bacterial spores[M]. New York: Academic Press, 1969: 215- 220.
Article Outline
胡玉霞, 赵南京, 甘婷婷, 段静波, 刘建国, 刘文清. 基于多波长透射光谱的水体细菌生长阶段特征参数反演研究[J]. 中国激光, 2018, 45(2): 0207023. Hu Yuxia, Zhao Nanjing, Gan Tingting, Duan Jingbo, Liu Jianguo, Liu Wenqing. Growth Stages Characteristic Parameters of Bacteria in Water Based on Multi-Wavelength Transmission Spectra[J]. Chinese Journal of Lasers, 2018, 45(2): 0207023.







