光学成像技术在光动力剂量监测中的应用进展  下载: 1596次特邀综述
下载: 1596次特邀综述
1 引言
光动力疗法(PDT)是一种联合利用光敏剂(PS)、激发光和氧分子,通过光动力反应选择性治疗恶性病变和良性病变的精准疗法[1-3]。如
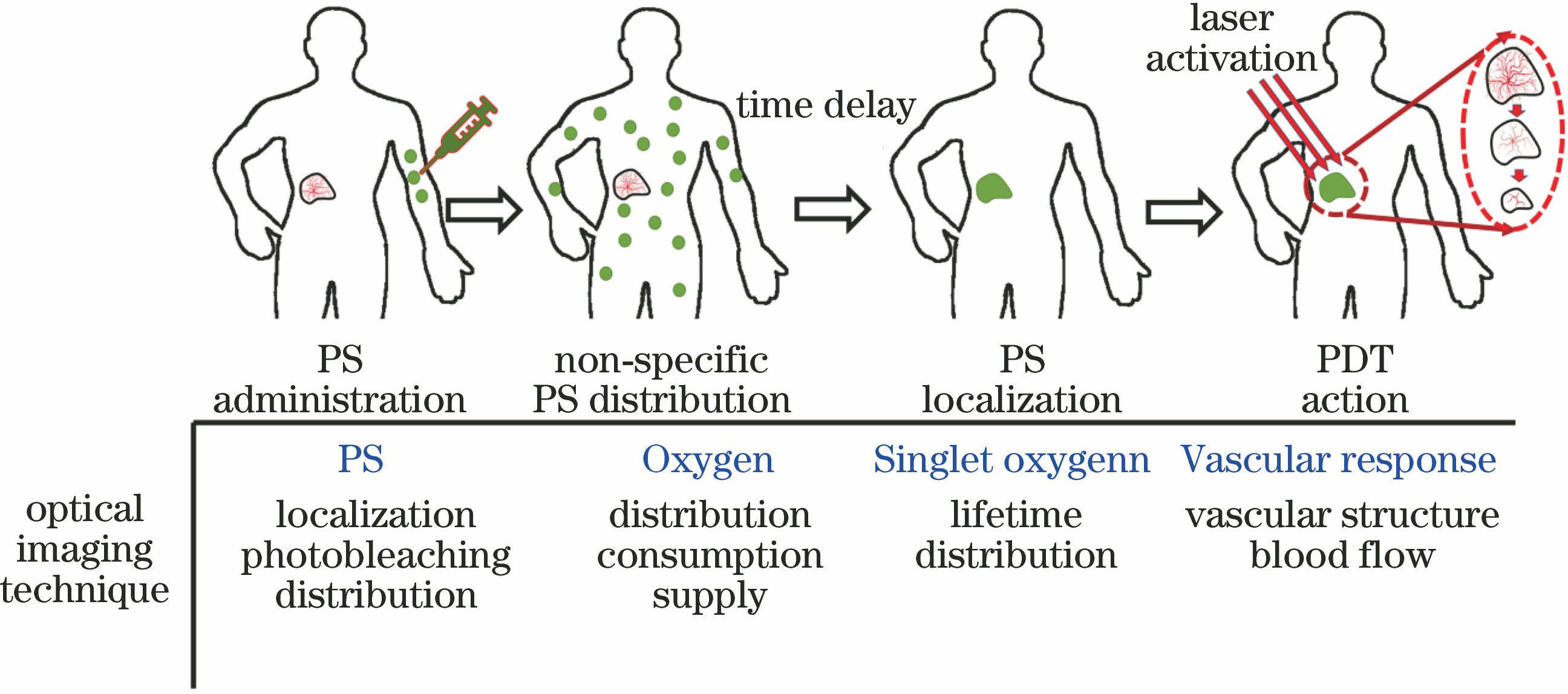
图 1. PDT原理及剂量参数的光学监测
Fig. 1. PDT principle and the optical monitoring for dose parameters
如

图 2. 光学成像技术在PDT剂量监测中的应用
Fig. 2. Applications of optical imaging techniques in monitoring PDT dose
2 光敏剂光学成像
通过检测光敏剂被激发的荧光强度,能够获得光敏剂的靶向性、光漂白特性和空间分布等信息。多光谱荧光成像(MSFI)是单点荧光光谱和空间荧光成像相结合的混合成像模式,该技术不仅能实时获取靶组织中光敏剂的二维空间荧光强度信息,还能通过分光元件分时得到荧光光谱信息[22]。选用不同的分光和探测元件,光谱分辨带宽可达几纳米,成像波段覆盖可见光到近红外光波段[23-24]。与此同时,PDT辐照光和光敏剂荧光除了受组织体的吸收和散射特性影响之外,还与组织体的自体荧光信号形成串扰。为了实现光敏剂浓度分布的定量成像分析,研究人员相继提出了不同的荧光定量算法。如
表 1. 定量检测光敏剂浓度的光学成像技术
Table 1. Optical imaging techniques for quantifying photosensitizer concentration
|
光敏剂也能作为光声成像造影剂。光敏剂吸收探测光的能量后会因热弹效应而产生超声波发射,最终基于PAI技术,可以实现光敏剂深度空间分布信息的检测。由于该方法基于超声信号进行探测,因此能够有效避免组织自体荧光的干扰。Hirao等[32]利用PAI检测了烧伤大鼠皮下组织中的光敏剂分布,成功获取了光敏剂的深度分布信息。Ho等[33]比较了5种不同光敏剂的光声效果,发现酞菁锌(ZnPc)的光声活性最高,并获得了ZnPc在小鼠肿瘤模型中的定位效率和不同时间观测点的生物分布。由于大多数光敏剂的最大吸收峰值位于可见光区域,因此光敏剂的PAI深度有限。为了提高成像深度,Hu等[34]研制了具有近红外光谱(NIR)吸收的溶酶体靶向氟化硼二吡咯(BODIPY)纳米粒子,它们可以在纳秒脉冲激光的辐照下在更深层次组织中实现光敏剂成像,同时在NIR辐照下也能有效杀伤肿瘤细胞。光敏剂在吸收PAI探测光过程中由于光漂白效应,降低了PAI的成像对比度[16]。为此,Yan等[35]设计合成了一种利用聚乙二醇氧化石墨烯装载卟啉钠(DVDMS)的新型纳米粒子GO-PEG-DVDMS,氧化石墨烯有效地增强了光敏剂的PAI成像。为了实现临床转化应用,新型纳米光敏剂的药代特性、化学毒性和特异性等有待于开展更多的临床试验研究。此外,PAI仅通过信号强度来反演光敏剂的空间分布信息,相对于MSFI,尚未见定量光敏剂浓度的成像结果。
3 氧参量光学成像
氧作为PDT的三大关键要素之一。增加氧含量有助于提高PDT过程中1O2的产量。组织微血管受到损伤而封闭后,将导致血管中的氧含量降低。氧含量不仅直接决定了PDT的疗效,还可以用于预测肿瘤的再生和复发[36]。在肿瘤乏氧的条件下,部分生物还原前药也将具有细胞毒性,能够协同PDT提高疗效[37]。血氧饱和度和组织氧分压是用于定量评估组织中氧含量的两个重要参量[38]。可用于监测氧参量的光学成像技术如
血氧饱和度表征的是血液中氧饱和血红蛋白含量和总血红蛋白含量的比值。PAI可以在几微米到几毫米的尺度范围内对血管形态结构和氧含量进行成像,其检测原理是含氧血红蛋白和脱氧血红蛋白分别在500~600 nm和700~800 nm存在显著的吸收差异,PAI利用不同的探测光进行光声成像并计算血氧饱和度相对量的变化[39]。Mallidi等[40]利用超声-PAI双模成像系统(Vevo LAZR, VisualSonics)监测小鼠胶质母肿瘤(GBM)的PDT疗效,并获得GBM的三维血氧饱和度图像。PDT治疗24 h后,GBM的血氧饱和度下降约85%。进一步的研究表明,根据所获得的三维血氧饱和度图像可以预测肿瘤的复发概率,进而使早期干预治疗成为可能。但是,这种技术无法对单一毛细血管实现血氧饱和度的精确成像。随后,Shao等[41]利用光声显微镜(PAM)开展了大鼠耳部模型的PDT实验,他们同时观察到了单根血管管径的缩小和血氧饱和度的下降。多光谱光声层析成像(MSOT)同时选用多个激光波长进行光声成像,提高了含氧血红蛋白和脱氧血红蛋白浓度的光谱解混精确度,实现了更高灵敏度的血氧饱和度成像。Neuschmelting等[42]利用MSOT研究小鼠肾肿瘤经WST-11光敏剂诱导PDT治疗后血氧饱和度的相对变化,结果表明,MSOT照明光源能有效激发WST-11。该手持MSOT探头由256个超声波探测器元件组成,且沿球面弧线均匀排列,中心频率为4 MHz,扫描角度为135°,分辨率为200 μm,在700~900 nm范围内以10 nm为间隔选取21个波长。
表 2. 用于监测氧参量的光学成像技术
Table 2. Optical imaging techniques for monitoring oxygen parameters
|
组织氧分压定义为特定组织间隙内的氧分压,反映的是特定时间内局部供氧与消耗之间的平衡关系。其检测原理是基于延迟荧光/磷光发光淬灭技术,利用氧敏感染料寿命与组织氧分压线性相关的特性实现组织氧分压成像。监测组织氧分压的传统方法需要使用氧敏感染料探针,不适合用于临床PDT[43-45]。Shao等[46]利用光声寿命成像(PALI)检测小鼠局部组织氧分压。PALI是一种基于磷光寿命成像(PLI)的技术,其原理与磷光发光淬灭机制类似。选用亚甲基蓝(MB)作为氧敏感染料,通过检测MB激发三重态寿命可以间接实现组织氧分压成像,所得到的组织氧分压值与Pyro science氧气测量仪的测量值相同,且能同时实现PDT治疗,成像深度约为1 cm。
除了上述应用于PDT氧参量监测的光学成像技术外,可见光OCT也可用于成像血管的血氧饱和度,其原理与PAI类似,不同之处在于其所检测的信号是经含氧血红细胞和脱氧血红细胞散射后的探测光[47]。Yi等[48]利用可见光OCT精确地测量大鼠视网膜的氧代谢速率,并在供氧不足时,监测视网膜循环(RC)与脉络膜循环(CC)的生理反应。Chen等[49]利用可见光OCT对小鼠皮质循环的血流动力学变化进行了成像,实验证实血氧饱和度随着血管管径的增大而增大。可见光OCT有望被应用于PDT中血氧饱和度的实时成像。
4 1O2发光成像
1O2的产量与空间分布直接决定了PDT的疗效。检测1O2的方法可分为直接检测和间接检测[14]。与直接检测法相比,间接检测法虽然具有较高的灵敏度,但用于检测1O2的吸光度探针、电子自旋共振(ESR)探针、荧光探针和化学发光探针等不仅淬灭光敏化过程中所产生的1O2,而且它们在不同细胞,特别是在不同组织微环境中的分布、药理代谢机制,以及化学毒性等还有待进一步研究。因此,间接检测法难以获得临床应用[50]。1O2敏化延迟荧光(SOSDF)是1O2能量反向转移至光敏剂激发态的延迟发射荧光。虽然该荧光能量强度比1O2发光强度高3个数量级,但基于SOSDF检测1O2仍是一种半直接定量检测方法。此外,SOSDF与光敏剂的瞬时荧光光谱波段相同,基于SOSDF检测1O2需要复杂的门控技术来区分SOSDF和瞬时荧光[51]。直接检测法利用高灵敏度光电检测系统测量1O2在1270 nm的发光,是测量1O2的金标准[14]。如
时间分辨扫描成像的优点在于能够通过脉冲光激发获得1O2发光的动力学信息(如1O2寿命和三重态光敏剂寿命),以及通过对时间分辨信号的处理来提高1O2发光信号检测的信噪比。2005年,Niedre等[52]利用近红外光电倍增管NIR-PMT(Photomultiplier Tube, R5509-14,Hamamatsu),结合可移动的三维平台,对小鼠皮肤组织进行了逐点扫描,首次获得了活体组织中氨基乙酰丙酸(ALA)诱导PpIX的1O2发光图像。随后,Looft等[53]利用自制光纤探头和NIR-PMT(H-10330-45,Hamamatsu),通过采用时间相关多光子计数(TCMPC)实现了对鸡绒毛尿囊膜(CAM)在PDT过程的1O2发光成像。更为重要的是,测量所获得的1O2发光动力学信息可提供动脉和静脉中的不同氧分压信息。
除了NIR-PMT外,超导纳米线单光子探测器(SNSPD)和负反馈雪崩二极管(NFAD)也已被用于时间分辨扫描成像。截至目前,1O2发光成像主要用的光电探测器件是NIR-PMT,其探测单元的有效面积>10 mm×10 mm,适合搭配大数值孔径光学镜头,以实现1O2发光信号的高效率收集。Kim等[54]开发了PMT-1O2检测系统(PMT-SOD),其甲醇溶液中光敏剂Che6和PPa的最低检测浓度和最高检测浓度分别为15 nmol/L和10 μmol/L。实验结果表明,PDT诱导的细胞毒性与PMT-SOD所检测得到的1O2产量成正相关。PMT的不足之处在于:低的量子效率(<1%);中等噪声(>10000 counts per second);光电阴极易受损,且难以抑制杂散光。SNSPD是一种高性能的超导材料单光子探测器,具有暗计数低、探测效率高(>85%)和检测频谱宽等优点。Gemmell等[55]利用低噪声SNSPD测量了溶液中玫瑰红的1O2发光,并采用窄带光谱滤波和化学猝灭法对1O2发光信号进行了验证。同时,他们还研究了牛血清蛋白(BSA)对1O2寿命的影响。SNSPD的不足之处在于:探测单元的有效面积较小(<10 μm×10 μm);SNSPD主要采用低温超导材料,需配置2.1 K以下的制冷系统,系统复杂且成本较高。与NIR-PMT和SNSPD相比,NFAD能够以10%的探测效率达到低至1 counts per second的暗计数率(DCR)。Boso等[56]利用NFAD开发了1O2发光检测系统,该系统不仅可以提高1O2发光信号的收集效率,还可以被应用于不同的临床情况(如光纤系统、共聚焦显微镜、扫描系统等)。该探测器与大面积多模光纤耦合,可以提高生物样品的体外和体内收集效率,与单模光纤耦合检测器相比,收集效率提高100倍。
表 3. 1O2发光的光学成像技术
Table 3. Optical imaging techniques for 1O2 luminescence
|
时间分辨扫描成像需要结合机械扫描装置实现多点扫描,在降低成像分辨率至毫米尺度的情况下,仍需要几百秒的成像时间。相反,稳态宽场成像基于带有滤光片的NIR相机能够快速获得高分辨的1O2发光图像,成像时间至少缩短了2个数量级以上。2011年,Hu等[57]利用近红外面阵CCD相机(XEVA-CL-FPA-1.7-320-TE1-60Hz,Xenics)获得256 pixel×320 pixel的活体1O2发光图像,成像时间为1 s。Lee等[58]基于高灵敏度NIR-CCD(MOSIR 950,Intevac)开发了荧光-1O2发光双光路多模成像系统,该系统的离体成像时间不超过30 s,成像范围为1024 pixel×256 pixel。他们利用该系统获得荷瘤小鼠PDT的1O2发光图像。随后,Lin等[59]利用自主设计的大视场近红外镜头和NIR-CCD (Xeva-1.7-320,Xenics)首次获得了活体小鼠皮窗模型微血管中1O2的发光图像,并定量研究了光剂量对1O2发光的影响。研究结果表明,对于感兴趣区域中的血管,在相同玫瑰红剂量作用下,1O2发光强度与光剂量呈线性关系。目前,稳态宽场成像的不足在于:生物环境中1O2的发光量子产率极低(10-8),检测信号易受到背景信号光的干扰,且目前尚无法实时提供1O2发光动力学信息。
在充分利用时间分辨扫描成像和稳态宽场成像各自优点的基础上,开发高灵敏度的时空分辨1O2发光成像技术是未来的发展方向。该技术能够集成时间分辨和宽场成像单元,同步获取1O2发光空间分布和动力学信息。
5 血管响应光学成像
血管作为PDT作用机制的靶标之一,对其生物响应的监测有望用于优化治疗方案和预测PDT疗效。如
LDI基于激光多普勒血流仪(LDF)[60],利用辐照激光照射流动血红细胞所产生的多普勒平移效应,反演血管的血流速度信息。相对于LDF,LDI利用机械扫描方式实现了大视场范围的血流速度成像,且无需使用接触式探头[61]。Chen等[62]利用LDI动态监测了鲜红斑痣(PWS)的PDT治疗效果,结果表明,PWS病变部位的血流灌注率显著高于正常皮肤,且血流灌注率在治疗初期显著上升,随后在达到峰值之后又缓慢下降到较低的水平。LDI的优点在于其能够无创快速成像大视场的血流速度,但该技术受限于探测光在组织中的快速衰减,通常仅能测量组织深度<500 μm的血管血流速度[63],且难以分辨血管的形态结构。
LSI基于辐照激光照射血红细胞所产生的动态散斑信号,对该动态散斑信号在时间域和空间域上的强度和频率的变化进行统计分析,获取反映血流速度的散斑衬比图像[64]。LSI具有成像速度快、时空分辨率高和成像视场大等优势,且还能同时获得血管的形态结构等信息[65-66]。Kruijt等[67]利用LSI研究了小鼠皮窗模型在PDT过程中的血流变化,结果表明LSI能够实现对单根动脉、静脉和毛细血管的成像。Moy等[68]利用LSI定量研究了鼠背皮窗模型在PDT后的血管损伤,结果表明,当Npe6给药剂量为5 mg/kg且光剂量大于85 J时,PDT诱导血管产生了不可逆损伤。Ren等[69]利用LSI测量了PDT治疗PWS后血流灌注率的变化,并定量评估了病变区域血管微循环的改变。LSI的成像速度和面积优于LDI、功能性OCT和PAI,且能同时提供血流速度和血管形态结构信息。LSI的不足在于:受限于生物组织的高散射特性,其成像深度小于700 μm,且无法提供血管的三维分布信息[70]。
PAI使用超声转换装置探测生物组织吸收光子能量后因热弹效应而产生的超声波信号,进而反演组织的内部结构[71]。该技术同时具有光学成像分辨率高和超声波成像深度深的优点[72-74]。Xiang等[75]利用光声层析成像(PAT)观察了CAM经PDT治疗后血管的损伤,结果表明,血管损伤程度与光敏剂浓度、光强成正相关。Shao等[41]在通过PAM监测小鼠耳部血氧饱和度的同时,还利用PAM研究了小鼠耳部浅表内微血管的三维形态结构,其成像分辨率可达60 μm。PAI的优点在于:成像深度最大可达10 cm,相应的轴向分辨率为0.1~1.0 mm[71],且PAI能够提供三维的血管组织结构和氧参量信息。但是,PAI的成像轴向分辨率较功能型OCT低,且PAI的成像速度不及LSI快。另外,由于PAI基于超声信号进行探测,因此探头须与测量组织贴合,属于接触式测量。
表 4. 监测血管响应的光学成像技术
Table 4. Optical imaging techniques for monitoring vascular response
| ||||||||||||||||||||||||||||||||
功能型OCT是指能够对生理功能信息(如血流速度、血氧饱和度、组织光学双折射特性等)进行监测的OCT技术[76-77]。目前,应用于PDT剂量参量监测的功能型OCT包括多普勒光学层析成像OCT(DOCT)和微血管光学造影OCT(OCTA)。DOCT结合OCT和光学多普勒效应,通过探测相邻轴向扫描之间信号的相位变化来获得血管内的血流速度[78]。OCTA将血红细胞与周围组织的相对运动作为内源性的血流标记特征来区分静态组织背景和动态血流信号,实现血管分布特征的三维成像[79-80]。Latrive等[81]利用DOCT开展了PWS和血管瘤病变区域内血管形态和血流速度的对比研究,结果表明,两种不同病灶组织中的血管特征之间存在显著差异。Pellegrin等[82]利用OCTA观察了患者的脉络膜新生血管(CNV),对11位患者的CNV确诊率为100%,优于荧光素血管造影的确诊率(90%)和吲哚菁绿血管造影的确诊率(83%),同时,还观察到了CNV的大小和形状。De Jong等[83]利用OCTA评估了PDT后患者视网膜血管瘤增生(RAP)的疗效,结果表明OCTA可用于优化RAP的治疗方案。在PDT治疗中,血管的生物响应有强弱之分:强响应表现为血管出血,血管无血液和血栓等;弱响应表现为血细胞聚集、血流停滞和血管充血等。对于血管弱响应,静止血液中依然存在运动的血红细胞,仅依赖基于强度/相位算法的OCTA无法区分PDT治疗前后血管的细微结构变化。为此,Sirotkina等开发了M型光学相干血管造影系统(MML-OCA),该系统结合了多普勒效应和相位/强度方差算法,与OCTA相比,具有更高的成像灵敏度和鲁棒特性[84]。此外,静止血液引起散斑变化的频率通常小于50 Hz,基于高通滤波器滤除频率低于96 Hz的复杂散斑,可使该系统具有识别弱血管响应的能力[85]。随后,Sirotkina等[86]将MML-OCA应用于临床监测基底细胞癌的PDT疗效,结果表明,治疗后24 h内肿瘤血管的密度显著降低,并可根据血管密度预测肿瘤的复发概率。功能型OCT的优点在于快速、实时、高分辨率,且轴向分辨率最高可达1 μm[87],可实现对血管三维分布的高分辨实时成像;但OCT成像深度通常约为3 mm[88],且DOCT的血流测量精确性依赖于血流和探测光束之间的角度方向,无法测量垂直于光束方向的血管中的血流速度[89]。
6 结束语
本文在介绍PDT治疗过程中光敏剂、氧、单线态氧以及血管响应等参量的基础上,全面总结用于实时监测PDT剂量参量的光学成像技术,并比较分析了成像技术的优势和局限性。1)MSFI和PAI均可应用于光敏剂空间分布成像。MSFI虽然可以实现光敏剂浓度的精确定量测量,但无法获得光敏剂的三维空间分布信息。相反,PAI可以获得光敏剂的三维空间分布信息,但成像过程中光敏剂易被漂白,需要借助纳米技术提高光敏剂的成像衬比度。2)PAI是用于监测氧参量的主要光学成像技术,可见光OCT也已获得初步应用,但它们分别受限于成像深度和成像轴向分辨率。如何设计更为合适的算法以实现更高灵敏度的氧参量成像是今后的重点发展方向。3)1O2发光的时间分辨扫描成像虽然能获得光敏化1O2的动力学信息,但成像时间至少需要几百秒;稳态宽场成像虽然可将成像时间缩短2个量级以上,但无法获得1O2发光的动力学信息。为此,充分利用时间分辨扫描成像和稳态宽场成像各自的优点,开发出高灵敏度的时空分辨1O2发光成像技术是未来的发展方向。4)LDI、LSI、PAI和功能型OCT均可监测PDT治疗过程中的血管响应,其中:LDI成像深度<500 μm,无法分辨血管形态结构;LSI成像深度<700 μm,无法提供血管的三维分布信息;PAI成像深度<10 cm,属接触式光学成像,轴向分辨率低于功能型OCT;功能型OCT成像深度约为3 mm,DOCT无法测量垂直于探测光束的血管中的血流速度。在临床PDT应用中,需根据监测需求选择不同的光学成像技术。
鉴于不同剂量参数之间的复杂相互作用以及不同光学成像技术自身的局限性,单一的光学成像技术难以监测所有的PDT剂量参数。为了实现对PDT中多个剂量参数的同步监测,研发由多种光学成像技术集成的多模光学成像系统或光学成像平台是未来的重点发展方向,是研究不同剂量参数之间相互作用关系和开展个性化精准治疗的关键。
[1] Yun S H. Kwok S J J. Light in diagnosis, therapy and surgery[J]. Nature Biomedical Engineering, 2017, 1(1): 0008.
[2] Fukumura D, Jain R K. Photodynamic therapy for cancer[J]. Nature Reviews Cancer, 2003, 3(5): 380-387.
[3] 李步洪, 谢树森, Wilson Brian C. 光动力学疗法剂量学的研究进展[J]. 生物化学与生物物理进展, 2009, 36(6): 676-683.
Li B H, Xie S S, Wilson B C. Advances in photodynamic therapy dosimetry[J]. Progress in Biochemistry and Biophysics, 2009, 36(6): 676-683.
[4] Celli J P, Spring B Q, Rizvi I, et al. Imaging and photodynamic therapy: mechanisms, monitoring, and optimization[J]. Chemical Reviews, 2010, 110(5): 2795-2838.
[5] Weishaupt K R, Gomer C J, Dougherty T J. Identification of singlet oxygen as the cytotoxic agent in photo-inactivation of a murine tumor[J]. Cancer Research, 1976, 36: 2326-2329.
[6] Yamamoto J, Yamamoto S, Hirano T, et al. Monitoring of singlet oxygen is useful for predicting the photodynamic effects in the treatment for experimental glioma[J]. Clinical Cancer Research, 2006, 12(23): 7132-7139.
[7] Krasnovsky A A Jr. Luminescence and photochemical studies of singlet oxygen photonics[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2008, 196(2/3): 210-218.
[9] 李黎波, 李文敏, 项蕾红, 等. 光动力疗法在中国的应用与临床研究[J]. 中国激光医学杂志, 2012, 21(5): 278-307.
Li L B, Li W M, Xiang L H, et al. Photodynamic therapy: clinical research and application in China[J]. Chinese Journal of Laser Medicine & Surgery, 2012, 21(5): 278-307.
[10] Star W M. Lightdosimetry in vivo[J]. Physics in Medicine and Biology, 1997, 42(5): 763-787.
[11] Dougherty T J. Photosensitizers: therapy and detection of malignant tumors[J]. Photochemistry and Photobiology, 1987, 45(6): 879-889.
[12] Fuchs J, Thiele J. The role of oxygen in cutaneous photodynamic therapy[J]. Free Radical Biology and Medicine, 1998, 24(5): 835-847.
[13] 陈德福, 王颖, 顾瑛. 血管靶向光动力疗法治疗鲜红斑痣的剂量监测技术研究进展[J]. 中国激光医学杂志, 2016, 25(2): 82-96.
Chen D F, Wang Y, Gu Y. Progress in dosimetric monitoring techniques involved in vascular targeted photodynamic therapy for port wine stains[J]. Chinese Journal of Laser Medicine & Surgery, 2016, 25(2): 82-96.
[14] Li B, Lin L, Lin H. Photosensitized singlet oxygen generation and detection: recent advances and future perspectives in cancer photodynamic therapy[J]. Journal of Biophotonics, 2016, 9(11/12): 1314-1325.
[16] Mallidi S, Spring B Q, Chang S, et al. Optical imaging, photodynamic therapy and optically triggered combination treatments[J]. The Cancer Journal, 2015, 21(3): 194-205.
[17] Robertson C A, Evans D H, Abrahamse H. Photodynamic therapy (PDT):a short review on cellular mechanisms and cancer research applications for PDT[J]. Journal of Photochemistry and Photobiology B: Biology, 2009, 96(1): 1-8.
[18] 蓝善优, 张达, 刘小龙, 等. 肿瘤微环境响应的智能纳米载体在肿瘤光动力治疗中的应用[J]. 中国激光, 2018, 45(2): 0207008.
[19] Fingar V H. Vascular effects of photodynamic therapy[J]. Journal of Clinical Laser Medicine & Surgery, 1996, 14(5): 323-328.
[20] Krammer B. Vascular effects of photodynamic therapy[J]. Anticancer Research, 2001, 21(6B): 4271-4277.
[21] Chen B, Pogue B W, Luna J M. Tumor vascular permeabilization by vascular-targeting photosensitization: effects, mechanism, and therapeutic implications[J]. Clinical Cancer Research, 2006, 12(3): 917-923.
[22] Shapey J, Xie Y J, Nabavi E, et al. Intraoperative multispectral and hyperspectral label-free imaging: a systematic review of in vivo clinical studies[J]. Journal of Biophotonics, 2019, 12(9): 201800455.
[23] Zhou L. El-Deiry W S. Multispectral fluorescence imaging[J]. Journal of Nuclear Medicine, 2009, 50(10): 1563-1566.
[24] Hillebrands J L, van Dam G M, et al. Multispectral near-infrared fluorescence molecular imaging of matrix metalloproteinases in a human carotid plaque using a matrix-degrading metalloproteinase-sensitive activatable fluorescent probe[J]. Circulation, 2009, 119(20): 534-536.
[25] Valdés P A, Leblond F, Jacobs V L, et al. Quantitative, spectrally-resolved intraoperative fluorescence imaging[J]. Scientific Reports, 2012, 2: 798.
[26] Valdés P A, Leblond F, Kim A, et al. A spectrally constrained dual-band normalization technique for protoporphyrin IX quantification in fluorescence-guided surgery[J]. Optics Letters, 2012, 37(11): 1817-1819.
[28] Jermyn M, Gosselin Y, Valdes P A, et al. Improved sensitivity to fluorescence for cancer detection in wide-field image-guided neurosurgery[J]. Biomedical Optics Express, 2015, 6(12): 5063-5074.
[29] Sibai M, Veilleux I, Elliott J T, et al. Quantitative spatial frequency fluorescence imaging in the sub-diffusive domain for image-guided glioma resection[J]. Biomedical Optics Express, 2015, 6(12): 4923-4933.
[30] Xie Y J, Thom M, Ebner M, et al. Wide-field spectrally resolved quantitative fluorescence imaging system: toward neurosurgical guidance in glioma resection[J]. Journal of Biomedical Optics, 2017, 22(11): 116006.
[31] Sunar U, Rohrbach D J, Morgan J, et al. Quantification of PpIX concentration in basal cell carcinoma and squamous cell carcinoma models using spatial frequency domain imaging[J]. Biomedical Optics Express, 2013, 4(4): 531-537.
[32] Hirao A, Sato S, Saitoh D, et al. In vivo photoacoustic monitoring of photosensitizer distribution in burned skin for antibacterial photodynamic therapy[J]. Photochemistry and Photobiology, 2010, 86(2): 426-430.
[33] Ho C J H, Balasundaram G, Driessen W, et al. Multifunctional photosensitizer-based contrast agents for photoacoustic imaging[J]. Scientific Reports, 2015, 4: 5342.
[34] Hu W B, Ma H H, Hou B, et al. Engineering lysosome-targeting BODIPY nanoparticles for photoacoustic imaging and photodynamic therapy under near-infrared light[J]. ACS Applied Materials & Interfaces, 2016, 8(19): 12039-12047.
[35] Yan X F, Hu H, Lin J, et al. Optical and photoacoustic dual-modality imaging guided synergistic photodynamic/photothermal therapies[J]. Nanoscale, 2015, 7(6): 2520-2526.
[36] Krzykawska-Serda M, Dabrowski J M, Arnaut L G, et al. The role of strong hypoxia in tumors after treatment in the outcome of bacteriochlorin-based photodynamic therapy[J]. Free Radical Biology and Medicine, 2014, 73: 239-251.
[37] Liu Y Y, Liu Y, Bu W B, et al. Hypoxia induced by upconversion-based photodynamic therapy: towards highly effective synergistic bioreductive therapy in tumors[J]. Angewandte Chemie International Edition, 2015, 54(28): 8105-8109.
[38] Cao F, Qiu Z H, Li H H, et al. Photoacoustic imaging in oxygen detection[J]. Applied Sciences, 2017, 7(12): 1262.
[39] Moore C, Jokerst J V. Strategies for image-guided therapy, surgery, and drug delivery using photoacoustic imaging[J]. Theranostics, 2019, 9(6): 1550-1571.
[40] Mallidi S, Watanabe K, Timerman D, et al. Prediction of tumor recurrence and therapy monitoring using ultrasound-guided photoacoustic imaging[J]. Theranostics, 2015, 5(3): 289-301.
[41] Shao P, Chapman D W, Moore R B, et al. Monitoring photodynamic therapy with photoacoustic microscopy[J]. Journal of Biomedical Optics, 2015, 20(10): 106012.
[42] Neuschmelting V, Kim K, Malekzadeh-Najafabadi J, et al. WST11 vascular targeted photodynamic therapy effect monitoring by multispectral optoacoustic tomography (MSOT) in mice[J]. Theranostics, 2018, 8(3): 723-734.
[43] Hirakawa Y, Mizukami K, Yoshihara T, et al. Intravital phosphorescence lifetime imaging of the renal cortex accurately measures renal hypoxia[J]. Kidney International, 2018, 93(6): 1483-1489.
[44] Sakadžic S, Roussakis E, Yaseen M A, et al. Two-photon high-resolution measurement of partial pressure of oxygen in cerebral vasculature and tissue[J]. Nature Methods, 2010, 7(9): 755-759.
[45] Wang Y, Hu S, Maslov K, et al. In vivo integrated photoacoustic and confocal microscopy of hemoglobin oxygen saturation and oxygen partial pressure[J]. Optics Letters, 2011, 36(7): 1029-1031.
[46] Shao Q, Ashkenazi S. Photoacoustic lifetime imaging fordirect in vivo tissue oxygen monitoring[J]. Journal of Biomedical Optics, 2015, 20(3): 036004.
[47] Chen S Y, Shu X, Nesper P L, et al. Retinal oximetry in humans using visible-light optical coherence tomography[J]. Biomedical Optics Express, 2017, 8(3): 1415-1429.
[48] Yi J, Liu W Z, Chen S Y, et al. Visible light optical coherence tomography measures retinal oxygen metabolic response to systemic oxygenation[J]. Light: Science & Applications, 2015, 4(9): e334.
[49] Chen S Y, Liu Q, Shu X, et al. Imaging hemodynamic response after ischemic stroke in mouse cortex using visible-light optical coherence tomography[J]. Biomedical Optics Express, 2016, 7(9): 3377-3389.
[50] 蒋昕鹏, 戴志飞. 光动力活性氧的研究进展[J]. 科学通报, 2018, 63(18): 1783-1802.
Jiang X P, Dai Z F. Reactive oxygen species in photodynamic therapy[J]. Chinese Science Bulletin, 2018, 63(18): 1783-1802.
[51] Scholz M, Biehl A L, Dědic R, et al. The singlet-oxygen-sensitized delayed fluorescence in mammalian cells: a time-resolved microscopy approach[J]. Photochemical & Photobiological Sciences, 2015, 14(4): 700-713.
[52] Niedre M J, Yu C S, Patterson M S, et al. Singlet oxygen luminescence as an in vivo photodynamic therapy dose metric: validation in normal mouse skin with topical amino-levulinic acid[J]. British Journal of Cancer, 2005, 92(2): 298-304.
[53] Looft A, Pfitzner M, Preuß A, et al. In vivo singlet molecular oxygen measurements: sensitive to changes in oxygen saturation during PDT[J]. Photodiagnosis and Photodynamic Therapy, 2018, 23: 325-330.
[54] Kim I W, Park J M, Roh Y J, et al. Direct measurement of singlet oxygen by using a photomultiplier tube-based detection system[J]. Journal of Photochemistry and Photobiology B: Biology, 2016, 159: 14-23.
[55] Gemmell N R. McCarthy A, Liu B C, et al. Singlet oxygen luminescence detection with a fiber-coupled superconducting nanowire single-photon detector[J]. Optics Express, 2013, 21(4): 5005-5013.
[56] Boso G, Ke D M, Korzh B, et al. Time-resolved singlet-oxygen luminescence detection with an efficient and practical semiconductor single-photon detector[J]. Biomedical Optics Express, 2016, 7(1): 211-224.
[57] Hu B L, Zeng N, Liu Z Y, et al. Two-dimensional singlet oxygen imaging with its near-infrared luminescence during photosensitization[J]. Journal of Biomedical Optics, 2011, 16(1): 016003.
[58] Lee S, Isabelle M E. Gabally-Kinney K L, et al. Dual-channel imaging system for singlet oxygen and photosensitizer for PDT[J]. Biomedical Optics Express, 2011, 2(5): 1233-1242.
[59] Lin L S, Li Y R, Zhang J D, et al. Vessel constriction correlated with local singlet oxygen generation during vascular targeted photodynamic therapy[J]. Proceedings of SPIE, 2014, 9268: 92680T.
[60] Briers D J. Laser Doppler, speckle and related techniques for blood perfusion mapping and imaging[J]. Physiological Measurement, 2001, 22(4): R35-R66.
[61] 林黎升, 陈德福, 顾瑛, 等. 评估光动力血管损伤的光学监测技术[J]. 激光生物学报, 2016, 25(2): 97-106.
[62] Chen D F, Ren J, Wang Y, et al. Intraoperative monitoring of blood perfusion in port wine stains by laser Doppler imaging during vascular targeted photodynamic therapy: a preliminary study[J]. Photodiagnosis and Photodynamic Therapy, 2016, 14: 142-151.
[63] Yu G, Durduran T, Zhou C, et al. Noninvasive monitoring of murine tumor blood flow during and after photodynamic therapy provides early assessment of therapeutic efficacy[J]. Clinical Cancer Research, 2005, 11(9): 3543-3552.
[65] Vaz P G, Humeau-Heurtier A, Figueiras E, et al. Laser speckle imaging to monitor microvascular blood flow: a review[J]. IEEE Reviews in Biomedical Engineering, 2016, 9: 106-120.
[66] 李晨曦, 陈文亮, 蒋景英, 等. 激光散斑衬比血流成像技术研究进展[J]. 中国激光, 2018, 45(2): 0207006.
[70] Abdurashitov A, Bragina O, Sindeeva O, et al. Off-axis holographic laser speckle contrast imaging of blood vessels in tissues[J]. Journal of Biomedical Optics, 2017, 22(9): 091514.
[71] Wang L V, Yao J J. A practical guide to photoacoustic tomography in the life sciences[J]. Nature Methods, 2016, 13(8): 627-638.
[72] 唐嘉铭, 黄正. 光声成像在光动力疗法研究中的应用[J]. 激光生物学报, 2016, 25(3): 204-208.
[73] Gao X X, Tao C, Wang X D, et al. Quantitative imaging of microvasculature in deep tissue with a spectrum-based photo-acoustic microscopy[J]. Optics Letters, 2015, 40(6): 970-973.
[74] Liu L B, Tao C, Liu X J, et al. Photoacoustic tomography from weak and noisy signals by using a pulse decomposition algorithm in the time-domain[J]. Optics Express, 2015, 23(21): 26969-26977.
[75] Xiang L Z, Xing D, Gu H M, et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor[J]. Journal of Biomedical Optics, 2007, 12(1): 014001.
[76] 李培, 李鹏. 多样本光学相干血流运动造影技术及应用[J]. 中国激光, 2018, 45(3): 0307001.
[77] Swanson E A, Fujimoto J G. The ecosystem that powered the translation of OCT from fundamental research to clinical and commercial impact[J]. Biomedical Optics Express, 2017, 8(3): 1638-1664.
[78] Leitgeb R A, Werkmeister R M, Blatter C, et al. Doppler optical coherence tomography[J]. Progress in Retinal and Eye Research, 2014, 41(10): 26-43.
[79] de Carlo T E, Romano A, Waheed N K, et al. A review of optical coherence tomography angiography (OCTA)[J]. International Journal of Retina and Vitreous, 2015, 1(1): 5.
[80] Chen C L, Wang R K. Optical coherence tomography based angiography[J]. Biomedical Optics Express, 2017, 8(2): 1056-1082.
[81] Latrive A. Teixeira L R C, Gomes A S L, et al. Characterization of skin Port-Wine Stain and Hemangioma vascular lesions using Doppler OCT[J]. Skin Research and Technology, 2016, 22(2): 223-229.
[82] Pellegrini M, Corvi F. Say E A T, et al. Optical coherence tomography angiography features of choroidal neovascularization associated with choroidal nevus[J]. Retina, 2018, 38(7): 1338-1346.
[83] de Jong JH, BraafB, AmarakoonS, et al. Treatment effects in retinal angiomatous proliferation imaged with OCT angiography[C]//Annual Meeting of the Association for Research in Vision and Ophthalmology(ARVO), May 01, 2016, Seattle, WA, USA. Maryland: Assoc Res Vis & Ophthalmol, 2019, 241( 3): 143- 153.
[84] Matveev L A, Zaitsev V Y, Gelikonov G V, et al. Hybrid M-mode-like OCT imaging of three-dimensional microvasculature in vivo using reference-free processing of complex valued B-scans[J]. Optics Letters, 2015, 40(7): 1472-1475.
[85] Sirotkina M A, Matveev L A, Shirmanova M V, et al. Photodynamic therapy monitoring with optical coherence angiography[J]. Scientific Reports, 2017, 7: 41506.
[86] Sirotkina M A, Gubarkova E V, Matveev L A, et al. Optical coherence angiography monitoring of tumor early response to PDT in experimental and clinical studies[J]. Proceedings of SPIE, 2019, 11079: 110790K.
[87] Harper D J, Augustin M, Lichtenegger A, et al. White light polarization sensitive optical coherence tomography for sub-micron axial resolution and spectroscopic contrast in the murine retina[J]. Biomedical Optics Express, 2018, 9(5): 2115-2129.
[88] Fujimoto J G. Optical coherence tomography for ultrahigh resolution in vivo imaging[J]. Nature Biotechnology, 2003, 21(11): 1361-1367.
[89] Liu G J, Chen A Z. Advances in Doppler OCT[J]. Chinese Optics Letters, 2013, 11(1): 011702.
李文博, 沈毅, 李步洪. 光学成像技术在光动力剂量监测中的应用进展[J]. 中国激光, 2020, 47(2): 0207006. Li Wenbo, Shen Yi, Li Buhong. Advances in Optical Imaging for Monitoring Photodynamic Therapy Dosimetry[J]. Chinese Journal of Lasers, 2020, 47(2): 0207006.






