基于动态散斑的光学相干层析成像技术  下载: 959次
下载: 959次
1 引言
光学相干层析成像(OCT)是一种非侵入式成像方法,通过低相干光干涉来获取生物的组织结构。OCT技术通过解析从组织中返回的背向散射光来获得高分辨率的生物组织内部截面图以及三维结构图。随着技术的不断发展,以OCT为基础的相关方法也得到持续改善,衍生出了许多技术,例如将OCT技术与医用电子内窥镜相结合可以对胃肠道、支气管、血管等器官进行诊断[1],还可以利用OCT实现无创血糖监测[2]。多普勒OCT就是由OCT技术结合多普勒原理发展而来的血管造影技术,可以提取由散射颗粒移动所产生的多普勒频移信号来区分静态的组织和动态的血流。血管信息的获取在生物医学应用领域具有重要的意义。
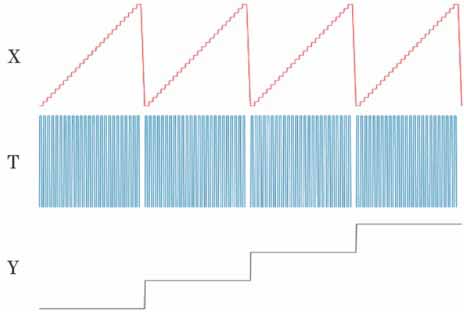
多普勒OCT技术基于多普勒效应引起频移的原理[3],能够提供活体的血管、血流方向和血流速度信息[4],通过计算空间位置相同或者高度重叠的两线之间的相位差来确定多普勒频移信息[5]。但由于生物组织通常是光学非均匀性结构,相当于引入了相位差,故多普勒OCT图像上存在纹理图案伪影[6]。因此,使用强度信息代替相位信息进行处理,有利于改善造影成像的质量。通过分析相邻几帧OCT图像的信息,从强度信息中提取散斑信息,然后构建三维血管图[7-8]。但该方法要计算相邻几帧的信息,由采样定理可知采样时会产生频谱混叠,所以采用同一位置多次采集的方式来避免频谱混叠。
本文通过处理OCT强度信息实现生物血管造影。OCT图像中存在生物散斑信息,血管中血液流动产生动态散斑效应,通过提取动态散斑与静态散斑,进而提取生物组织中的血管位置信息。该方法可以克服相位波动引起的纹理图案伪影,从而构建生物组织的三维高分辨率血管结构。通过实验验证了激光散斑的处理方法可以移植到OCT技术中,将动态散斑技术应用于OCT中,构建了小白鼠耳朵的血管模型。
2 实验原理
激光经粗糙表面反射后呈现明显的颗粒状或斑驳,这种现象被称为散斑[9]。散斑图案主要分为两
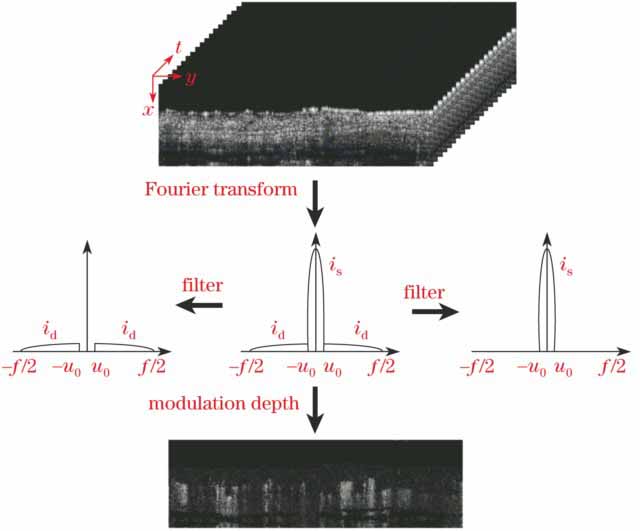
种:静态散斑和动态散斑。若散射颗粒保持静止,产生的散斑图案也是静止的;若散射体发生形变或位移,则散斑图像产生波动,光强分布不断变化,形变越剧烈或位移越大,散斑图像的波动也越剧烈。OCT中也存在散斑信号,其统计性质与激光散斑类似[9],且散斑信号可用来表征流速[10]。首先,将相机采集到的光谱信号沿波矢方向进行傅里叶变换,解析出沿深度方向不同回光位置的强度信号,即OCT的结构信号。然后将激光散斑提取血管结构的方法应用于OCT,利用文献[ 11]提及的调制深度作为成像参数:
式中
以得到每个像素点的调制深度。由于成像区域内有移动颗粒,造成散斑频谱内动态散斑的成分高于没有移动颗粒的成像区域。通过应用调制深度这一参数,可以突出成像范围内的动态区域,其中
3 实验方法及结果
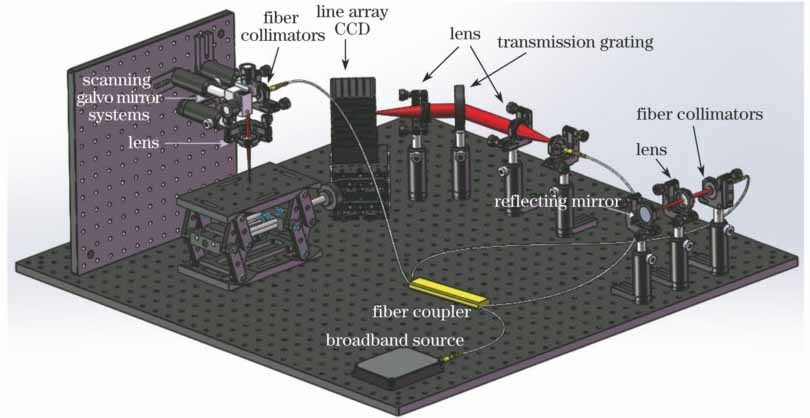
用仿体实验验证上述理论。在硅胶软管(内径为0.5 mm,外径为1 mm)中注入稀释的牛奶溶液,然后将软管嵌入含TiO2的琼脂中,通过注射泵控制硅胶软管中的牛奶溶液流动。
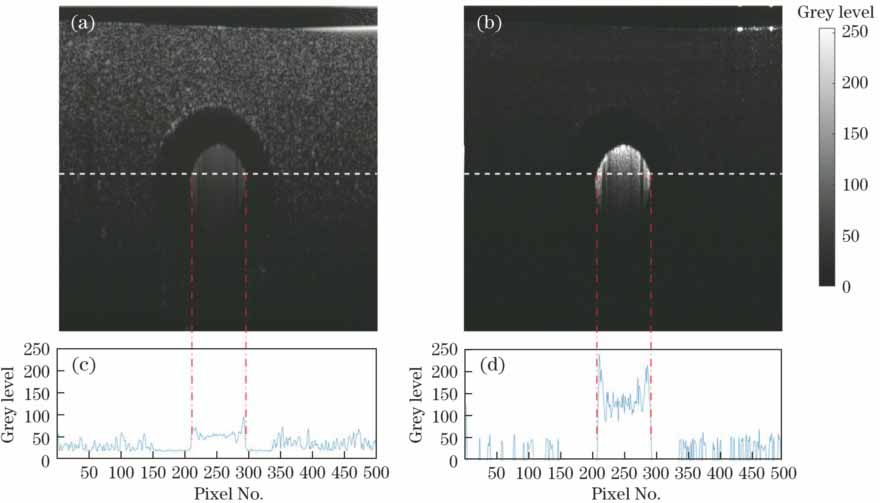
图 4. 仿体实验结果。(a)原始OCT截面图;(b)调制深度;(c)图4(a)虚线处强度曲线;(d)图4(b)虚线处强度曲线
Fig. 4. Results of phantom experiment. (a) Cross section of raw OCT image; (b) cross section of modulation depth; (c) intensity curve corresponding to the dashed line in Fig. 4(a); (d) intensity curve corresponding to the dashed line in Fig. 4(b)
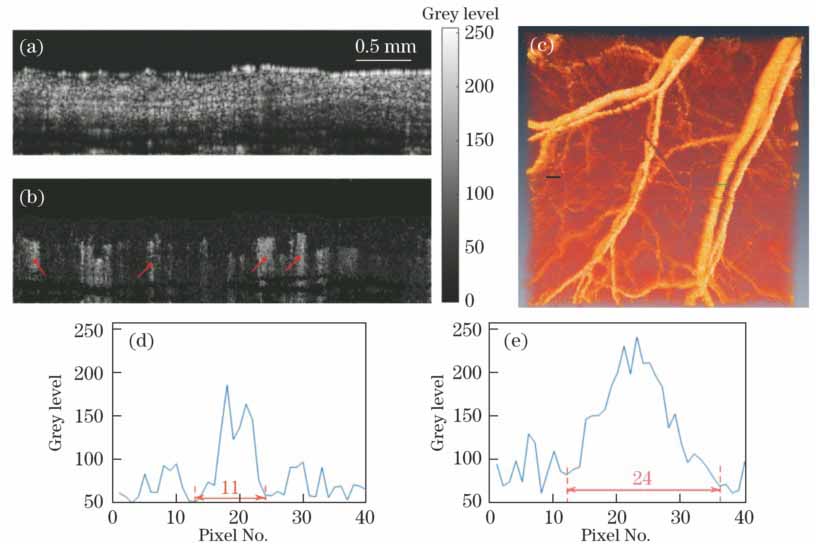
图 5. 生物实验结果。(a)鼠耳原始OCT截面图;(b)鼠耳调制深度截面;(c)鼠耳三维血管图;(d)图5(c)黑色实线处强度曲线;(e)图5(c)绿色实线处强度曲线
Fig. 5. Results of biological experiment. (a) Cross section of raw OCT image of mouse ear; (b) cross section of modulation depth of mouse ear; (c) three-dimensional vascular figure of mouse ear; (d) intensity curve corresponding to black solid line in Fig. 5(c); (e) intensity curve corresponding to green solid line in Fig. 5(c)
仿体实验结果证明散斑方法可以应用于OCT。该方法也可以应用于活体生物的组织成像,分别提取动态散斑和静态散斑,然后再用调制深度构建图像。
4 结论
在OCT技术中引入激光散斑的成像方法,提出了一种基于OCT散斑信号的三维血管造影技术,用OCT图像中动态散斑和静态散斑信号的比值表征生物结构的血管区域。仿体实验中,硅胶软管中牛奶流动区域从周围含有TiO2的琼脂中被高亮凸显,进一步验证了用调制深度表征的图像可以提取生物组织中的血管结构。但在血管造影图像中血管区域存在拖尾现象。与基于相位获取血管结构的方法相比,该方法可以有效避免相位不稳定的干扰和生物组织光学不均匀性的影响。
[1] 刘景宇, 张春雨, 唐晓英, 等. OCT内窥镜的研究现状与展望[J]. 激光与光电子学进展, 2015, 52(10): 100006.
刘景宇, 张春雨, 唐晓英, 等. OCT内窥镜的研究现状与展望[J]. 激光与光电子学进展, 2015, 52(10): 100006.
刘景宇, 张春雨, 唐晓英, 等. OCT内窥镜的研究现状与展望[J]. 激光与光电子学进展, 2015, 52(10): 100006.
[2] 付磊, 苏亚, 李果华, 等. 广义极大似然估计在OCT无创血糖监测中的应用[J]. 激光与光电子学进展, 2016, 53(3): 031701.
付磊, 苏亚, 李果华, 等. 广义极大似然估计在OCT无创血糖监测中的应用[J]. 激光与光电子学进展, 2016, 53(3): 031701.
付磊, 苏亚, 李果华, 等. 广义极大似然估计在OCT无创血糖监测中的应用[J]. 激光与光电子学进展, 2016, 53(3): 031701.
陈俊波, 曾亚光, 袁治灵, 唐志列. 基于动态散斑的光学相干层析成像技术[J]. 光学学报, 2018, 38(1): 0111001. Junbo Chen, Yaguang Zeng, Zhiling Yuan, Zhilie Tang. Optical Coherence Tomography Based on Dynamic Speckle[J]. Acta Optica Sinica, 2018, 38(1): 0111001.