定量干涉显微流式细胞仪的研究与设计  下载: 1138次
下载: 1138次
1 引言
在生物医学领域,细胞参数的测量与统计具有重要的研究意义和价值。对大量的细胞参数进行测量与统计,是定量分析与评估细胞物理形态、生命特征的基础,可为生物研究、医学诊断提供重要的参考依据。目前,一般采用流式细胞仪对大量的细胞参数进行测量与统计,其主要是通过荧光强度来实现细胞中特定物质含量的测量。然而,流式细胞仪是一种零分辨率的测量装置,它无法对细胞进行成像,故而无法直观地分析更多的细胞细节信息。细胞的直观形态特征是了解细胞状态的直观参量,如通过对血红细胞形貌的判断,可以实现糖尿病、疟疾和地中海贫血的定量诊断,因此将细胞成像引入到大量细胞参数的测量与统计中具有重要价值与意义[1-3]。传统的显微测量工具仅能对细胞的轮廓进行观察,而且由于细胞通常对可见光的吸收较小,因此其成像的对比度不明显。虽然相衬显微、微分干涉相衬显微等技术可以有效地对非染色的相位物体实现高对比度清晰成像,但仍无法获取物体的定量相位分布[4]。另外,受显微成像视场的限制,上述技术单次观察的采样细胞数量较少,难以满足统计的需求。因此,探索和设计一种可以定量测量细胞形状参数,并且能够对大量细胞实现测量与统计的成像系统具有重要意义。
国际上许多研究组针对这一需求开展了一系列研究。Greenbaum等[5]基于无透镜数字全息技术对大量细胞实现了定量观测。该系统的优势是可以对极大视场内的细胞实现快速测量,并进行统计,而且无需对样品进行扫描。然而该方法对样品的放大率有限,这会丢失较多的样品细节信息。为了实现对大量细胞进行测量,同时又能够获取更丰富的细节信息,研究人员先后开发了一系列新颖的细胞扫描方式,如:Ramachandraiah等[6]设计了基于数字化视频光盘(DVD)播放器的细胞大通量扫描检测系统,该系统采用传统的DVD读写头对加载在DVD上的细胞进行成像;Mir等[7]同样借助DVD旋转扫描,并结合干涉测量的方式获得了细胞的定量相位分布。这些系统可以被称为DVD上的实验室。这一类扫描可以归类于机械扫描,该扫描方法的优势是扫描精度可控,并且能够保证样品在同一焦面上成像;不过其缺点也显而易见,即需要结构复杂的机械扫描系统进行控制。另外,其扫面速度通常较慢,难以实现对大量细胞的快速扫描成像。di Caprio等[8-9]设计的生物光学检测系统可以自动识别大量样品的生物信息,并追踪样品的三维轨迹。Rappaz等[10-11]设计了一种精巧的设备,该设备可以快速检测大量血细胞。近些年来,芯片实验室得到了广泛关注与研究,结合芯片实验室的概念,再结合光学微流,可以对流动的大量生物细胞进行扫描成像[12]。Cui等[13-14]基于光学微流装置的芯片实验室,结合微孔阵列,实现了生物细胞的超高分辨率成像。Schonbrun等[15-18]结合荧光和细胞的吸收特性,利用光学微流装置实现了生物细胞的多模式成像。相较于机械扫描,使用光学微流对细胞实现视场扫描的装置更简单,也较容易实现;但该扫描方式难以保持细胞的稳定状态,仅能用于细胞的瞬态成像与测量。
为了实现大量细胞的成像与分析,本课题将定量干涉显微与扫描相结合设计了细胞测量统计装置,该装置基于定量干涉显微系统,为离轴干涉,可以记录被测样品的相位分布,并可将其反映于干涉条纹中。使用相位恢复方法可以从干涉图中获取被测样品的真实相位分布[19-21]。本文分别介绍了本课题组所设计的3种基于视场扫描的定量干涉显微流式细胞仪:基于扩展主程序分析相位恢复算法的定量干涉显微流式细胞仪、基于正则化光学流场相位恢复算法的定量干涉显微流式细胞仪以及重力驱动的定量干涉显微流式细胞仪。这一系列定量干涉显微流式细胞仪分别基于机械扫描和微流扫描实现对大量细胞定量相位的测量,并且根据测量的相位分布,再结合细胞识别与统计,还能够对单个细胞的相位面积、相位体积、圆率和血红蛋白含量等一系列参数进行测量[22]。第2~4节分别对应介绍了基于扩展主程序分析相位恢复算法、基于正则化光学流场相位恢复算法和重力驱动的定量干涉显微流式细胞仪,并采用这3种定量干涉显微流式细胞仪对大量血红细胞的参数进行了测量。最后,总结了这3种定量干涉显微流式细胞仪的特点和适宜的应用场合。
2 基于扩展主程序分析相位恢复算法的定量干涉显微流式细胞仪
定量干涉显微流式细胞仪结合了离轴干涉技术和显微技术,可以实现对被测样品的放大和相位记录。然而,因受到显微物镜视场的限制,其视场较小,仅能在视场中观察到个别血红细胞。因此,这里使用视场扫描的方法来扩大测量范围,从而获取更多的被测样品的定量信息。视场扫描的示意图如
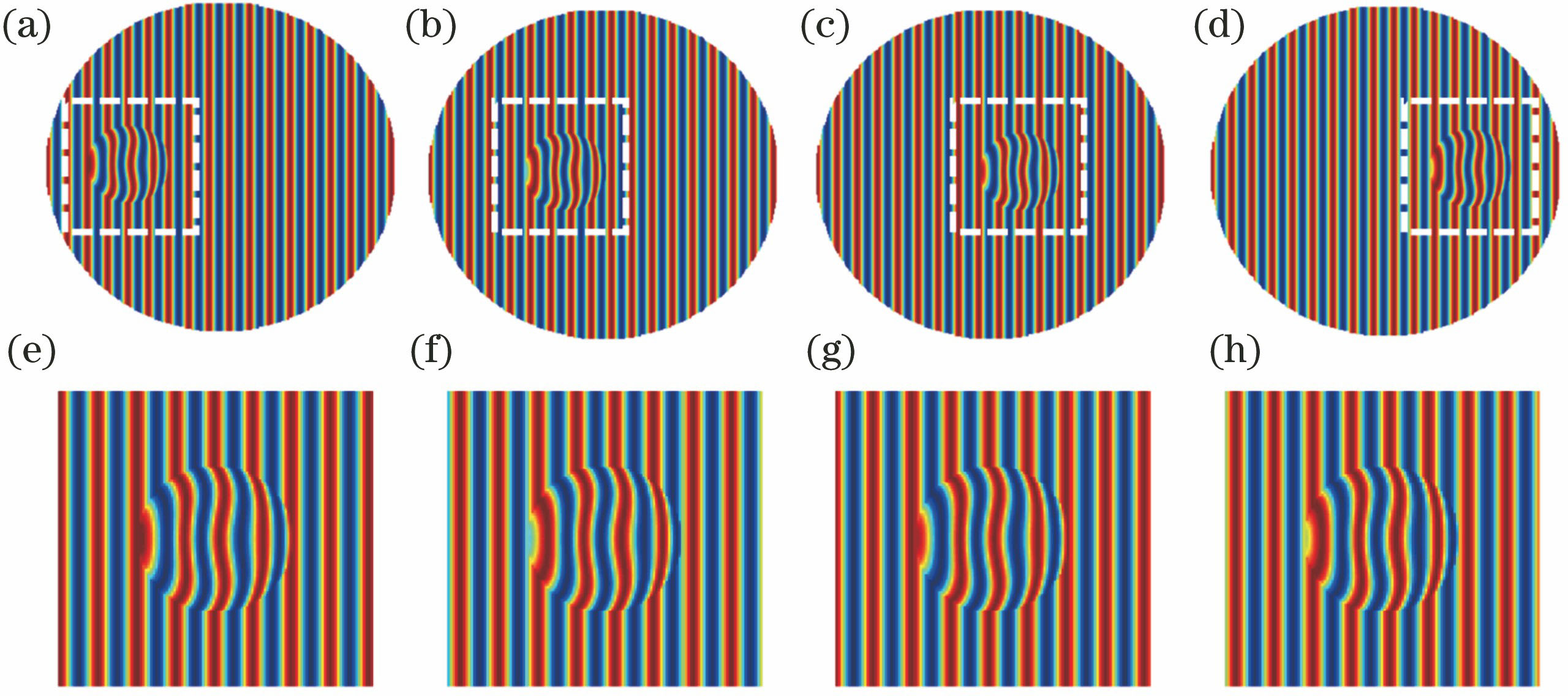
图 1. (a)~(d)视场扫描时不同位置上的血红细胞;(e)~(h)对应(a)~(d)中白色虚线框中的亚视场干涉图
Fig. 1. (a)-(d) Red blood cells at different positions during field of view scanning; (e)-(h) interferograms in sub-field of view corresponding to those in dashed boxes of (a)-(d)
在
式中:
式中:
当对含有血红细胞的样品在显微物镜的焦面处进行扫描时,在不同的时刻,血红细胞处于不同的位置,如
基于移相相位的恢复解法一般无需时域频域转换,因此不涉及频谱泄漏等基于快速傅里叶变换相位恢复等传统算法的弊端,而且其实现简单,计算方便。然而其劣势是通常需要对多张干涉图进行相位求解。这里,使用具有较高采集速率的电荷耦合器件(CCD)摄像机,结合视场扫描可以很容易地获取如
离轴干涉图的表达式为
式中:
将多幅消除背景的移相干涉图的行向量按照列组合形成矩阵,即
该矩阵的协方差矩阵为
将该协方差矩阵对角化得到
式中:
式中:矩阵
得到正交特征值之后,带有包裹的相位便可以通过反正切函数求得:
再综合使用相位解包算法便可以获取亚视场内的定量相位分布。更为详细的算法原理与步骤可参见参考文献[ 19,24-25]。
根据扩展主程序分析相位恢复算法可以由亚视场干涉图求解其对应的定量相位分布,结果如

图 2. 血红细胞模型定量相位分布。(a)根据(2)式得到的血红细胞模型定量相位分布;(b)传统的基于快速傅里叶变换相位恢复算法得到的血红细胞模型定量相位分布;(c)传统的基于希尔伯特变换相位恢复算法得到的血红细胞模型定量相位分布;(d)根据扩展主程序分析相位恢复算法得到的血红细胞模型定量相位分布;(e)含有噪声的干涉图;(f)噪声情况下,根据扩展主程序分析相位恢复算法得到的血红细胞模型定量相位分布
Fig. 2. Quantitative phase distributions of red blood cell model. (a) Quantitative phase distribution of red blood cell model obtained according to equation (2); (b) quantitative phase distribution recovered by traditional phase retrieval algorithm based on fast Fourier transform; (c) quantitative phase distribution recovered by traditional phase retrieval algorithm based on Hilbert transform; (d) quantitative phase distribution recovered by expanded principle component analysis phase retrieval algorith

图 3. 基于机械扫描的定量干涉显微流式细胞仪
Fig. 3. Scheme of quantitative interferometric microscopic cytometer based on mechanic field of view scanning

图 4. (a)基于扩展主程序分析相位恢复算法的定量干涉显微流式细胞仪采集的干涉图;(b)相位恢复后的血红细胞定量相位分布
Fig. 4. (a) Interferograms captured by quantitative interferometric microscopic cytometer with phase retrieval algorithm based on expanded principle component analysis; (b) quantitative phase distribution of red blood cell after phase retrieval
实验中采用健康兔子的血红细胞作为样品(样品由江苏省农业科学院提供)。全血样品经过多次离心后去除白细胞和血小板成分,得到的血红细胞作为被测样品置于由两片盖玻片制作的样品室中,使用质量分数为0.9%的生理盐水作为折射率液,以保证细胞的活性。
3 基于正则化光学流场相位恢复算法的定量干涉显微流式细胞仪
基于扩展主程序分析相位恢复算法的定量干涉显微流式细胞仪虽然能够较好地恢复细胞的定量相位分布,但其受限于机械扫描速率而难以对大范围样品实现快速扫描成像。为了实现对生物样品的快速大通量成像检测,这里在以上研究的基础上对相位恢复算法进行改进,仅使用两幅干涉图便能恢复出被测样品的定量相位分布。该算法实际上是改进的基于二维希尔伯特变换的相位恢复算法,不仅与传统的希尔伯特变换算法一样保留了更加丰富的样品细节信息,同时还考虑了干涉条纹的弯曲方向角,从而克服了传统的基于希尔伯特变换的相位恢复算法仅局限于一维信号处理的弊端。该算法的核心原理是二维希尔伯特变换,即
式中:F和F-1分别为快速傅里叶变换及其逆变换;
传统的基于一维希尔伯特变换的相位恢复算法忽略了干涉图条纹角度,认为其值为0,而在基于一维希尔伯特变换的相位恢复算法中,考虑了这一项对相位恢复的影响。
基于采集到的干涉图通过简单的均值计算可以消去多幅亚视场干涉图的零频分量,从而可以获取其余弦调制分量
这里,采用基于正则化光学流场相位恢复算法求解该条纹角度,与

图 5. (a)(b)视场扫描时在不同位置的血红细胞;(c)(d)对应(a)(b)中白色虚线的亚视场干涉图;(e)基于正则化光学流场相位恢复算法得到的被测样品相位;(f)噪声情况下,基于正则化光学流场相位恢复算法得到的血红细胞模型定量相位分布
Fig. 5. (a)(b) Red blood cells at different positions during field of view scanning; (c)(d) interferograms in sub-field of view corresponding to those in dashed boxes of (a) and (b); (e) phase of measured sample recovered by phase retrieval algorithm based on regularized optical flowing; (f) quantitative phase distribution of red blood cell model recovered by phase retrieval algorithm based on regularized optical flowing with noise
同样,使用

图 6. (a)基于正则化光学流场相位恢复算法的定量干涉显微流式细胞仪的操作步骤;(b)同一批次血红细胞的微分干涉相衬显微结果;(c)~(e)基于正则化光学流场相位恢复算法计算得到的被测样品的定量相位分布
Fig. 6. (a) Processing steps of quantitative interferometric microscopic cytometer with phase retrieval algorithm based on regularized optical flowing; (b) the same batch of red blood cells at differential interferometric contrast microscopy; (c)-(e) quantitative phase distributions of the measured sample recovered by phase retrieval algorithm based on regularized optical flowing
从实验结果可以看出,基于正则化光学流场相位恢复算法的定量干涉显微流式细胞仪可以很好地恢复被测样品的定量相位分布,而且相较于基于扩展主程序分析相位恢复算法的定量干涉显微流式细胞仪,其所需信息量更少,有效缩短了扫描时间,提高了扫描精度。同样扫描0.5 cm×0.5 cm的视场,其仅需要约100 s(15次独立实验数据的平均值)。不过,其依旧受到机械扫描速率的制约,难以实现更加快速的扫描成像。
4 重力驱动的定量干涉显微流式细胞仪
以上所介绍的两种定量干涉显微流式细胞仪皆是基于机械扫描,该方式的优势是可以保持扫描过程中被测样品的稳定,并且样品室固定在显微物镜的焦平面上,可以获得更高的放大倍率和成像效果。然而,使用机械扫描的定量干涉显微流式细胞仪明显受限于步进电机的扫描速率。此外,电机的振动同样会给干涉系统带来噪声。为了进一步提高定量干涉显微流式细胞仪的扫描效率,本课题组改进了原有的扫描成像光路,如
由于血红细胞呈扁平状,在重力作用下,其在样品室中的流动会带有自身的转动。因此,为了实现对血红细胞高通量快速相位成像,选择基于单幅离轴干涉图的相位恢复算法。综合考虑计算速率与信噪比,这里选择传统的基于快速傅里叶变换的相位恢复算法对干涉图进行处理,实现对血红细胞样品的定量相位成像。这样做虽然牺牲了相位恢复的计算精度,但该算法保证了较高的采集效率和信噪比。实现重力驱动定量干涉显微流式细胞仪的流程如
运用该重力驱动的扫描成像系统对大量血红细胞样品进行信号采集与相位测量,被测样品仍是按照标准处理程序处理过的兔子血红细胞。

图 7. 重力驱动定量干涉显微流式细胞仪示意图
Fig. 7. Schematic of gravity-driven quantitative interferometric microscopic cytometer

图 8. 重力驱动的定量干涉显微流式细胞仪实现细胞大通量高速检测的流程
Fig. 8. Procedure of high-throughput and high-speed cell detection with gravity-driven quantitative interferometric microscopic cytometer

图 9. (a)微分干涉相衬显微镜下的同批次血红细胞样品;(b)~(f)重力驱动的定量干涉显微流式细胞仪得到的不同血红细胞定量相位分布
Fig. 9. (a) Same batch of red blood cell samples at differential interferometric contrast microscopy; (b)-(f) quantitative phase distributions of different red blood cells obtained by gravity-driven quantitative interferometric microscopic cytometer
另外,相较于之前介绍的基于机械扫描的定量干涉显微流式细胞仪,重力驱动的扫描成像系统实验光路更为简单紧凑,无需光路折转与步进电机扫描。此外,该系统还避免了由步进电机振动而造成的噪声污染。更为重要的是,重力驱动的定量干涉显微流式细胞仪具有更高的扫描速率。该系统仅需80 s便可捕捉到超过100个血红细胞样品,若是提高流动的血红细胞浓度,还能够进一步提高测量效率。
5 各类定量干涉显微流式细胞仪的分析与比较
将定量干涉显微与样品扫描相结合,其主要目的是实现对大量被测生物样品的统计与分析。这类定量干涉显微流式细胞仪与传统基于荧光或散射强度分析的流式细胞仪不同,前者是基于被测样品定量干涉相位分布来实现对样品各类参数的分析。这里,使用定量干涉流式细胞仪对兔子血红细胞进行测量与统计,主要对以下参数进行测量与分析。
1) 相位面积
相位面积等效于血红细胞所占的面积,反映了血红细胞的尺寸、直径等定量信息,表达式为
式中:
2) 相位体积
相位体积为血红细胞折射率与外界折射率液差值导致的相位差值的积分,即定量干涉相位分布
相位体积可以定量反映生物样品的形貌与体积。尤其是对于血红细胞而言,其折射率分布均匀,因此相位体积能够精确地反映血红细胞的体积信息。
3) 细胞形态参数
细胞形态参数包括等效直径
细胞周长对应血红细胞轮廓线的面积,最大、最小直径则是血红细胞最大与最小的直径长度,偏心率可以由其最大、最小直径得出:
偏心率的范围在0到1之间,偏心量越接近0,说明细胞形状越趋近于圆,否则越趋近于椭圆。同偏心率一样,圆率也可以用来描述细胞形状与正圆的趋近度,表达式为
4) 平均红细胞血红蛋白
血红细胞主要由血红蛋白组成,平均红细胞血红蛋白可由血红细胞的定量相位分布计算得到
式中:
基于定量干涉显微流式细胞仪先后对多批血红细胞进行了扫描成像与测量,其主要结果如
使用定量干涉显微流式细胞仪得到181个有效被测血红细胞,其相位面积与相位体积的关系如

图 10. 被测血红细胞参数。(a)相位体积和相位面积(红线代表线性拟合结果);(b)圆率和偏心率
Fig. 10. Parameters of measured red blood cells. (a) Phase volume and phase area (red line indicating linear fitting result); (b) circle-ratio and eccentricity
表 1. 不同定量干涉显微流式细胞仪的对比
Table 1. Comparison among different quantitative interferometric microscopic cytometers
|
6 结论
为了实现对大量生物样品快速高通量的定量相位成像及后续分析,结合定量干涉显微技术与视场扫描,设计了定量干涉显微流式细胞仪系统。该系统不仅能够对诸如血红细胞等生物样品实现定量成像,还能通过细胞识别实现对一系列细胞参数的测量,如相位面积、相位体积、圆率、离心率、平均红细胞血红蛋白等。结合不同的视场扫描和相位恢复方法,先后设计了基于扩展主程序分析相位恢复算法、基于正则化光学流场相位恢复算法和重力驱动的定量干涉显微流式细胞仪。在不同检测速度和精度的要求下,可以选择合适的测量系统对大量被测样品进行成像与测量。所设计的定量干涉显微流式细胞仪可以对生物样品进行大通量的高速测量、识别与统计,并可以精确地反映血红细胞的各项参数,从而为病理诊断、生物研究提供合理且具有参考意义的实验数据。
致谢 感谢意大利国家研究委员会应用科学与智能系统研究所Pietro Ferraro教授在重力驱动定量干涉显微流式细胞仪工作方面的帮助,感谢西班牙国家研究委员会Javier Vargas博士在正则化光学流场算法方面的指导,感谢南京农业大学单分子与纳米技术实验室刘斐教授以及实验室成员单衍可、徐明飞在血红细胞采集、微分干涉相衬显微成像方面的帮助。此外,实验装置三维结构图由中国科学院国家天文台南京天文光学技术研究所姜海娇博士根据实验装置设计,在此一并表示感谢。
[1] 杨萍, 魏丹, 庞恺, 等. 在体光声流式细胞术在循环肿瘤细胞检测中的研究进展[J]. 激光与光电子学进展, 2017, 54(9): 090001.
[2] 卜敏, 胡双双, 陶兆禾, 等. 白细胞对偏振光的散射特性及散射特性与细胞结构的关系[J]. 中国激光, 2017, 44(10): 1007001.
[3] 李灿, 郭帮辉, 孙竹. 多光谱消色差成像流式细胞仪的光学系统设计[J]. 光学学报, 2016, 36(9): 0922002.
[13] Cui X Q, Lee L M, Heng X, et al. Lensless high-resolution on-chip optofluidic microscopes for Caenorhabditis elegans and cell imaging[J]. Proceedings of the National Academy of Sciences, 2008, 105(31): 10670-10675.
Article Outline
闫克丁, 薛亮, 黄华川, 王绶玙. 定量干涉显微流式细胞仪的研究与设计[J]. 激光与光电子学进展, 2018, 55(12): 120901. Keding Yan, Liang Xue, Huachuan Huang, Shouyu Wang. Research and Design of Quantitative Interferometric Microscopic Cytometer[J]. Laser & Optoelectronics Progress, 2018, 55(12): 120901.






