肿瘤微环境响应的智能纳米载体在肿瘤光动力治疗中的应用  下载: 1645次特邀综述
下载: 1645次特邀综述
1 引言
光动力治疗(PDT)是基于微创的新型肿瘤治疗方法,已成为近年来癌症治疗的基础研究与临床转化的新热点。其原理是利用光敏剂(PS)吸收外源可见-近红外光(NIR)光能,自身由基态(So)转变为激发态(S1),再与周围氧分子(O2)反应,产生高活性激发态毒性光化学产物,如活性氧自由基(ROS),之后再与细胞内邻近的活性分子(如氨基酸、脂肪酸或核酸)等相互作用,导致直接的细胞毒性,诱导细胞凋亡或坏死[1]。此外,光动力治疗能激活机体的免疫反应,损伤肿瘤组织脉管系统,抑制新生血管,从而达到治疗肿瘤的目的[2]。与传统手术及放疗、化疗相比,光动力治疗具有微创可控、可重复、低免疫原性、低成本、局部高选择性等特点[3]。然而,肿瘤组织复杂的微环境导致光动力治疗效果较低、预后效果差,阻碍了光动力治疗的临床应用。肿瘤微环境的产生原因在于肿瘤细胞生长失控,基因表达异常,导致肿瘤组织异于正常组织的生理结构与代谢特征,如肿瘤组织细胞内外的氧化还原性差异、pH差异、肿瘤组织间质特定酶的代谢、肿瘤细胞的过快增殖以及血管畸形导致的肿瘤组织内部乏氧等[4-5]。随着纳米技术与生物医学工程等交叉学科的不断发展,以及对肿瘤微环境机制的不断探索,基于肿瘤微环境因子设计的智能响应性纳米载体系统能有效利用肿瘤微环境异于正常组织细胞的因素,选择性地对肿瘤细胞给药,遏制肿瘤的产生、发展。因此针对肿瘤微环境因子设计的纳米载体已成为近年来改善光动力治疗的研究热点,具有一定的临床转化应用意义。基于此,本文针对不同的肿瘤微环境响应因子与纳米载体系统在肿瘤光动力治疗中的最新研究进展进行综述,为纳米技术在肿瘤光动力治疗方面的应用提供参考和新的研究思路。
2 肿瘤微环境响应的智能纳米载体
恶性肿瘤是严重威胁人类健康和生命安全的一大疾患,其中实体肿瘤占人类肿瘤的90%以上。尽管目前癌症的治疗仍以手术切除为主,辅以放疗、化疗等综合治疗,并获得了良好的治疗效果,但多种实体瘤的预后效果差[6],其原因可能是实体肿瘤存在的肿瘤微环境。肿瘤微环境是由肿瘤组织、免疫细胞、肿瘤细胞自身代谢及其分泌的活性物质等构成的,其对于肿瘤的产生、发展、转移及药物耐受等具有重要影响;同时,肿瘤微环境为肿瘤细胞的快速增殖与转移提供了理想的场所。因此,对肿瘤微环境的深入研究,能够有效改善传统药物递送效果差、选择性不高、治疗效果不理想等问题。此外,由肿瘤细胞生长失控、代谢异常、基因表达异常等生理过程导致的异于正常组织细胞的特征,可作为新的肿瘤靶标用于选择性给药,以提高药物疗效,同时降低传统药物对健康机体产生的毒副作用。随着纳米技术与生物医学工程等交叉学科的发展,利用肿瘤微环境因素设计的智能纳米载体用于肿瘤的临床研究与协同治疗已成为可能。通过合理设计可显著提高其对肿瘤的选择性,减少毒副作用。
2.1 pH响应的智能化纳米载体
在肿瘤组织中,由于肿瘤细胞的增殖速度较正常细胞快,其脉管系统提供的营养物质及血氧含量不能满足其生长所需,导致肿瘤组织内部供养不足,促使肿瘤细胞发生无氧糖酵解作用以提供其生长所需能量,但同时会产生大量乳酸及三磷酸腺苷(ATP)水解产物,并释放到胞外,从而导致肿瘤部位的酸性增加,pH较正常组织部位低。人体正常组织细胞与肿瘤细胞内的pH约为7.4,而肿瘤组织区域的pH为6.0~7.0,低于正常组织的pH,正常组织细胞内溶酶体的pH为 5.0~6.5,肿瘤细胞内溶酶体的pH为4.0~5.0[7]。与此同时,由于肿瘤细胞快速无序增殖,导致血管内皮细胞增殖异常,内皮间隙较大,周细胞缺乏以及基底膜异常等,进而导致血管的通透性增强,促使血液循环中的物质渗透进肿瘤组织并滞留其中,产生高渗透长滞留(EPR)效应[8]。而基于pH敏感的纳米药物载体将药物封闭于载体内部,在正常组织细胞间隙中药物不释放或微量释放,降低了传统给药方式对正常细胞的无差别损伤;当纳米药物载体利用EPR效应进入肿瘤组织区域后,由于较低的pH微环境会诱导其纳米结构发生改变,释放出药物(如光敏剂),从而提高了肿瘤组织区域及细胞内的药物含量,改善肿瘤的治疗效果,同时降低了对正常细胞的损伤。基于此方法,Liu等[9]将阳离子二苯丙氨酸(H-Phe-Phe-NH2·HCl,CDP)、二肽9-芴基甲氧基羰基-1-赖氨酸(Fmoc-1-Lys)与二氢卟吩(Ce6)混合,通过静电作用力、π-π堆叠力以及疏水作用力等,制备出了纳米尺度均一、对pH敏感的二肽杂化纳米颗粒(FCNPs)(如
这种由二肽和光敏剂相互作用自组装的载体,通过改变光敏剂与二肽的含量或反应时间,可调节载体尺寸;同时通过静电力、π键堆叠作用、疏水作用等来负载药物,具有通用性强、负载效率高的特点。利用肿瘤的弱酸性环境破坏载体与光敏剂间的作用力,控制光敏剂释放,实现智能给药。
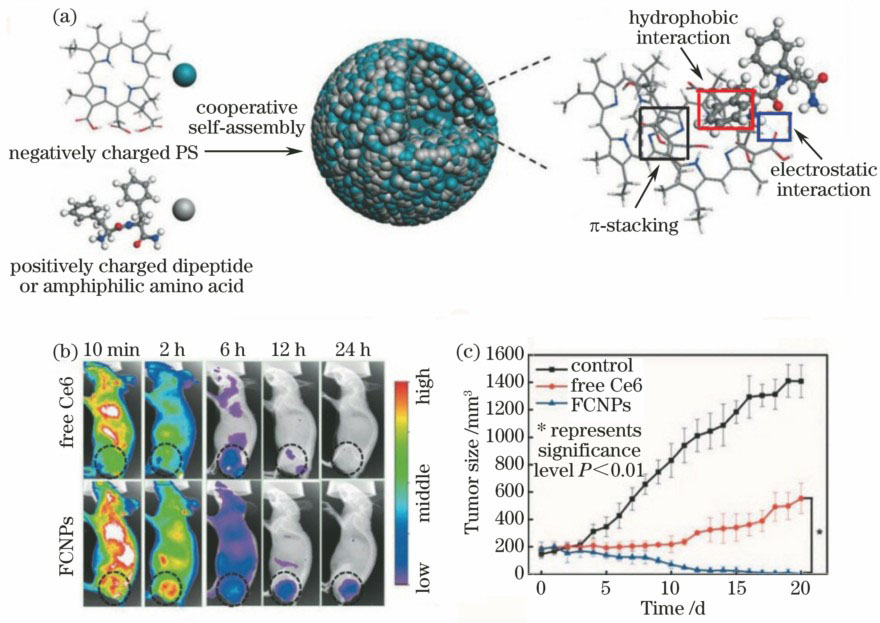
图 1. (a)通过两亲性二肽或氨基酸调节的自组装制备光敏纳米颗粒;(b)通过尾静脉注射FCNPs和游离Ce6(相当于每千克FCNs中含有4.0 mg Ce6)的MCF7-荷瘤裸鼠在不同时间的全身荧光图像,黑色圆圈表示肿瘤部位;(c)测量肿瘤生长20 d的大小(每组小鼠数量n=4)
Fig. 1. (a) Fabrication of photosensitive nanoparticles by amphiphilic dipeptide- or amino-acid- tuned self-assembly; (b) whole body fluorescence images of MCF7-tumor-bearing nude mice intravenously injected through a tail vein with FCNPs and free Ce6 (equivalent to 4.0 mg Ce6 per kilogram FCNs) at different times, black circles indicate tumor sites; (c) measured tumor size for 20 days growth (the number of mice in each group n=4)
5-氨基乙酰丙酸(5-ALA)是光敏剂原卟啉IX(PpIX)的前体,因具有无毒、体内代谢快等优点而被广泛使用[10]。5-ALA可通过细胞内血红素生物合成途径转化为PpIX,而内生的PpIX不仅可以用于癌症的诊断及荧光成像,还可作为一种有效的光敏剂用于癌细胞的选择性杀伤。然而,5-ALA难以透过细胞膜进入细胞,并且选择性差[11-12]。因此,需要一种药物载体协助5-ALA绕过亲脂性屏障直接进入肿瘤细胞中,用于肿瘤的光动力治疗。大多数研究利用静电力将5-ALA负载于纳米载体表面,但是这种方式的非共价键作用力较弱,容易引起5-ALA在体内输送过程中过早释放,影响光动力治疗效果[13]。为此,Tong等[14]设计了一种pH双重响应的纳米载体,并将其用于肿瘤的选择性光动力治疗(如

图 2. 用于光动力治疗的ALA准聚轮烷前药胶束示意图
Fig. 2. Schematic of ALA pseudopolyrotaxane prodrug micelles for photodynamic therapy
2.2 还原响应的智能化纳米载体
肿瘤组织中普遍存在的乏氧环境导致肿瘤细胞内部的谷胱甘肽(GSH)含量升高,其浓度大约是正常细胞内GSH的4倍[18]。在生理条件下,GSH浓度较低,不足以断裂二硫键,纳米载体可稳定存在,当纳米载体进入肿瘤细胞后,促使纳米药物的结构在肿瘤细胞内的较高还原性环境下发生变化,化学键断裂而释放药物,实现肿瘤的选择性治疗。其中,细胞内的GSH、二价铁离子、半胱氨酸、溶酶体硫醇还原酶(GILT)等均具有还原性,可作为还原响应纳米药物载体的刺激因子[19],利用其设计还原敏感的纳米药物载体。具备还原性敏感的化学键包括二硒键[20-21]、二硫键[22-24]、琥珀酰亚胺-硫醚键[25]等。
McFarland公司研制的钌(II)络合物TLD-1433已进入I期临床试验,其在光动力治疗中表现出了具大的潜力[26]。但钌聚吡啶复合物细胞的摄取率低,阻碍了其临床应用。Wang等[27]合成了一种钌络合物-靶向肽共轭复合物Ru-SST8,如
为了提高光动力治疗疗效,将其与化疗联合的肿瘤微环境响应纳米载体也被广泛研究。张文佳等[32]制备了一种新型还原性响应纳米载体ICG@

图 3. (a)通过二硫化物重新桥接和生物偶联合成试剂6(叠氮双砜);(b) SST的功能化以获得Ru-SST缀合物8(Ru-SST8)
Fig. 3. (a) Synthesis of the disulfide rebridging and bioconjugation reagent 6 (azide double sulfone); (b) functionalization of SST to receive Ru-SST conjugate 8 (Ru-SST8)
PEG-b-PCPTM,并将其用于肿瘤的选择性光动力协同化学治疗。其利用两步法合成两亲性喜树碱聚前药分子PEG45-b-PCPTM18,再通过“自下而上”自组装,同时负载疏水性光敏剂吲哚箐绿(ICG),形成了具有还原敏感的喜树碱聚前药两亲分子-光敏纳米药物(ICG@PEG-b-PCPTM)。在还原性GSH作用下,释放出化疗药物喜树碱;同时,释放出光敏剂ICG用于光动力治疗,实现化疗与光动力的联合治疗,表现出良好的肿瘤抑制效果。
2.3 酶敏感的智能化纳米载体
在肿瘤组织细胞中存在各种生物酶,如基质金属蛋白酶、水解酶、蛋白酶、脂肪酶、糖苷酶等,这些酶在不同生理过程中发挥着重要作用[33]。随着肿瘤的产生、发展及某些生物酶基因的异常高表达,一些酶的活性会发生改变[34]。因此,可利用正常组织与肿瘤组织内酶的种类及其表达差异,制备具有酶响应的纳米药物载体,用于光动力治疗[35]。Jang等[36] 通过多肽两端将光敏剂与金纳米棒偶联,该多肽可被金属蛋白酶(MMP2)切割,制备得到MMP2P-GNR复合物(如

图 4. 使用酶活化的光敏剂-金纳米棒共轭物(MMP2P-GNR)荧光成像和光动力疗法的概念图
Fig. 4. A concept of enzyme activatable fluorescence imaging and photodynamic therapy using a photosensitizer-conjugated gold nanorod (MMP2P-GNR)
2.4 H2O2响应的智能纳米载体
在肿瘤组织中,癌细胞线粒体呼吸链或细胞膜NADPH 氧化酶形成的超氧阴离子及过氧化物酶体增殖物激动剂活化增殖物激活受体(PPARα)引起酯酰辅酶A氧化酶转录水平增加,导致H2O2在细胞膜、线粒体、过氧化物酶体多位点产生,使肿瘤细胞内的H2O2高于正常细胞[40-41]。Zhang等[42]利用苯基介孔二氧化硅(APMs)包埋金纳米棒(AuNR)形成核-壳型纳米结构(如

图 5. APMECR@MB NCs逐步组装的简化过程及其协同光动力治疗/光热治疗作用的机制
Fig. 5. Simplified representation of a stepwise assembly process of final APMECR@MB NCs and the synergistic PDT/PTT mechanism of their action
作用及π堆叠作用负载于APMs,形成APME@MB纳米结构。其中,MB为光敏剂,其单线态氧产率较高。通过比较紫外光谱可知,MB分子在APM介孔内形成了二聚体,提高了MB的稳定性。过氧化氢酶与APME@MB表面的氨基交联作为堵孔剂,防止[Eu(HTHA)3(phen)]与MB泄漏,维持APM的稳定性。为了提高APMEC@MB的靶向作用,在APMEC @MB表面修饰靶向环肽(cRGD)。当APMECRs@MB进入肿瘤组织后,肿瘤细胞产生的内源性H2O2能清除堵塞APM介孔的过氧化氢酶,促进[Eu(HTHA)3(phen)]和MB释放。在808 nm近红外光照射下,[Eu(HTHA)3(phen)]络合物通过发光共振能量转移(LRET)效应激活光敏剂MB,产生ROS。内源性H2O2与APMECR@MB的过氧化氢酶反应生成O2,可进一步提高APMECRs@MB对肿瘤细胞的光动力治疗效果。与传统的纳米载体相比,此纳米载体除了具有多孔结构,能负载大量药物外,还有以下几点优势:1) APM的介孔通道具有超疏水性,可改善负载药物的生物稳定性,用过氧化氢酶包被的APM能抑制MB过早泄漏,并且改善MB的水溶性;2) Eu3+络合物的发光特性导致能量长期转移到MB,进而激发MB的光动力效应,同时MB分子与Eu3+相互结合,促进了它们之间的LRET效应,使ROS生成增加;3) 肿瘤微环境中过量的H2O2与堵孔剂过氧化氢酶反应产生大量O2,改善氧依赖性光动力治疗对缺氧性肿瘤的疗效,同时促进MB的释放;4) cRGD连接在APMEC@MB表面,提高了纳米载体的靶向性。上述几种优点使光敏剂能在肿瘤细胞内智能性释放,实现选择性治疗。
2.5 核酸响应的智能纳米载体
为满足生长需要,肿瘤细胞内的某些蛋白质高表达会导致肿瘤细胞内的DNA或信使RNA(mRNA)转录水平提高。利用这一特征,设计了针对肿瘤细胞内特定DNA或mRNA序列的纳米药物载体系统,以实现药物选择性递送,提高治疗效果。Wu等[43]制备了以量子点为核心,通过修饰有光敏剂Ce6及猝灭基团BHQ3的分子信标,设计出了靶向mRNA刺激响应的光动力诊疗探针TMB(如

图 6. TMB示意图。(a)封闭和开放式TMB的FRET模式;(b)发夹DNA序列和每个FRET对的分离距离
Fig. 6. Schematic of TMB. (a) FRET mode of TMB in the closed and opened forms; (b) hairpin DNA sequence and the separation distance of each FRET pair
2.6 ROS响应的智能纳米载体
ROS是机体氧化应激时产生的主要分子,主要在线粒体呼吸链中产生,在生理和病理过程中都起着重要的作用。正常生理条件下,生物体内的ROS保持在较低的平衡水平,维持着细胞正常的生长凋亡,而肿瘤组织中的ROS水平高于正常细胞[44-45]。因此,可以利用肿瘤组织与正常细胞ROS的差异,设计ROS响应的纳米药物载体。目前,国内外已报道的ROS 敏感材料有聚丙烯-硫化物、含硒嵌段复合物、聚硫醚酮、脯氨酸低聚物、聚酮缩硫醇等[46]。Kim等[47]制备了巨噬细胞靶向纳米粒子MacTNP(如

图 7. 用于巨噬细胞靶向荧光成像和光动力学治疗的可激活的纳米材料示意图
Fig. 7. A schematic of activatable nano-photo medicine for macrophage-targeted fluorescence imaging and subsequent photodynamic therapy
Yue等[49]考虑到由光敏剂产生的ROS不仅能用于光动力疗法,而且能用于切割聚酮缩硫醇类物质释放药物,实现光动力治疗与化疗相结合。因此,他们制备出了一种多功能Ce6-CPT-UCNPs纳米载体(如

图 8. Ce6-CPT-UCNPs制备示意图以及光调节的ROS激活Ce6-CPT-UCNPs的原理
Fig. 8. Schematic illustration of the preparation of Ce6-CPT-UCNPs and concept of the light-regulated ROS-activated Ce6-CPT-UCNPs
2.7 多重响应的智能纳米载体
在抗肿瘤药物递送研究中,多重刺激响应型纳米药物载体系统(如pH-ROS双敏感、pH-GSH双敏感、ROS-MMP双敏感、pH-ROS-GSH多重敏感)等能提高光敏剂在肿瘤部位的靶向传递,并控制药物释放。何玉玲[50]设计了一种可以在肿瘤微环境中实现双响应的聚丙烯硫醚-聚乙烯亚胺-多肽-肝素(PPS-PEI-Peptide-HP)聚合物胶束。其中:PPS是活性氧响应的聚合物,在肿瘤细胞内高浓度的GSH条件下由疏水相转变成亲水相,促进药物释放;Peptide是具有MMP-2切割位点的多肽,肿瘤细胞内高表达的MMP-2能切割Peptide释放HP,脱落的HP和PEI电荷竞争导致DNA释放。PPS-PEI-Pe ptide-HP纳米胶束利用肿瘤细胞中高浓度的谷胱甘肽(GSH)和基质金属蛋白酶-2(MMP-2),通过其独特的相变和酶裂解行为, 能智能性地在肿瘤部位释放药物和基因。
此外,Zhang等[51]合成了一种GSH与pH双重响应的纳米诊疗探针AQ4N-Cu(II)-Apt Ce6-GNPs,如

图 9. AQ4N-Cu(II)-Apt Ce6-GNPs的制备及功能示意图
Fig. 9. Schematic of the preparation and functional principle of AQ4N-Cu(II)-Apt Ce6-GNPs
3 总结与展望
光动力治疗是新型的微创肿瘤光学治疗,其具有低免疫原性、低成本、局部选择性等特点,对肿瘤的治疗具有一定的指导意义,然而实体瘤内部的肿瘤微环境因素导致光动力治疗效果下降,阻碍了光动力治疗的临床发展及应用。近年来,基于肿瘤微环境响应的智能纳米药物载体系统,如pH响应型纳米载体、氧化还原响应型纳米载体、酶响应性型纳米载体、活性氧响应型纳米载体、mRNA型纳米载体、H2O2型纳米载体,能有效解决传统光敏剂在治疗过程中表现出的光敏剂活性低、对正常组织的光敏毒性高、药物血液半衰期短、疏水性、稳定性差、肿瘤选择性低等问题,有效地提高了肿瘤治疗的选择性及有效性。但智能响应的光动力纳米探针的发展仍然面临着一定问题,如组分复杂、结构稳定性差、非药物组分残留率高、代谢差、ROS产率低、激发波长短及治疗深度限制等。理想的光动力治疗纳米药物载体应符合以下标准:1)高药物负载效率;2)多重刺激响应,程序性、协同发挥治疗作用; 3)具有良好的主动靶向功能;4)具备诊断与治疗功能。在未来抗肿瘤药物递送的研究中,可通过提高近红外光激发波长,或利用上转换材料、双光子及X线激发等方式解决治疗深度等问题;也可利用携带氧气或产氧的物质进入肿瘤区域解决肿瘤乏氧问题,或利用乏氧化疗药物与光敏剂协同治疗,提高对肿瘤的抑制效果与选择性,充分发挥光动力治疗与其他治疗方式的协同效应;同时,利用多重刺激响应型纳米药物载体系统解决传统光敏剂在肿瘤靶向传递上的问题,为更加精准有效的肿瘤治疗提供新方向。
[1] 杨曼, 邢力允, 高卫栋, 等. 锌酞菁体外光动力学疗法体外抗肿瘤细胞量效关系[J]. 中国激光, 2017, 44(3): 0307001.
[6] 王诗淼, 王晶, 刘军, 等. 不同长径比金纳米双锥对光敏剂荧光和光动力疗法效果的增强[J]. 中国激光, 2017, 44(6): 0607003.
[8] 张艳惠, 管庆霞, 吕邵娃, 等. 纳米载体传递抗肿瘤药物在肿瘤微环境的靶向性及应用研究进展[J]. 现代肿瘤医学, 2014, 22(12): 2997-3001.
[26] Mari C, Pierroz V, Ferrari S, et al. Combination of Ru(II) complexes and light: New frontiers in cancer therapy[J]. Chemical Science, 2015, 6(5): 2660-2686.
[32] 张文佳, 胡祥龙. 喜树碱聚前药纳米粒子包埋吲哚箐绿用于化疗与光动力联合抗肿瘤治疗[J]. 激光生物学报, 2016, 25(6): 520-522.
[34] Ghadiali J E, Stevens M M. Enzyme-responsive nanoparticle systems[J]. Advanced Materials, 2010, 20(22): 4359-4363.
[46] 刘艳红, 周建平, 霍美蓉. 肿瘤微环境响应型智能纳米药物载体的研究进展[J]. 中国药科大学学报, 2016, 47(2): 125-133.
[50] 何玉玲. 肿瘤微环境响应性纳米载体用于药物和基因输送的研究[D]. 兰州: 兰州大学, 2013.
He YL. Environment-responsive nanocarriers for drug and gene delivery to cancer cells[D]. Lanzhou: Lanzhou University, 2013.
[51] Zhang D, Zheng A, Li J, et al. Smart Cu(II)-aptamer complexes based gold nanoplatform for tumor micro-environment triggered programmable intracellular prodrug release, photodynamic treatment and aggregation induced photothermal therapy of hepatocellular carcinoma[J]. Theranostics, 2017, 7(1): 164-179.
Article Outline
蓝善优, 张达, 刘小龙, 曾永毅. 肿瘤微环境响应的智能纳米载体在肿瘤光动力治疗中的应用[J]. 中国激光, 2018, 45(2): 0207008. Lan Shanyou, Zhang Da, Liu Xiaolong, Zeng Yongyi. Tumor-Microenvironment Activable Smart Nanocarrier System for Photodynamic Therapy of Cancers[J]. Chinese Journal of Lasers, 2018, 45(2): 0207008.






