基于光声温度精准调控的光热治疗方法  下载: 1240次封面文章
下载: 1240次封面文章
1 引言
光热治疗(PTT)是近年来兴起的一种新型的非侵入式肿瘤治疗方法,该方法采用近红外治疗激光直接照射肿瘤部位使其温度升高,从而诱发肿瘤细胞凋亡[1-4]。与传统的放疗、化疗及手术治疗相比,光热治疗具有微创、特异性强、副作用小、可重复治疗等优点,且该方法可与光动力疗法、声动力疗法、免疫疗法等新兴疗法相结合,提升治疗效果。但在实际治疗过程中,由于缺乏可对靶区进行实时温度控制及功能成像的有效手段,因此目前的治疗均是对激光采用开环控制方式,导致医生只能凭经验估计治疗时间并采用扩大治疗区域的方式保证肿瘤组织被有效杀灭。这不仅会增加病人的痛苦和医生的工作量,而且过高的温度会导致靶区细胞碳化,难以被人体代谢吸收,并可能会对同期开展的肿瘤免疫疗法的效果造成较大影响[5]。因此,对靶区温度进行实时检测及精准调控成为光热治疗过程中急需解决的关键技术难题。
目前,医学领域采用的温度测量技术按照传感器是否与组织直接接触分为接触式测量与非接触式测量两种[6]。其中,接触式温度测量技术,如热电偶或荧光温度传感器等,由于其侵入式特点而不适合应用在光热治疗过程中。在众多的非接触式温度测量技术中,红外温度测量技术可以提供高灵敏度、高精度的测量方案,但由于光在组织中具有散射特性且穿透性较差,因此只能测量组织表面的温度[7-9];超声温度测量技术具有较强的穿透性,但是测量过程易受气体及骨骼的影响,导致测量精度与成像分辨率较差[10-11];磁共振测温方式可以实现无创的、大范围的精确测温,且同时具备高穿透性和高分辨率优势,但其测量速度慢、成本高、且测温设备体积较大[12]。可见,现有的温度检测技术都存在一定的局限性,无法完全满足临床治疗上光热治疗、光动力治疗对靶区温度精准调控的需求。光声测温技术是近几年发展起来的一种新型的温度检测手段,在短脉冲激光照射下,组织吸收能量发生热膨胀,产生的初始声压与组织温度在一定范围内呈良好的线性关系,因而可以利用光声效应进行组织温度的测量。“光去声回”的测量原理使得光声测温技术结合了超声测量的高穿透性和光学测量的高对比度及高分辨率,不仅具有便携、实时、无创的特点,还在一定深度和范围内具有对组织温度进行高精度测量的潜力[13-17]。
已有大量的实验和研究验证了光声测温技术在生物组织温度检测领域应用的可行性。2005年,Larina[18]等发现了光声信号与组织温度之间的线性关系,揭示了光声测温在肿瘤热疗手术中的应用潜力。2009年,Pramanik等[19]的研究表明,在10~55 ℃范围内,光声信号强度与生物组织温度呈良好的线性关系,光声测温的精度可达0.15 ℃。这为光热治疗过程中利用光声测温结果作为高精度的反馈信号提供了科学依据。2013年,Gao等[20]在光声显微成像技术的基础之上,提出了一种无需测量组织深处的温度即可进行参数校准的方法,使光声测温在临床应用上具有了可操作性。2017年,廖宇等[21]提出了一种双波长光声测温方法,该方法显著减小了测量误差,测量精度平均提高35%以上(与单波长测温方法相比)。但现有的研究方案并没有对靶区实现实时的温度成像,也没有将光声测温成像与光热治疗靶区温度控制有机结合到一起。
本文首先提出了一种基于光声温度精准调控的新型光热治疗技术;然后给出了基于光声图像的温度成像算法、基于光声温度敏感因子的靶区温度闭环控制方法;之后搭建了一套基于光声温度精准调控的光热治疗系统。仿体的实验结果表明,基于光声温度精准调控的光热治疗方法可以作为一种更精准、更高效的辅助手段应用于光热治疗领域。
2 光声温度精准调控算法的原理
2.1 光声温度成像的原理
脉冲激光照射到物体表面的瞬间,照射区域产生光能量沉积,一部分能量被声子吸收,由此形成的温度梯度在样品内部形成压力场,压力场使样品组织发生热弹性膨胀,从而激发出超声波。光声效应产生的初始声压P可表示为
其中,
式中:F为激光能量密度;μa为组织的光吸收系数;Γ(Τ)为格林艾森系数;T为待测组织的温度;A与B都是与待测组织自身性质有关的常数。将(1)式与(2)式合并可得
其中,
由(3)~(5)式可知,只要组织的参数C与D被准确地校准,理论上就可以利用光声效应产生的超声信号对该组织进行温度测量。
此外,由于光声成像系统是一个系统,因此光声图像的每一个像素点的强度值与成像组织在该位置产生光声效应而激发出的光声信号是线性相关的,则有
式中:E是与光声成像系统相关的常数;N是测量过程中引入的噪声;V(x,y)为成像系统得到的光声图像在点(x,y)处的强度值;P(x,y)为该点组织因产生光声效应而激发出的超声信号。将(3)~(6)式合并可得
其中,
在待测组织区域较小的情况下,组织的光吸收系数μa与激光能量密度F在该区域内可近似看作常数。故由(7)~(9)式可知,可以通过光声图像的强度值对组织温度进行较为准确的测量。
2.2 基于光声温度敏感因子的闭环温度控制算法原理
成像系统在信号测量和图像重建过程中会不可避免地引入噪声,这会严重影响提取温度的精度。因此,本文首先通过对光声图像强度值进行时域分析来选取合适的噪声临界值Vn,然后基于此对整个图像进行阈值滤波,即
本文将滤波后的每张光声图像中强度值大于Vn的点定义为光声温度敏感点,将每个图像矩阵中光声温度敏感点的个数定义为该图像的光声温度敏感因子S,这样可得到每张光声图像的平均光声强度值为
由于每张光声图像的光声温度敏感因子S与平均光声强度值Vm都是由待测组织光声图像的强度值通过线性变换得到的,因此,(7)式所示的与待测组织温度的线性关系也被保留。提取不同温度下光声图像的光声温度敏感因子S与平均强度值Vm,并将它们分别与温度进行线性拟合,得到相应的线性关系为
通过(12)~(13)式可以得到待测区域光声图像上每一个像素点的温度值,从而可以得到光声图像对应的温度图像。对于每一张光声图像,都可通过(13)式快速获取闭环反馈信息。
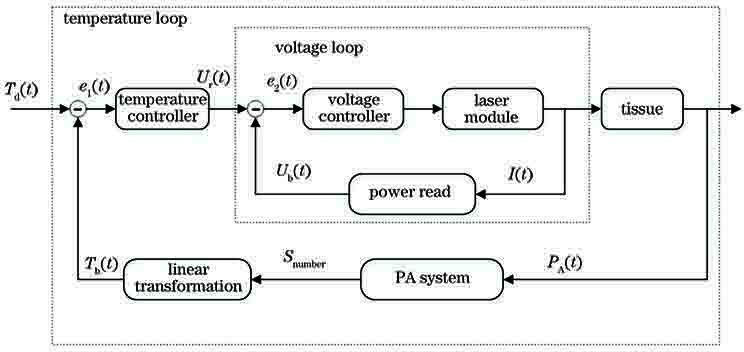
PID控制算法在众多闭环控制算法中是最简单有效的,而且具有较强的鲁棒性,故本文采用PID控制器,结合实际控制对象进行充分的控制器参数整定工作。
3 实验装置与成像系统
系统的工作流程为:超短脉冲激光器(波长为532 nm,脉宽为10 ns,脉冲能量为25 mJ,重复频率为20 Hz)及连续型激光器(波长为808 nm,额定功率为10 W)组成的光源(如

图 3. 光热治疗系统的光源部分。(a)光路整体图;(b)脉冲激光器;(c)连续型激光器
Fig. 3. Light source of PTT system. (a) Overall optical path; (b) pulse laser; (c) continuous laser

图 4. 一体化探头。(a)探头侧视图;(b)探头出光口侧图;(c)一体化探头的三维模型
Fig. 4. Integrated probe. (a) Lateral view of the probe; (b) light exit of the probe; (c) 3D model of the integrated probe
4 实验方法及结果
4.1 光声温度测量的仿体实验
为了对光声温度测量理论进行实验验证,本文选用线阵探头第64号阵元进行单阵元信号采集。由于琼脂的光散射特性和力学特性与生物组织相近,故本文设计了去离子水与琼脂(质量分数为3%)组成的肌肉组织仿体。一般情况下,肿瘤组织都存在于滋养血管环境中,且碳素墨水具有与人体组织较为相似的光声效应,故而,本研究团队制作了一系列加入不同质量碳素墨水的肿瘤仿体立方块。仿体中的各成分如

图 6. 实验仿体实物图。(a)仿体侧视图;(b)仿体俯视图;(c)对照变量
Fig. 6. Physical map of experimental phantom. (a) Side view of the phantom; (b) top view of the phantom; (c) the control variable
表 1. 仿体参数
Table 1. Parameters of phantom
|
为了对光声信号与温度之间的线性关系进行拟合,采用信号发生仪产生控制信号,并以开环控制的形式驱动连续型激光器对肿瘤仿体进行加热,同时对光声信号进行采集。实验中的采样温度间隔为1 ℃,在每个采样点采集15组数据。为了获得温度测量目标点的实验对照温度,将热电偶(测温精度为0.1 ℃)插入肿瘤仿体内部进行温度采集,每次采样时将采得的15个光声信号强度(峰峰值)进行均值处理,并将其作为该温度下的光声信号幅值,最终采用多项式拟合的方式对数据进行线性拟合(R2为待拟合数据与直线的确定系数)。实验结果如

图 8. 各组仿体光声信号与温度的线性关系。(a) 1号对照组;(b) 2号对照组;(c) 3号对照组;(d) 4号对照组;(e) 5号对照组;(f) 6号对照组
Fig. 8. Linear relationship between temperature and photoacoustic signal of each phantom. (a) Control group 1; (b) control group 2; (c) control group 3; (d) control group 4; (e) control group 5; (f) control group 6
4.2 光声温度成像及光热治疗实验
为了对光声温度成像与靶区温度反馈控制算法的有效性进行验证,本文进行了光声温度实时成像实验。为此,本文设计了由模拟血管和肌肉两部分组成的人体组织仿体。仿体内部由碳素墨水及薄塑料管(PVCP)组成,PVCP用来模拟人体血管,血管横截面是直径为2 mm的圆形。仿体外部由质量分数为2%的琼脂与5%的明胶组成,用以模拟人体肌肉组织。为了保证较好的成像效果,血管仿体距离人体肌肉组织仿体上表面约26 mm。为了使实验结果更具有代表性,本实验选择仿体中如
随后对温度变化情况下仿体的光声图像进行采集。考虑到温度成像涉及的区域较大,因此在本次实验中采用水浴加热的形式(恒温分辨率为0.1 ℃)来保证整个ROI温度的一致性,水浴温度从30 ℃逐渐升高至48 ℃(温度间隔为0.5 ℃),水浴锅内水的温度将在每个目标温度下保持3 min,以保证仿体与水进行充分的热交换;之后重复采集128次信号,并对重建后的128张光声图像进行平均处理,实验结果如

图 11. 不同温度下的光声图像及采样信号。(a) 31 ℃,光声图像;(b) 36 ℃,光声图像;(c) 41 ℃,光声图像;(d) 41 ℃,光声信号;(e) 36 ℃,光声信号;(f) 31 ℃,光声信号
Fig. 11. Photoacoustic images and sampling signals at different temperatures. (a) Photoacoustic image at 31 ℃; (b) photoacoustic image at 36 ℃; (c) photoacoustic image at 41 ℃; (d) photoacoustic signal at 41 ℃; (e) photoacoustic signal at 36 ℃; (f) photoacoustic signal at 31 ℃
按前文推导出的光声温度成像算法对光声图像进行处理(以40 ℃下的仿体为例),
通过(12)、(13)式提取光声图像中携带的温度信息,并分别拟合成如

图 12. 光声图像矩阵中强度值的分布曲线
Fig. 12. Distribution curve of intensity values in photoacoustic image matrix

图 13. 仿体光声测量数据与温度的线性拟合结果。(a)光声温度敏感点;(b)平均像素值
Fig. 13. Linear fitting result between photoacoustic data and actual temperature of phantom. (a) Sensitive point of photoacoustic temperature; (b) average pixel value

图 14. 多模态重建结果。(a)光声图像;(b)超声图像;(c)温度图像
Fig. 14. Multimodal reconstruction. (a) Photoacoustic image; (b) ultrasound image; (c) temperature distribution image
根据平均像素值与温度间的线性关系可计算出仿体的温度图像。
为了验证系统的控制精度和算法的有效性,本文进行了光热治疗实验。实验中采用808 nm连续型激光与532 nm超短脉冲激光组成的混合光源均匀照射在仿体表面,设置仿体的初始温度与期望温度分别为34 ℃与44 ℃,采用光热治疗系统以5 Hz的工作频率对仿体进行加热,即每秒有5个光声温度敏感因子实时反馈回上位机,并产生对应的控制量来驱动连续型激光工作。仿体靶区中插入了热电偶,将热电偶采集的温度作为实验对照。实验过程中采用临界比例度法反复对系统进行PID参数整定,最终得到的较优的整定结果为:Kp=5,Ki=0.002,Kd=0.3(Kp、Ki、Kd分别为PID控制器中比例、积分与微分控制参数)。实验得到的靶区温度和温度跟随误差曲线图分别如
为了对比光声温度敏感因子测温方式与传统热电偶测温方式的测量效果,绘制了光声测温曲线与插入人体组织仿体中的热电偶的测温曲线,如

图 17. 热电偶与光声测温结果的对比
Fig. 17. Temperature measured by thermocouple and photoacoustic method
表 2. 两种测温方式的温度控制精度
Table 2. Temperature control accuracy of two temperature measurement methods
|
从上述实验结果可以看出,本文设计的光热治疗系统具有较好的暂态和稳态性能。基于光声温度敏感因子的闭环温度控制算法可以实现光热治疗过程中快速、准确的非接触式靶区温度控制功能,为肿瘤光热治疗提供了重要的技术手段。
5 结论
在肿瘤的光热治疗领域,利用光声效应对生物组织温度进行测量是一种十分有发展前景的技术。本文基于肿瘤光热治疗过程对靶区温度控制和温度成像功能的需求,设计了一套新型的基于光声温度精准调控的光热治疗系统,完成了从系统硬件设计、软件算法开发到仿体实验验证等一系列工作。在基于单阵元超声探头温度测量技术的基础上,本文研究了基于二维光声图像强度值的温度成像算法,采用多阵元超声探头实现了对靶区的实时超声/光声/温度三模态成像,系统成像速率为3 frame/s。同时,本文提出了基于光声温度敏感因子的温度闭环控制算法,并通过实时调控激光器的功率对靶区温度进行精准调控,进行了基于仿体的光声测温成像及光热治疗实验。在人体组织仿体实验中,系统的调节时间为10 s,温度跟随均方根误差在0.7 ℃以内,温度跟随曲线与热电偶测温曲线在趋势和精度上都保持了较高的一致性,可基本满足光热治疗的临床使用要求。
需要指出的是,本文在算法和系统方面仍存在部分局限性。在算法方面,由于光声测温原理性的限制,必须在进行实验前对温度与光声信号之间的线性关系进行校准,这增加了临床应用的繁琐程度,而且校准工作的准确性将直接影响温度控制精度;此外,在温度控制算法的参数选择方面,本文采用的临界比例度法具有一定的控制不确定性。因此,在实际应用过程中,参数的确定依然是一项需要时间和经验的工作,参数整定的结果也与温度控制效果息息相关,这也会增加医护人员使用时的工作量。在系统方面,目前的成像速率为3 frame/s,这对于光热治疗的临床使用还是相对较慢的。
在后续的研究中,本研究团队拟在以下几方面继续开展研究:1)简化校准工作流程和提高校准精度,通过多次校准取平均以及升温降温过程联合校准的方式提升校准的准确度;2)设计自整定控制算法,以降低控制器参数整定带来的控制不确定性和临床使用时操作流程的繁琐性,提高系统的温度测量精度和控制精度;3)结合光热探针对小鼠进行肿瘤活体实验,期望能提升系统的成像速率到15 frame/s以上。
综合而言,与传统的开环式光热治疗方法相比,基于光声温度精准调控的光热治疗方法可以实现离体组织的非接触温度实时成像,并可完成对组织温度的快速、准确调控,避免光热治疗过程中过治疗导致的组织碳化等一系列问题;对温度进行精确调控可以极大地促进肿瘤光热治疗与其他新型(如肿瘤免疫治疗等)疗法的有机结合,极大地减少病患治疗的痛苦并降低医生的工作量。
[1] Shao P, Cox B, Zemp R J. Estimating optical absorption, scattering, and Grueneisen distributions with multiple-illumination photoacoustic tomography[J]. Applied Optics, 2011, 50(19): 3145-3154.
[3] 李聪, 王克鸿, 黄俊. 吲哚菁绿与亚甲基蓝对生物组织激光钎焊强度及热损伤的影响[J]. 中国激光, 2019, 46(12): 1207002.
[4] 王玲, 涂沛, 徐铭恩. 激光辐照下组织光热响应的实时监测研究[J]. 中国激光, 2015, 42(1): 0104001.
[5] 梁国海, 邢达. 用于肿瘤光热治疗的有机纳米材料研究进展[J]. 中国激光, 2018, 45(2): 0207020.
[6] 马冬晓, 汪家春, 陈宗胜, 等. 宽动态范围辐射测温系统的简化定标方法[J]. 光学学报, 2019, 39(6): 0612003.
[7] 肖航, 杨振发, 张雷, 等. 温度对水泥生料近红外光谱检测的影响及补偿方法[J]. 中国激光, 2020, 47(1): 0111001.
[8] Nienhaus K, Nienhaus G U. Ligand dynamics in heme proteins observed by Fourier transform infrared-temperature derivative spectroscopy[J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2011, 1814(8): 1030-1041.
[9] 涂碧海, 洪津, 姚萍萍, 等. 多角度偏振成像仪温度校正方法[J]. 中国激光, 2019, 46(10): 1010002.
[10] Hwang O, Lee M C, Weng W B, et al. Development of novel ultrasonic temperature measurement technology for combustion gas as a potential indicator of combustion instability diagnostics[J]. Applied Thermal Engineering, 2019, 159: 113905.
[11] Shen G F, Chen Y Z, Ren G X. An improved tumour temperature measurement and control method for superficial tumour ultrasound hyperthermia therapeutic system[J]. Journal of Physics: Conference Series, 2006, 48: 653-657.
[12] Wyatt C, Soher B, Maccarini P, et al. Hyperthermia MRI temperature measurement: evaluation of measurement stabilisation strategies for extremity and breast tumours[J]. International Journal of Hyperthermia, 2009, 25(6): 422-433.
[13] Feng X H, Gao F, Zheng Y J. Photoacoustic-based-close-loop temperature control for nanoparticle hyperthermia[J]. IEEE Transactions on Biomedical Engineering, 2015, 62(7): 1728-1737.
[14] Petrova E, Liopo A, Oraevsky A A, et al. Temperature-dependent optoacoustic response and transient through zero Grüneisen parameter in optically contrasted media[J]. Photoacoustics, 2017, 7: 36-46.
[15] Xu M H, Wang L V. Photoacoustic imaging in biomedicine[J]. Review of Scientific Instruments, 2006, 77(4): 041101.
[16] Upputuri P K, Das D, Maheshwari M, et al. Real-time monitoring of temperature using a pulsed laser-diode-based photoacoustic system[J]. Optics Letters, 2020, 45(3): 718-721.
[17] Alaeian M. Orlande H R B, Lamien B. Application of the photoacoustic technique for temperature measurements during hyperthermia[J]. Inverse Problems in Science and Engineering, 2019, 27(12): 1651-1671.
[18] Larina I V, Larin K V, Esenaliev R O. Real-time optoacoustic monitoring of temperature in tissues[J]. Journal of Physics D, 2005, 38(15): 2633-2639.
[19] Pramanik M, Wang L V. Thermoacoustic and photoacoustic sensing of temperature[J]. Journal of Biomedical Optics, 2009, 14(5): 054024.
[20] Gao L, Wang L D, Li C Y, et al. Single-cell photoacoustic thermometry[J]. Journal of Biomedical Optics, 2013, 18(2): 026003.
[21] 廖宇, 简小华, 崔崤峣, 等. 一种基于双波长的光声测温技术[J]. 物理学报, 2017, 66(11): 117802.
Liao Y, Jian X H, Cui Y Y, et al. Photoacoustic temperature measurement based on dual-wavelength method[J]. Acta Physica Sinica, 2017, 66(11): 117802.
[22] Wang J, Lu H B, Li T F, et al. An alternative solution to the nonuniform noise propagation problem in fan-beam FBP image reconstruction[J]. Medical Physics, 2005, 32(11): 3389-3394.
Article Outline
马一鸣, 马立勇, 秦泽政, 孙明健. 基于光声温度精准调控的光热治疗方法[J]. 中国激光, 2020, 47(10): 1007001. Ma Yiming, Ma Liyong, Qin Zezheng, Sun Mingjian. Photothermal Therapy Method Based on Precise Regulation of Photoacoustic Temperature[J]. Chinese Journal of Lasers, 2020, 47(10): 1007001.