基于对数补偿和动态阈值的手持式光学相干层析成像方法  下载: 673次
下载: 673次
1 引言
光学相干层析成像(OCT)[1]是一项基于低相干光干涉原理的三维(3D)层析成像技术。OCT系统通过测量探测光和参考光的干涉信号,再对其进行处理来得到重构样品组织的层析图像。OCT技术现已在生物医学[2]等领域获得了广泛应用。
微血管是人体中管径最细、分布最广的血管,其主要功能是促进血液与组织之间进行物质交换,调节血压和体温,并在人体内参与营养物质的输送和代谢物质的清除。因此,微血管的结构、分布与功能变化都可以反映出人体的健康状况,可将微血管分布图像作为辅助手段对癌症[3-4]、糖尿病[5-7]、酒色斑[8-9]等病变进行早期诊断。
利用OCT技术的无侵入性、成像迅速、空间分辨率高和探测灵敏度高等特点,研究人员提出了几种基于OCT的人体血管内血流速度和微血管分布的OCT血管造影术,包括多普勒光学相干层析术(DOCT)[10-12]、散斑方差光学相干层析术(SVOCT)[13-14]等。
OCT血管造影术不需要向体内注射造影剂,对人体更安全,摆脱了诸多传统血管造影技术应用的限制,拓展了OCT技术的微血管分布可视化能力。
依据成像原理,OCT技术主要可以分为时域OCT(TDOCT)[15]和频域OCT(FDOCT)[16],两者的不同主要体现在干涉信号的获取方式上。FDOCT系统参考镜不需要机械扫描,可保持静止,光电探测器接收低的相干干涉光的干涉信号,经由傅里叶变换后可得到样品深度方向的结构。与传统的需要参考镜沿深度方向机械运动的TDOCT系统相比,FDOCT系统具有更高的信噪比、系统灵敏度和成像速率[17-18]等。
FDOCT有两种实现方式:谱域OCT(SDOCT)和扫频OCT(SSOCT),两者的不同主要体现在光电探测设备和光源上。SDOCT系统选用光谱仪作为光电探测设备,分束镜首先将光源发出的光分为参考光和测量光,它们分别从参考臂和样品臂中返回并发生干涉,最后由光谱仪对干涉信号进行采集。干涉信号由光栅分光后再经过傅里叶透镜会聚在线扫电荷耦合器件(CCD)上,这样,不同光谱分量的干涉光强度信号便可以被分别获取。SSOCT系统不使用光谱仪,而是使用扫频激光光源,出射光的波长具备时变性,并以高速响应单点探测器作为光电探测设备来接收干涉信号。扫频激光光源发出的光在每一周期内历经全部波长,每个周期完成后,一次线扫描(A扫)即可获得所需的干涉光谱信号。
SSOCT系统兼具无需机械扫描、稳定性高、成像速度快、结构简单的优点,且因高速响应单点探测器的加入,又具备较高的灵敏度。随着技术的进步,在生物医学领域中,手持式OCT系统崭露头角,受到青睐。Larocca等[19]利用二维(2D)微机电扫描系统搭建了手持式SSOCT,并将其应用于眼科检查;Cheon等[20]实现了手持式SSOCT对视网膜的高精度实时深度控制成像。
本文基于SSOCT技术搭建了一套手持式人体皮肤微血管的快速成像系统,基于强度差分(PID)和动态阈值算法[21]重建血流图像,并将动态阈值算法与单纯的强度差分算法、对数补偿算法的重建结果进行比较。结果表明,本文采用的动态阈值算法能够呈现出更多的血流分布细节,成像效果更佳。
2 原理
光纤耦合器中产生的干涉光一部分直接进入平衡探测器(BPD)的某一端口,另一部分入射到环流器接口2中,再经接口3进入平衡探测器的另一接口。最后,平衡探测器中的干涉信号转换为电信号,被数据采集卡(ATS9350,Alazartech公司)采集后传输至计算机中进行处理,即可重构出微血管分布图像。
使光束先经过偏振控制器后再进入参考臂和样品臂的目的是为了让两束光的偏振态尽量一致,从而使得到的干涉光信号具有更高的条纹对比度。
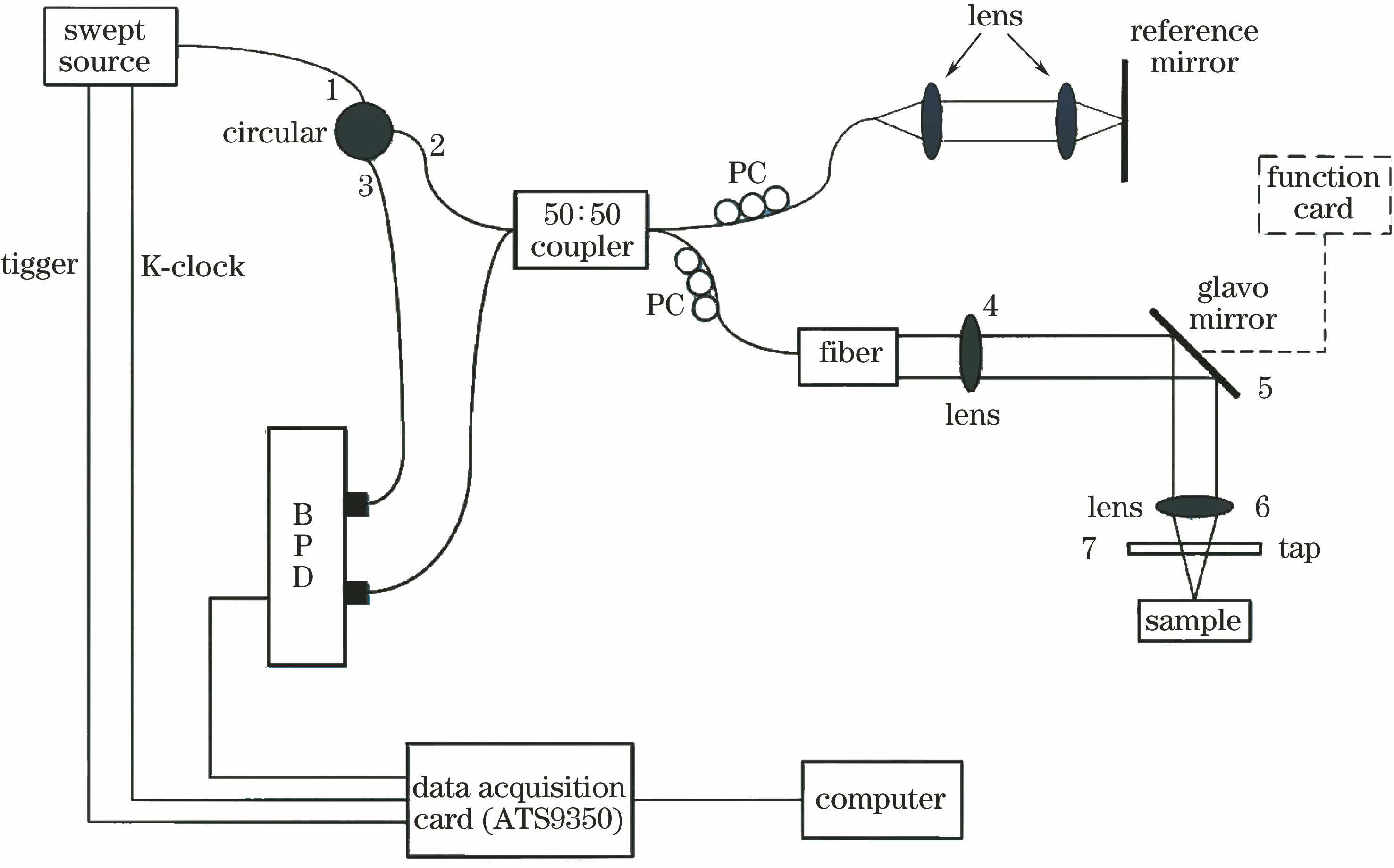
图 1. 手持式SSOCT微血管成像系统的原理图
Fig. 1. Schematic of the handheld SSOCT microvascular imaging system

图 2. 手持式SSOCT微血管成像系统实物图。(a)样机;(b)手持化样品臂
Fig. 2. Actual picture of the handheld SSOCT microvascular imaging system. (a) Prototype; (b) handheld sample arm
3 微血管分布重建算法
根据光的干涉原理,手持式SSOCT微血管成像系统采集到的干涉光信号[22]应为
式中:
由(1)式可知,波数
本文基于对数补偿的方法获取血流分布图像[23],结合动态阈值方法对传统PID算法进行改进,并与LCPID算法进行比较。
3.1 进行对数补偿的PID算法
OCT微血管重建算法的根本原理是利用各种数学方法对静态组织和动态组织进行区分,而动静态组织与动态组织的根本区别在于其运动属性的不一致。因此,通过处理连续帧的强度层析图来获取微血管的分布图像。在PID算法中,设定参数
式中:
式中:FFT为快速傅里叶变换。
对光谱强度
3.2 动态阈值方法优化的PID算法
自OCT技术问世以来,多种基于运动属性来区别动、静态组织的算法得到了广泛应用。通常,对于任一种区分算法,在计算得到的运动分布谱中,动静态组织都应当分立两侧。因此,只要在运动分布谱中设立合适的阈值,便可正确区分动、静态组织。但获取的动、静态组织的运动信息不仅取决于其实际的运动状态,还会受到原始OCT散射幅度的影响。OCT散射幅度随深度的增大呈指数衰减,运动分布谱中的区分阈值也会与深度产生联系。因此,基于以往经验所得的分类阈值会给图像带来较大误差。
在此,本课题组结合动态阈值方法对已进行对数补偿的血流分布图像进行优化。其中,运动谱仍然基于对OCT信号的连续帧进行强度差分得到,同样设立参数
式中:
根据参考文献[
24]可知,OCT血管造影信号
式中:
相似地,动态体素的分布函数为
式中:
结合(5)、(6)式,在对PID算法进行对数补偿的基础上,采用动态阈值方法对成像进行进一步优化。首先,依次对不同深度的正面图进行初步的动、静态组织区分,然后进行直方图分析,以得到特定深度的运动图谱。之后,将所测量的运动谱直方图信息与双Rayleigh分布曲线
然后,将动态体素和静态体素的交点作为对应深度的阈值,再通过拟合寻找阈值和深度的关系,最后将低于阈值的静态体素从微血管分布图像中去除。
4 实验结果
为了验证动态阈值算法的有效性,对一个志愿者的左手大拇指根部和左手无名指皮下微循环血流进行在体成像。在实验中,每个面扫描(B扫)包含1000个A扫(线扫),一次完整的扫描包括400个B扫,成像范围为3 mm×3 mm。对左手大拇指根部和左手无名指标记区域进行血流重建的实验结果如
对比

图 4. 左手大拇指根部在体成像结果的对比图。(a)左手拇指成像部位;(b)无对数补偿PID算法的血流重建截面图;(c)有对数补偿PID算法的血流重建截面图;(d)结合动态阈值及对数补偿算法的血流重建截面图
Fig. 4. Comparison of in vivo imaging results of the left thumb’s root. (a) Imaging area of the left-hand thumb; (b) en-face image using PID algorithm without logarithmic compensation; (c) en-face image using logarithmic-compensated PID algorithm; (d) en-face image using logarithmic-compensated PID algorithm with motion threshold

图 5. 左手无名指在体成像结果对比图。(a)左手无名指成像部位;(b)无对数补偿PID算法的血流重建截面图;(c)有对数补偿PID算法的血流重建截面图;(d)结合动态阈值及对数补偿算法的血流重建截面图
Fig. 5. Comparison of in vivo imaging results of the left hand ring finger. (a) Imaging area of the left hand ring finger; (b) en-face image using PID algorithm without logarithmic compensation; (c) en-face image using logarithmic-compensated PID algorithm; (d) en-face image of logarithmic-compensated PID algorithm with motion threshold
5 结论
本课题组搭建了一套使用高速扫频激光光源的SSOCT系统,并成功地进行了人体皮下微血管的在体成像。使用SSOCT系统对左手大拇指根部和左手无名指的标记区域进行数据采集,通过不同的算法重建了皮下血流分布,并进行了对比。在成像过程中,首先预处理得到的OCT散射信号,具体方式为对其进行快速傅里叶变换得到对应的结构信息,即结构图。之后,基于结构信息,以PID算法为基础,分别比较了有无对数补偿和有无动态阈值优化的情况下,血流重建图像的差异。成像结果表明,对数补偿方法呈现出了更深层的血流,动态阈值方法为图像带来了更多的细节和更高的对比度。在对数补偿和动态阈值结合方法的重建结果中可以观察到其他方法重建结果无法呈现的一些细节血流信息,体现了明显的优越性。在实验室搭建的SSOCT系统中,采用SolidWorks软件设计及增材制造技术制作出了样品臂外壳,实现了手持化,大大提高了系统使用的方便性,可对人体大部分皮下血管进行快速成像,对OCT系统的发展和临床应用具有重要意义。
[1] Huang D, Swanson E A, Lin C P. et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181.
[2] 苏亚, 孟卓, 王龙志, 等. 光学相干层析无创血糖检测中相关性分析及标定[J]. 中国激光, 2014, 41(7): 0704002.
[3] Folkman J. Tumor angiogenesis factor[J]. Cancer Research, 1974, 34(8): 2109-2113.
[5] Fossarello M, Florence C, Napoli P E, et al. Evaluation of foveal avascular zone alterations in diabetic retinopathy with optical coherence tomography angiography[J]. Investigative Ophthalmology & Visual Science, 2017, 58(8): 951-951.
[9] Latrive A. Teixeira L R C, Gomes A S L, et al. Characterization of skin port-wine stain and hemangioma vascular lesions using Doppler OCT[J]. Skin Research and Technology, 2015, 22(2): 223-229.
[11] 叶鳞泓, 鲍静, 邵毅. 多普勒OCT在眼科疾病的应用进展[J]. 眼科新进展, 2017( 7): 680- 683.
Ye LH, BaoJ, ShaoY, Application progress of Doppler optical coherence tomography in eye diseases[J]. Recent Advances in Ophthalmology, 2017( 7): 680- 683.
[12] 丁志华, 赵晨, 鲍文, 等. 多普勒光学相干层析成像研究进展[J]. 激光与光电子学进展, 2013, 50(8): 080005.
[14] 姚辛励, 季琨皓, 刘桂鹏, 等. 基于散斑方差和多普勒算法的光学相干层析术血流成像[J]. 激光与光电子学进展, 2017, 54(3): 031702.
[22] 陈朝良. 基于谱域光学相干层析术的人体皮肤三维血流成像研究[D]. 南京: 南京理工大学, 2016.
Chen CL. Study of Fourier domain optical coherence tomography based 3D blood flow imaging of human skin[D]. Nanjing: Nanjing University of Science and Technology, 2016.
[23] 张兰兰, 高万荣, 史伟松. 基于对数强度差分标准差的光学相干层析成像性能分析[J]. 中国激光, 2018, 45(4): 0407002.
张越, 高万荣, 张兰兰, 史伟松. 基于对数补偿和动态阈值的手持式光学相干层析成像方法[J]. 中国激光, 2018, 45(11): 1107002. Zhang Yue, Gao Wanrong, Zhang Lanlan, Shi Weisong. Handheld Optical Coherence Tomography Based on Logarithmic Compensation and Motion Threshold[J]. Chinese Journal of Lasers, 2018, 45(11): 1107002.







