激光光谱技术在呼吸气体分析中的发展与未来  下载: 1477次
下载: 1477次
1 引言
人体与外界的气体交换以及气体在体内运输交换的呼吸是人类最重要的生命活动,其包含的信息与人体代谢、疾病及环境有着密切的关系。早在春秋战国时期,中医诊断学“望闻问切”的创始人——扁鹊就开始根据病人呼出气体的气味变化来诊断疾病。《黄帝内经》中明确指出了“望”“闻”“问”“切”。四诊中的“闻”诊包括听声音和嗅气味,初步讨论了异常气味与病变的关系。如:糖尿病患者呼出的气体中有一种特殊的水果味,肝脏疾病患者的呼出气体中有一种鱼腥味,肺炎患者的呼出气体中有腐臭味等。“西医之父”希波克拉底也曾有过类似的记载。1971年,两届诺贝尔奖获得者Pauling[1]发现了呼吸气体中含有250多种挥发性特征有机物(VOCs),开创了现代呼吸气体分析领域。在最近10年中,随着现代医学科技的发展和多学科的交叉融合,用于重大疾病诊断的生物标记物,特别是呼吸生物标记物技术得到了快速发展[2-9]。也可以说,这一基本思想始于中医诊断中的“闻”。随着分子生物学的快速发展,该思想将成为中西医结合中一个颇具前景的研究领域。“呼口气,知健康”一直是人们的美好愿景,其发展的每一步,几乎都折射出人类历史上重大的智慧与科技进步。
相关病理学的调查和研究表明[4],当人体的脏器或组织出现损伤或病变之后,其功能上的变化会相应地引起代谢产物的改变。这些代谢产物进入到血液中就会引起某些代谢产物含量相对增高,通过检测代谢产物的浓度就可以诊断出脏器损伤或病变的程度。因此,通过分析血液中某些特定成分来诊断疾病已经成为现代医学诊断中的一种常规手段。血液中的代谢产物能够通过气血屏障进入肺部,进而引起呼出气体组分的改变,最终使得排出体外的某些特定气体浓度升高。因此这些特定气体能够揭示身体内部的变化,成为人体健康评估、疾病诊断及环境医学研究的呼吸生物标记物。在目前已确认的呼出气体包含的2000多种低浓度VOCs中(体积分数在10-6或10-9量级,有的甚至在10-12量级),已有包括13C-同位素、一氧化氮(NO)、丙酮、硫化氢、氨气、丁烷等在内的30多种VOCs。被确认为与人体代谢异常、疾病或外部环境影响相关的即成为呼吸生物标记物,已建立的生物标记物及其对应的生理症状如
2 呼吸气体分析检测技术之激光光谱
目前已确认呼出气体中包含2000多种体积分数在10-12~10-6量级的低浓度VOCs。呼吸气体分析研究领域的未来发展对其检测技术提出了新的要求:发展实时、在线、高灵敏、高精度、高准度地获取大量呼吸气体数据的分析技术;加速呼吸气体分析领域的研究成果向临床医学的转化;发现新的呼吸生物标记物。气相色谱-质谱联用技术(GC-MS)是长期以来呼吸气体分析领域最常用的手段,可对肺癌、哮喘等疾病患者的呼吸标志物实现体积分数为10-9乃至10-12量级的高精度测量。但是采用该方法对痕量气体进行分析时,需要先对气体样品进行低温富集(或其他富集方法),然后采用GC技术进行分离,再通过MS进行分析。对单个样品的分析通常需要1 h左右。而且想要得到该样品的绝对浓度,还需要进行定标(外标法、内标法或归一化法)。在这一分析过程中,样品的采集与低温富集处理会带来误差,从而注定了GC-MS无法满足呼吸气体分析领域未来发展的要求[10-11]。
各国的研究人员都在不断探索和研究新的分析技术,以推动呼吸气体分析的发展。随着激光技术的发展,激光光谱技术以其高灵敏度、高选择性、实时在线分析的特点,为呼吸气体分析领域的研究提供了一种实现实时在线分析的可行性技术手段。激光穿过气体混合物时具有选择的吸收光谱,即不同的气体分子有着自己的特征吸收“指纹”,位于谱线中界限分明的位置,这使激光光谱法成为无创呼吸分析领域中非常有用的一种方法。2006年在美国举办的CLEO(Laser Science for Photonic Applications)会议上,包括美国科学院院士Ye、美国Rice大学的Tittle、美国Johns Hopkins大学的Risby、英国皇家科学院院士Smith以及奥地利科学院Amann在内的专家一致认为,激光光谱技术在灵敏度、选择性、响应时间等方面有着巨大优势。在此之后,基于激光光谱实现痕量呼吸标记物检测的成果也在不断涌现,受到了业界的广泛关注[8-9,12-13]。特别是随着技术的发展,基于太赫兹和光学频率梳的呼吸气体分析成果近年来常有报道[14-16]。本文论述的主要激光光谱技术包括:可调谐
表 1. 已建立的生物标记物及其对应的生理症状[7]
Table 1. Established breath biomarker and their physiological symptoms[7]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
半导体激光吸收光谱(TDLAS)技术、光腔衰荡光谱(CRDS)技术以及光声光谱(PAS)技术。
2.1 TDLAS技术
TDLAS技术是一种将激光技术与长光程吸收池相结合的痕量气体检测技术,常用于气体浓度的测量。依据Beer-Lambert定律,激光的基准强度
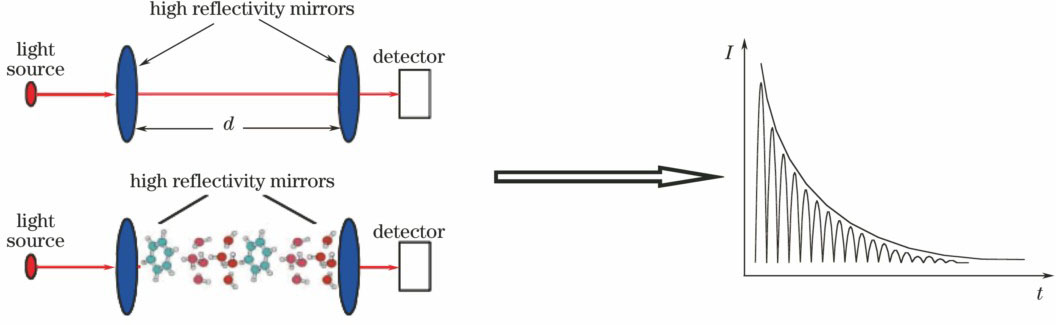
2.2 CRDS技术
2.3 PAS技术
PAS技术不同于TDLAS技术和CRDS技术,它不测量光谱本身,而是检测物质吸收光辐射后产生的声波变化。当物质吸收光辐射后,在通过无辐射跃迁返回基态时,常常会将激发能转变成为热能,热能又可以激发出声波,通过接收热激发的声波来获取光谱信息,即为光声光谱技术。其相应的吸收为
3 基于激光光谱技术的呼吸生物标记物检测
在相关文献列出的目前主要的呼吸生物标记物中,以呼吸气体作为测量样品,激光光谱技术作为检测手段,已经有14种生物标记物得到了测量;还有一些呼吸生物标记物仅进行了标准样品的测量,没有在呼吸气体样品中进行测量。已测14种呼吸生物标记物的光谱“指纹”涵盖了紫外到中红外的光谱区域,因此每一种呼吸生物标记物光谱“指纹”的选择,都需要考虑待测生物标记物在呼吸气体中的预期含量、检测灵敏度、其他气体可能的光谱干扰、激光光源,以及整个呼吸气体分析系统的便携性与成本。代表性的标记物检测如
表 2. 主要生物标记物的光谱指纹以及采用的光谱技术和检测极限[7]
Table 2. Spectral fingerprints, laser spectroscopic technique, and detection limit of major biomarkers[7]
|
总体来看,目前基于激光光谱技术的呼吸生物标记物检测中的光谱指纹主要集中在紫外波段、近红外波段和中红外波段,其灵敏度和选择性较高,有的呼吸标记物的检测已达到10-12量级,性能也已完全可以媲美质谱技术。
4 基于激光光谱技术的呼吸气体分析仪及应用研究进展
4.1 基于激光光谱技术的呼吸气体分析仪
随着C-13同位素筛查幽门螺旋杆菌、NO筛查哮喘的相关仪器通过美国食品药品监督管理局(FDA)认证,呼吸气体分析领域的仪器研发进展迅速。2006年之后,激光技术得到了越来越多的关注,包括日本TOSHIBA公司在内的诸多研究机构和企业将目光聚焦在了基于激光光谱技术的呼吸气体分析仪器上。2006年,美国Oklahoma Ekips公司斥资290万美元研发出了主要用于哮喘诊断的第二代呼吸气体分析仪器;2011年,美国Metalobomx公司获得了美国国家癌症中心114万美元的支持,主要研发用于肺癌诊断的呼吸气体分析仪器;2013年,英国Oxford Medical Diagnostics公司获得了英国技术战略委员会25万英镑的小额资助,用于研究新一代便携式产品。
2014年,TOSHIBA公司推出了与早稻田大学联合研发的呼吸气体分析仪器。该仪器采用中红外光源及腔增强光谱技术检测呼吸气体中的丙酮,用于内分泌疾病诊断和人体代谢的研究。2015年,该产品正式推向市场,主要针对运动健康评估和脂肪代谢。
中国医学科学院生物医学工程研究所的激光光谱团队一直致力于基于CRDS技术的呼吸气体分析仪器研发,并于2013年研发出了第一代基于CRDS技术的呼吸丙酮分析仪(如

图 4. 第一代CRDS呼吸丙酮分析仪的重复性
Fig. 4. The reproducibility of the CRDS breath acetone analyzer I
4.2 临床应用进展
尽管目前已有几十种呼吸标记物得到了初步确认,但是要想真正应用于临床,还需要大量有效临床数据的支持。更重要的是,如果任何潜在的、有用的分子标记物与现有临床检验参数没有定量相关性,那么其将无法应用于临床诊断研究。而激光光谱以其媲美质谱技术的检测能力和实时在线检测的优势,在近年来的应用中展现出了广阔的前景。
早在1999年,Namjou等[12]就采用TDLAS技术测试了十几个自愿者测试对象(包括吸烟者和非吸烟者)呼出气体中4种不同分子(包括N2O、13CO2、12CO2和CO)的浓度。结果发现,CO2的浓度在吸烟者中普遍减少了42%,13CO2与12CO2的比值在吸烟者呼出气体中的浓度比在非吸烟者中的要高30%,但原因不明。
与国外相比,国内在临床应用方面的进展颇为显著,这主要得益于国内部分课题组与临床机构的“医工结合”。2011年,大连理工大学于清旭研究组[17]采用光声光谱技术,针对肾病的呼吸标记物——氨气实现了高浓度CO2和H2O背景下的高灵敏检测,检测极限达到1.6×10-8(体积分数)。同时,采用该系统测量了9名健康志愿者和6名终末期肾脏病(ESRD)患者透析过程中呼出氨气的浓度。检测结果表明,健康志愿者呼出氨气的体积分数一般在3×10-7左右;而ESRD患者透析前呼出氨气的体积分数在2×10-7左右,在透析过程中呼出氨气浓度呈近似指数的下降趋势,而在透析结束时呼出氨气浓度下降到健康者的水平,呼出氨气的下降率均超过65%。这与临床采用的血尿素氮(BUN)检测透析治疗充分性标准一致。
2015年,中国医学科学院生物医学工程研究所的李迎新、王储记带领的团队以呼吸丙酮为研究对象,报道了149名II型糖尿病受试者和32名健康受试者的呼吸丙酮测试[11]。研究结果显示,II型糖尿病人的平均呼吸丙酮值高于健康人的平均呼吸丙酮值。这是人体呼吸丙酮实验基于百例以上的测试,为“丙酮是否可以作为糖尿病的呼吸标记物”这一长期困扰该领域的问题进行了初步论证,也为该问题的解决提供了一个可行性方案。2016年,该团队基于自主研发的第二代CRDS呼吸丙酮分析仪,对386名受试者的1212例呼吸丙酮浓度进行测量,其中I型糖尿病(TD1)受试者22名、II型糖尿病(TD2)受试者312名、健康受试者52名,分析结果[10]如

图 7. 排除酮症外的20名I型糖尿病受试者的个体呼吸丙酮浓度和平均血糖浓度的线性关系
Fig. 7. Linear relation of the breath acetone concentrationwith the mean blood glucose level in 20 TD1 subjects with no ketoacidosis
5 激光光谱技术在该领域应用的挑战
尽管激光光谱技术在呼吸气体分析领域的应用不断发展,但是该技术在呼吸分析方面依然面临着几个挑战:仪器的总体成本、光谱干扰、呼气样本本身的误差以及大量数据的有效获取。
激光光谱技术最大的成本来自于光源。目前通信行业常用的半导体激光器的成本很低,但是其波长大多集中在近红外波段。与紫外及中红外区域相比,相应气体分子在此波段的吸收强度较低。而目前大多紫外和中红外激光光源的成本高、体积大,完全不适合未来即时检测(POCT)仪器商用的发展。例如,目前常用的YAG抽运染料激光器、光学参量振荡(OPO)激光系统等中红外光源仅仅适用于实验室呼吸分析。抽运猝灭腔染料激光技术(QCDL)在过去十年中取得了快速发展。该激光器可以在非低温条件下操作,相比之前的中红外光源,其成本已大大降低[18-20]。
激光光谱技术在呼吸气体分析领域应用的干扰主要来源于两方面:光谱干扰和生物干扰。光谱干扰取决于生物标志物的光谱“指纹”的选择。在不考虑仪器成本的前提下,大多生物标记物在近红外光谱区域的“指纹”特征都不如在紫外或中红外区域明显。这是因为呼出气体中水蒸气丰富的近红外吸收和所有C—H在近红外区域的伸缩振动泛频光谱的干扰。此外,可以通过对比,找到不与其他分子吸收重叠的近红外光谱“指纹”,但是这将会直接影响整个系统的灵敏度。
呼出气体样本本身的误差是另一个需要解决的问题。传统采样袋引入气体的方式会带来误差,因此直接呼入法是未来的发展趋势。研制适用于直接呼入的仪器是一个需要解决的问题。除此之外,人体呼出的气体中含有外部空气和肺泡空气。考虑到样本的混合,在呼出气体样本中,通常用于分析的内源性VOCs的浓度低于肺泡中的空气浓度。为此,美国胸科协会推荐了一个标准化的程序动作。但是如何更好地处理呼吸取样,实现所需样品与干扰样品的有效分离,是该领域面临的又一个挑战。
大量数据的有效获取是对基于激光光谱技术的呼吸气体分析仪提出的一个要求。因为任何潜在的、有用的呼吸生物标记物,要实现与现有临床检验参数的定量相关性,必须基于大量的有效数据。例如,可以采用CRDS技术的呼吸分析仪获得一个I型糖尿病人准确的、实时的呼吸丙酮浓度,但如果要确定呼吸丙酮浓度与血糖之间的定量相关性,仅仅通过22名I型糖尿病受试者的数据是远远不够的。这需要大量受试者的呼吸丙酮数据和血糖数据才可以完成。
6 结束语
从整个呼吸气体分析领域的现状来看,尽管不断有高水平的研究成果涌现,但其临床使用仍处于起步阶段。而激光光谱技术在该领域的应用是最新的进展[21-27]。在某种程度上,需要推进现代通信产业进程和开发出光谱覆盖更宽的半导体激光器。虽然当前的新型激光源对于家用呼吸气体分析仪而言成本较高,但是与传统MS技术相比,其综合成本明显降低。此外,现代镀膜技术的不断发展使高反镜的成本不断降低,因此CRDS及其衍生技术的成本有望降低。这些发展都将加速基于激光光谱技术的呼吸气体分析仪从实验室研究进入临床试验的进程。
[4] 应可净, 黄强. 呼吸气体检测在肺癌早期诊断中的应用[J]. 国际呼吸杂志, 2006, 26(2): 143-145.
[6] 童敏明, 王莹, 李娇, 等. 新型丙酮分析仪的研究[J]. 仪表技术与传感器, 2007( 1): 16- 17.
Tong MM, WangY, LiJ, et al. Study on new instrument for analysis of acetone[J]. Instrument Technique and Sensor, 2007( 1): 16- 17
[9] 林丽泉, 董浩, 王福园, 等. 呼气检测技术与设备的研究进展[J]. 中国医疗设备, 2016, 31(2): 11-17.
[12] 彭秋莲, 李满华. 激光光谱气体分析技术在医学诊断中的研究进展[J]. 应用激光, 2008, 28(4): 341-344.
[14] 刘乔, 蒋天伦, 孟坤, 等. 用于人体呼出气体分析的THz光谱技术[ C]. 全国太赫兹科学技术与应用交流会, 北京, 2012: 487- 496.
[16] MetsaelaeM. Optical techniques for breath analysis: From single to multi-species detection[J/OL]. Journal of Breath Research[2017-11-01].https://www.researchgate.net/publication/319492842_Optical_techniques_for_breath_analysis_from_single_to_multi-species_detection.
Article Outline
姜琛昱, 孙美秀, 李迎新, 王储记. 激光光谱技术在呼吸气体分析中的发展与未来[J]. 中国激光, 2018, 45(2): 0207015. Jiang Chenyu, Sun Meixiu, Li Yingxin, Wang Chuji. Breath Analysis Using Laser Spectroscopy Techniques: Development and Future[J]. Chinese Journal of Lasers, 2018, 45(2): 0207015.