基于内标法的表面增强拉曼散射定量分析  下载: 1767次
下载: 1767次
1 引言
表面增强拉曼散射(SERS)是一种高效的分子光谱检测技术,通过激发金属纳米结构表面分子间的相互作用使分子拉曼信号得到极大的增强。该现象由英国科学家Fleischmann等[1]在粗糙的银电极表面对吡啶分子Raman检测中首次发现。大量实验和理论表明,这种增强效果受两种主要因素影响:金属纳米结构间的局域电磁场增强(EM) [2-3]以及基底与分子间电荷转移的化学增强(CE) [4-5]。微纳加工技术和表面的等离子体的快速发展,为SERS光谱在材料和生命科学[6-8]、环境监测[9-10]、食品安全[11-13]、药物分析[14-16]等领域带来了更大的活力和机遇。
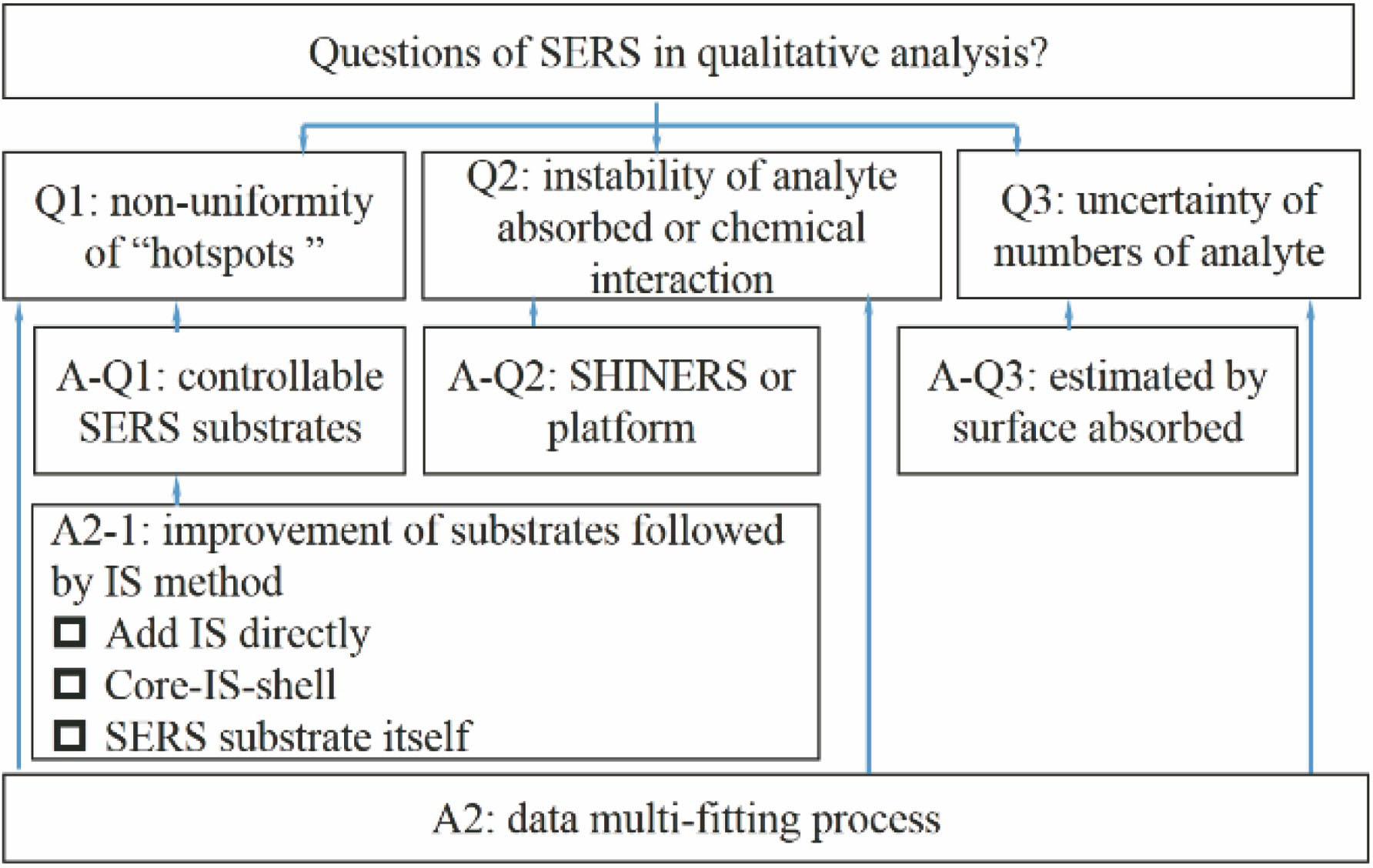
一方面,SERS可以达到单分子灵敏度;另一方面,可以实现对分析物的定量检测,这一应用尤为重要,尤其是在某些特定领域,例如持续释放中药物的体内监测、质量控制中污染物的原位检测等。然而SERS的可靠性依赖于基底的合理设计、样品的制备、对测试条件精准的控制以及充分的数据分析。目前在SERS的量化过程中仍然存在三个主要问题:1)金属纳米结构产生“热点”不均匀性引起的信号波动;2)吸附分子取向波动或化学相互作用导致光谱的不稳定性;3)吸附分子数量的不确定性。
针对上述问题1),研究人员主要从改善基底的稳定性方面进行研究,开发和制备各种形状尺寸可控的SERS基底。针对上述问题2),为了获得更稳定的SERS光谱,研究人员开发了壳核纳米结构(SHINERS),能有效避免吸附分子与金属纳米粒子的直接接触(避免化学作用的影响),并且能够提供特定的吸附表面[17]。针对上述问题3),通常根据SERS基底的表面粗糙情况、吸附面积和检测分析物分子的体积,在均匀吸附假设下进行估算。
2 内标法
本文将主要针对“热点”效应引起的信号波动问题介绍三种内标物(IS)添加的模式,主要思路如
2.1 “热点”效应
目前普遍认为,SERS由两种增强机制共同作用:表面等离子体共振(SPR)引起的EM和源自吸附分子和基底之间电荷转移的CM。两者共同作用于SERS过程中,提高SERS的灵敏度的同时也给SERS的定量分析带来了更大的困扰。SERS光强ISERS可以描述为[18]
式中:M1为由普通等离子体模式产生的EM场增强因子;M2为等离子体天线的共振发射导致的辐射因子[2, 19];ωL为入射光频率;ωR为拉曼散射光频率;β为分子所处位置的激发光的电场方向;β'为拉曼散射光的电场方向;(αβ,β')fi为某始态|i ñ经中间态|r ñ到达终态|f ñ的极化率张量。式中前半部分表示EM机制对ISERS的增强,后半部分是CM机制对ISERS的增强。但这仅是理论上的推导,在实际实验中的探测光强是探测区域内的平均光强,仍然存在很多不可控的因素,如基底上实际“热点”的分布和大小、基底上的化学作用或者分子的吸附方式。
“热点”:对于间隔紧密的金属纳米粒子,电场高度局限于纳米颗粒间隙。因此,诸如此类的粒子间电磁场耦合作用被称为电场增强的“热点”。对于AuNPs-AgNPs的聚集体可以使SERS增强达到1014倍[20]。Fang等[21]指出极少数位于“热点”中的分子就可贡献整个SERS强度的24%。因此,在常规SERS测量环境条件下,分子很容易扩散且离开热点,并导致SERS信号发生显著变化(在单分子SERS中观察到的眨眼效应)[22]。由于纳米结构的控制不易,很难采用简单的手段在基底上获得均匀的“热点”分布,因此SERS在分析物定量检测过程中存在很大的挑战,并且分子的吸附方式也会对分析物定量检测产生很大的影响[23]。常用来固定表面分子的三种策略包括[6,24-25]:1)静电和疏水相互作用,2)主客体相互作用,3)生物分子识别,如抗体-抗原、核酸对及适体-靶分子等。理想的情况是构造一个能均匀吸附分子的“热表面”,这是极具有挑战性的。
2.2 SERS内标法原理
式中:σ'RS为吸附分子的拉曼散射截面(分子固有性质);I0为入射光强度;N为处于“热点”中的吸附分子数;量化过程中可以近似为M1=M2;C为一个常数。又因内标分子和分析物分子经历相同的增强效果,所以理论增强因子近似相等,在活性基底增强因子上表现为一个常数。最终得到归一化的相对强度k仅与分析物分子数相关,从而有效避免了基底不均匀带来的信号波动。
2.3 内标法中需要考虑的问题
2008年,Bell等[27]总结了过去的SERS的发展,其中主要包括内标法和多元数据分析等方法在SERS定量中的研究。理论上内标法能够有效解决SERS定量检测中的难题,但必须满足两个简单假设:一是相对光谱强度随吸附物质的数量线性变化,二是内标分子和分析物分子必须经历相同的增强过程。所以在实验过程仍然需要考虑以下几点问题:
1) 分析物分子的均匀吸附:拉曼散射强度与分子的表面覆盖率成正比,分子的均匀吸附能有效改善基底的均匀性,能够更好地确定分子数。常在SERS基底表面提供一个分子吸附平台,以典型二维吸附平面-石墨烯(GE)为例,通过π—π键使得分析物分子能够均匀吸附于GE表面[28-29]。
2) 分子层厚度对内标法实验的影响:较低浓度下可近似认为表面覆盖度与浓度成正比,但浓度较高时表面分子吸附已经饱和,不再是线性变化[30]。同样考虑到“热点”的表面效应,电磁场增强在几个纳米内迅速衰减。因此,在亚单层吸附水平上能更准确地实现定量检测。分子吸附模型由吸附平台和分子类型决定[30-32]。
3) 低浓度检测对增强因子的要求:上述2)表明在低浓度亚单层的情况下定量结果更加精确,故也需要对基底的增强因子提出要求。简单的贵金属纳米结构能够提供较高的拉曼增强特性,此外双金属壳核结构[33]、借用SERS活性策略[34]、复合其他纳米材料基底[35]等也能获得足够的增强因子。同时也提高了检测极限和探测灵敏度。
4) 经历相同的增强过程:为了校准信号能准确反映基底对信号带来的波动,则要求内标物经历和分析物相同的增强过程。目前有三种内标物添加模式可以满足该基本假设,其中包括外部添加模式、内部添加模式和基底自标定模式。
5) 内标分子的选择:内部添加模式和基底自标定模式中为了避免峰叠加带来的干扰,通常选择校准峰远离分析物拉曼窗口的内标分子,如远离生物分子拉曼区的碳纳米材料的2D峰、位于520 cm-1的Si峰等。而在外部添加模式中考虑到环境对内标物的选择,分析物同位素作为内标物是最好的选择。
3 基底的改善
为了内标法更好地应用于定量分析,其中关键的第一步是改善基底本身的均匀性。改善的方向分为:1)改善基底的均匀性(物理稳定性);2)改善基底的化学稳定性。
3.1 基底均匀性改善
3.2 壳核结构对于基底化学性能的改善
为了避免化学效应对SERS光谱带来的干扰,采用壳核结构作为保护层来隔绝SERS活性内核与外部环境的干扰,同时选择不同的壳材料,作为SERS活性基底的功能化或吸附平台。
1) 作为保护层:厦门大学的田中群小组[18]将材料扩展到过渡金属(如Pt,Ru,Rh,Pd,Fe,Co,Ni及其合金)以及各种壳核结构,称之为SHINERS。他们利用超薄化学惰性的外壳涂层保护SERS活性内核,能有效避免探测分子与活性内核接触而导致SERS光谱的不稳定性,借用贵金属内核的SERS活性能够获得较高的增强效应,同时也能避免化学效应给SERS定量检测带来的干扰。如
2) 作为粒子功能化或吸附平台:如
![壳核结构对于SRES性能的改善:(a)壳作为保护层以避免化学效应的影响[17]; (b)壳作为粒子功能化或分子吸附平台[36];(c)碳纳米材料包裹金属纳米粒子在生物科学中的应用[42-43]](/richHtml/lop/2020/57/3/030002/img_4.jpg)
图 4. 壳核结构对于SRES性能的改善:(a)壳作为保护层以避免化学效应的影响[17]; (b)壳作为粒子功能化或分子吸附平台[36];(c)碳纳米材料包裹金属纳米粒子在生物科学中的应用[42-43]
Fig. 4. Shell core structure improves the performance of SERS substrate: (a)Shell acts as a protective layer to avoid the effects of chemical effects[17]; (b) shell acts as a particle functionalization or molecular adsorption platform[36]; (c) application of carbon nanomaterials wrapped metal nanoparticles in biological science[42-
4 内标法用于SERS定量检测
综合近年来有关SERS定量检测的报道,如

图 5. 三种内标物添加模式。(a) A:外部添加模式,包括直接添加内标物或添加标记分子;(b) B:核-内标分子-壳模式;(c) C:自标定复合基底
Fig. 5. Three internal standard addition modes. (a) A: External addition mode, including add internal standards directly or add labeling molecules; (b) B: core-internal standard-shell modes; (c) C: self-calibrating substrate
表 1. 三种内标模式下的结构、内标物和性能
Table 1. Structure, internal standard and performance in three internal standard modes
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.1 外部添加模式:直接添加或添加标记
本研究将直接在分析物中添加内标分子或者标记分子[33]归结为外部添加模式。2008年,聂书明教授[44]采用添加标记分子的方法,定量分析了金纳米粒子在肿瘤细胞内的聚集效率,随后很多课题组拓展了其应用领域。吉林大学Chen等[45]利用蛋白质在碱性环境中将Cu2+还原成Cu+,再通过二喹啉甲酸(BCA)与Cu+结合制备出BCA-Cu+复合结构,从而实现蛋白质的定量分析。该方法可以非常准确地检测出溶液中蛋白质浓度,为生物科学和医学诊断领域带来新的进展。华南师范大学Dong等[46]将4,4’-联吡啶(DP)标记物与胸腺嘧啶(T)适配体修饰到金纳米粒子上,制备了纳米传感器。利用其特异性吸附性,在三聚氰胺分子和胸腺嘧啶分子之间通过多氢键形成T-M-T结构,对牛奶中三聚氰胺进行了高灵敏度定量分析。苏州大学He等[47]利用石墨烯-金纳米粒子复合结构基底对修饰了Cy3染料分子的DNA分子进行定量分析。在单激光激发下,可以在同一衬底上同时检测更多类型的靶向DNA分子。东南大学Wu等[48]通过直接添加SERS探针对多种蛋白质进行定量分析。在此,SERS探针与样品溶液中的靶蛋白竞争,与底物上的抗体结合,即:在样品中存在的蛋白质越多,抗体在底物上捕获SERS探针数目就越少,探针分子的信号强与蛋白质浓度呈明显负相关。
湖南大学Xia等[49]所在课题组通过直接添加内标物或添加标记的方式对在水污染方面进行了定量分析,其中包括:鱼塘水样中的孔雀石绿定量检测;环境水样中的Cd2+的定量分析[50];河水中氨苄青霉素的定量检测[51]。
2005年,Zhang等[52]报道了一种SERS与同位素编辑内部校准(IEIS)[53]相结合的检测方法。该种方法的优点在于样品和参考物具有相似的化学性质,从而最大限度地减少了与光学性质差异、标记效率或底物有关的量化误差。缺点在于两种分子对于吸附位点存在竞争。此后还有2017年,Subaihi等[54]利用SERS结合同位素标记化合物(ILC)作为一种内部校准,并对色氨酸和咖啡因的SERS光谱进行了定量分析。2018年,Freeman等[8]报道了一种潜在的无标签DNA成分检测方法,使用SERS技术在单链DNA中识别胞嘧啶和腺嘌呤的成分。这种方法依赖于每个核苷酸有一个磷酸骨干,并作为拉曼信号的内部参考增强信号的可靠性。
该模式具有简单、快速和高灵敏度的优势,但是,在外部添加模式下内标物通常会影响甚至取代分析物分子的表面吸附位点,最好的选择是采用目标分析物本身的同位素作为内标物。然而,这种内标物质很难获得并且成本也很高。
4.2 核-内标分子-壳模式
将内标分子嵌入壳核结构中间,能有效地保证内标分子经历的增强效果与分析物分子近似一致。换句话说,内标物SERS信号的波动完全反映了基底的不均匀性。2015年, Shen等[55]设计了分子层中含有两种组分的核-分子-壳纳米粒子,嵌入式拉曼探针的信号为校正样品的波动和仪器参数的漂移提供了有效的反馈。对靶分子的定量分析表明,较大浓度范围内相对SERS强度随表面覆盖的响应呈线性关系。2018年,Wu等[56]以金纳米棒为核心设计了一种至少可以捕获两种SERS标记的合成核心内标壳(CISS)的Au@Ag纳米立方体。通过对罗丹明6G(R6G)的检测,得到3×10-11~10-8 mol/L浓度范围内良好的线性关系,进一步提高了SERS分析的可靠性。
2018年,湖南大学Zhang等[57]首次将多内标度的概念引入SERS定量分析中,将独特的谱形变(SSD)定量理论与多内标度嵌入核壳纳米粒子相结合,对苹果果皮磷残留量进行了定量分析。该方法的优点在于多内标为SERS光谱提供了更多的特征值,在数据分析过程中能够实现对未知浓度更准确的预测。
该结构也避免了分析物分子与内标分子在SERS活性表面的吸附竞争。但其缺点在于制备过程相对复杂,内标物的选择受到制备方法的限制。另一方面,电磁增强在惰性纳米壳间迅速衰减,需以牺牲基底灵敏度为代价来换取基底的稳定性。
4.3 基底自标定模式
基底自标定模式与其他两种添加模式的主要区别在于:其出发点旨在提高基底性能,校准信号来源于基底本身材料或者其他高性能材料复合材料。类似壳核结构,在固相基底表面同样可以复合其他纳米材料来获得想要的性能。例如典型的石墨烯介导表面增强拉曼散射增强(G-SERS)[58],同时具备高SERS活性和石墨烯优异的表面性能,其自身的拉曼信号也能够作为反映基底波动性的内部校准。
1) 复合碳纳米材料作为自标定:2016年,Zou等[59]报道了一个内标物由SERS基底材料本身提供的SERS定量检测方案。大量的金纳米粒子(AuNPs)修饰在多层石墨磁纳米胶囊(AGNs)上,AGNs从石墨化组分中表现出独特的拉曼带,位于生物分子的拉曼沉默区。该基底提供了一种不受背景干扰的定量拉曼分析的理想方法。2017年,Tian等[30]制备了G-SERS基底,其中石墨烯作为分子均匀吸附平台,用于建立内标信号。基于G-SERS基底,他们在水溶液中对探针分子进行了原位定量检测,检测极限达到10-8 mol/L。同时,实时、原位监测了罗丹明B分子的释放过程,以模拟药物的扩散。结果表明该方法在食品安全、药物检测和环境检测等方面具有广泛的应用前景。2018年,重庆大学Zhang课题组[35, 60]相继报道了碳纳米、石墨烯等碳纳米材料和金属纳米颗粒复合结构在SERS定量检测过程中应用。
2) 基底本身的Si信号作为内标:除碳纳米材料复合基底以外,基底本身的Si信号同样可以作为基底的自标定。2015年,Peksa等[61]在纳米球(FON)硅模板上获得了高度均匀的金纳米结构,并以来自硅载体的拉曼信号作为内标校准,定量检测了7种商用甜饮料饮料中偶氮玉红(Azorubine)的浓度。该方法提供了一种简单快速(35 min)的SERS途径,容易实现现场食品饮料的安全检测。2018年,Sophie等[32]利用支撑材料Si的拉曼信号作为内部标准,在sub-μmol/L范围内定量检测了磺胺甲恶唑。并根据Langmuir-Freundlich吸附模型,研究了该分子在金属表面的吸附行为。
3) 其他:2017年,Wei等[62]提出了一种基于表面等离子体增强瑞利带强度的方法,这一方法反映了基板本身的增强能力,并且与SERS强度存在一定的相关关系。
该模式的出发点源自对基底性能的改善,所以相比其他两种模式更具优势。该模式同时具备直接添加模式中简单、快速、高灵敏度的优点,拥有均匀的分子吸附平台,基于类似壳核结构改善了基底化学性能,避免了内标分子竞争。
4.4 内标法用于SERS定量的局限性
此外,内标法应用于拉曼光谱的定量分析时,虽部分解决了拉曼信号波动的问题,但其本身也存在一些缺点,比如由于热点的随机分布、金属表面的分子吸附不均,基底的重现性比较差。SHINERS技术虽然很先进,但是制备技术很复杂,导致目前实用受限。因此,SERS的定量分析仍未用于实际检测。近年来,纳米制造技术的发展,如纳米压印光刻[63]、电子束光刻[64]等,使制备具有均匀纳米结构的SERS基底成为可能,不同批次样品的差异逐渐缩小,大幅度提高了基底的重现性。再进一步结合内标法,有望将SERS技术用于实际的定量分析检测。
5 结束语
SERS的定量检测受到人们各方面的关注,在生物细胞、人类医疗、环境原位检测和药物分析等方面具有重要意义。然而内标法结合数据分析能够获得可靠的分析定量信息,并对未知浓度作出准确预测。相较而言,核-内标分子-壳在细胞内部监测或生物成像等方面具有优势,而自标定基底在环境原位监测、药物分析等方面更灵敏、方便、快捷。在实际应用中需要设计不同的SERS活性结构或复合新纳米材料来应对环境,解决SERS定量难的问题。将SERS技术与微流控、波导增强、拉曼成像、化学计量分析等技术相结合,推动了SERS技术在科学研究与日常生活中的应用。
[1] Fleischmann M, Hendra P J. McQuillan A J. Raman spectra of pyridine adsorbed at a silver electrode[J]. Chemical Physics Letters, 1974, 26(2): 163-166.
[2] Ding S Y, Yi J, Li J F, et al. Nanostructure-based plasmon-enhanced Raman spectroscopy for surface analysis of materials[J]. Nature Reviews Materials, 2016, 1(6): 16021.
[3] Pitarke J M, Silkin V M, Chulkov E V, et al. Theory of surface plasmons and surface-plasmon polaritons[J]. Reports on Progress in Physics, 2007, 70(1): 1-87.
[4] Jensen L, Aikens C M, Schatz G C. Electronic structure methods for studying surface-enhanced Raman scattering[J]. Chemical Society Reviews, 2008, 37(5): 1061-1073.
[5] Persson B N J, Zhao K, Zhang Z Y. Chemical contribution to surface-enhanced Raman scattering[J]. Physical Review Letters, 2006, 96(20): 207401.
[6] Zong C, Xu M X, Xu L J, et al. Surface-enhanced Raman spectroscopy for bioanalysis: reliability and challenges[J]. Chemical Reviews, 2018, 118(10): 4946-4980.
[7] 赵畅, 李蓉, 杨荟楠, 等. 基于表面增强拉曼光谱测量尿液样本中血小板衍生生长因子-BB[J]. 中国激光, 2017, 44(8): 0811002.
[8] Freeman L M, Pang L, Fainman Y. Self-reference and random sampling approach for label-free identification of DNA composition using plasmonic nanomaterials[J]. Scientific Reports, 2018, 8: 7398.
[9] Sharma B, Frontiera R R, Henry A I, et al. SERS: materials, applications, and the future[J]. Materials Today, 2012, 15(1/2): 16-25.
[10] 史晓凤, 张心敏, 严霞, 等. 基于三维表面增强拉曼基底的水中多环芳烃检测[J]. 光学学报, 2018, 38(7): 0724001.
[11] Li Y S, Church J S. Raman spectroscopy in the analysis of food and pharmaceutical nanomaterials[J]. Journal of Food and Drug Analysis, 2014, 22(1): 29-48.
[12] Li M, Cushing S K, Wu N Q. Plasmon-enhanced optical sensors: a review[J]. The Analyst, 2015, 140(2): 386-406.
[13] 马海宽, 张旭, 钟石磊, 等. 基于静电富集-表面增强拉曼光谱联用技术的抗生素检测[J]. 中国激光, 2018, 45(2): 0207028.
[14] 卢树华, 王照明, 田方. 表面增强拉曼光谱技术在毒品检测中的应用[J]. 激光与光电子学进展, 2018, 55(3): 030004.
[15] Geiman I, Leona M, Lombardi J R. Application of Raman spectroscopy and surface-enhanced Raman scattering to the analysis of synthetic dyes found in ballpoint pen inks[J]. Journal of Forensic Sciences, 2009, 54(4): 947-952.
[16] Berger A G, White I M. Therapeutic drug monitoring of flucytosine in serum using a SERS-active membrane system[J]. Proceedings of SPIE, 2017, 10081: 1008104.
[17] Li J F, Anema J R, Wandlowski T, et al. Dielectric shell isolated and graphene shell isolated nanoparticle enhanced Raman spectroscopies and their applications[J]. Chemical Society Reviews, 2015, 44(23): 8399-8409.
[18] Tian Z Q, Ren B, Wu D Y. Surface-enhanced Raman scattering: from noble to transition metals and from rough surfaces to ordered nanostructures[J]. The Journal of Physical Chemistry B, 2002, 106(37): 9463-9483.
[19] Yoshida K, Itoh T, Tamaru H, et al. Quantitative evaluation of electromagnetic enhancement in surface-enhanced resonance Raman scattering from plasmonic properties and morphologies of individual Ag nanostructures[J]. Physical Review B, 2010, 81(11): 115406.
[20] Xu H X. Theoretical study of coated spherical metallic nanoparticles for single-molecule surface-enhanced spectroscopy[J]. Applied Physics Letters, 2004, 85(24): 5980-5982.
[21] Fang Y, Seong N H, Dlott D D. Measurement of the distribution of site enhancements in surface-enhanced Raman scattering[J]. Science, 2008, 321(5887): 388-392.
[22] Le Ru E C, Etchegoin P G. Single-molecule surface-enhanced Raman spectroscopy[J]. Annual Review of Physical Chemistry, 2012, 63(1): 65-87.
[23] Moskovits M. Surface-enhanced Raman spectroscopy: a brief retrospective[J]. Journal of Raman Spectroscopy, 2005, 36(6/7): 485-496.
[24] Yamamoto Y S, Ozaki Y, Itoh T. Recent progress and frontiers in the electromagnetic mechanism of surface-enhanced Raman scattering[J]. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2014, 21: 81-104.
[25] Szlag V M, Rodriguez R S, He J Y, et al. Molecular affinity agents for intrinsic surface-enhanced Raman scattering (SERS) sensors[J]. ACS Applied Materials & Interfaces, 2018, 10(38): 31825-31844.
[26] 尹增鹤. 碳纳米管/石墨烯/金属纳米复合结构增强拉曼散射自标定特性研究[D]. 重庆: 重庆大学, 2019.
Yin ZH. Carbon nanotubes/graphene/metal nanoparticles with self calibration for enhanced Raman scattering[D]. Chongqing: Chongqing University, 2019.
[27] Bell S E, Sirimuthu N M. Quantitative surface-enhanced Raman spectroscopy[J]. Chemical Society Reviews, 2008, 37(5): 1012-1024.
[28] Su Y D, Han H L, Cai Q, et al. Polymer adsorption on graphite and CVD graphene surfaces studied by surface-specific vibrational spectroscopy[J]. Nano Letters, 2015, 15(10): 6501-6505.
[29] Lazar P, Karlicky F, Jurecka P, et al. Adsorption of small organic molecules on graphene[J]. Journal of the American Chemical Society, 2013, 135(16): 6372-6377.
[30] Tian H H, Zhang N, Tong L M, et al. In situ quantitative graphene-based surface-enhanced Raman spectroscopy[J]. Small Methods, 2017, 1(6): 1700126.
[32] Patze S, Huebner U, Weber K, et al. TopUp SERS substrates with integrated internal standard[J]. Materials, 2018, 11(2): 325.
[33] Weatherston J D, Worstell N C, Wu H J. Quantitative surface-enhanced Raman spectroscopy for kinetic analysis of aldol condensation using Ag-Au core-shell nanocubes[J]. The Analyst, 2016, 141(21): 6051-6060.
[34] Li J F, Huang Y F, Ding Y, et al. Shell-isolated nanoparticle-enhanced Raman spectroscopy[J]. Nature, 2010, 464(7287): 392-395.
[35] Zhang J, Yin Z H, Zhang X L, et al. Quantitative SERS by electromagnetic enhancement normalization with carbon nanotube as an internal standard[J]. Optics Express, 2018, 26(18): 23534-23539.
[36] Tian ZQ, RenB, Li JF, et al. Expanding generality of surface-enhanced Raman spectroscopy with borrowing SERS activity strategy[J]. Chemical Communications (Cambridge, England), 2007( 34): 3514- 3534.
[37] Velleman L, Scarabelli L, Sikdar D, et al. Monitoring plasmon coupling and SERS enhancement through in situ nanoparticle spacing modulation[J]. Faraday Discussions, 2017, 205: 67-83.
[38] Gong T C, Luo Y F, Zhao C W, et al. Highly reproducible and stable surface-enhanced Raman scattering substrates of graphene-Ag nanohole arrays fabricated by sub-diffraction plasmonic lithography[J]. OSA Continuum, 2019, 2(3): 582-594.
[39] Yan B, Boriskina S V, Reinhard B M. Design and implementation of noble metal nanoparticle cluster arrays for plasmon enhanced biosensing[J]. The Journal of Physical Chemistry C, 2011, 115(50): 24437-24453.
[42] Bian X, Song Z L, Qian Y, et al. Fabrication of graphene-isolated-Au-nanocrystal nanostructures for multimodal cell imaging and photothermal-enhanced chemotherapy[J]. Scientific Reports, 2014, 4: 6093.
[43] Lai X F, Zou Y X, Wang S S, et al. Modulating the morphology of gold graphitic nanocapsules for plasmon resonance-enhanced multimodal imaging[J]. Analytical Chemistry, 2016, 88(10): 5385-5391.
[44] Qian X M, Peng X H, Ansari D O, et al. In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags[J]. Nature Biotechnology, 2008, 26(1): 83-90.
[45] Chen L, Yu Z, Lee Y, et al. Quantitative evaluation of proteins with bicinchoninic acid (BCA): resonance Raman and surface-enhanced resonance Raman scattering-based methods[J]. The Analyst, 2012, 137(24): 5834-5838.
[46] Dong N, Hu Y J, Yang K, et al. Development of aptamer-modified SERS nanosensor and oligonucleotide chip to quantitatively detect melamine in milk with high sensitivity[J]. Sensors and Actuators B: Chemical, 2016, 228: 85-93.
[48] Wu L, Wang Z Y, Zhang Y Z, et al. In situ probing of cell-cell communications with surface-enhanced Raman scattering (SERS) nanoprobes and microfluidic networks for screening of immunotherapeutic drugs[J]. Nano Research, 2017, 10(2): 584-594.
[51] Chen Y, Chen Z P, Jin J W, et al. Quantitative determination of ametryn in river water using surface-enhanced Raman spectroscopy coupled with an advanced chemometric model[J]. Chemometrics and Intelligent Laboratory Systems, 2015, 142: 166-171.
[52] Zhang D M, Xie Y, Deb S K, et al. Isotope edited internal standard method for quantitative surface-enhanced Raman spectroscopy[J]. Analytical Chemistry, 2005, 77(11): 3563-3569.
[53] Perera P N, Deb S K, Jo Davisson V, et al. Multiplexed concentration quantification using isotopic surface-enhanced resonance Raman scattering[J]. Journal of Raman Spectroscopy, 2010, 41(7): 752-757.
[54] Subaihi A, Xu Y, Muhamadali H, et al. Towards improved quantitative analysis using surface-enhanced Raman scattering incorporating internal isotope labelling[J]. Analytical Methods, 2017, 9(47): 6636-6644.
[55] Shen W, Lin X, Jiang C Y, et al. Reliable quantitative SERS analysis facilitated by core-shell nanoparticles with embedded internal standards[J]. Angewandte Chemie (International Ed. in English), 2015, 54(25): 7308-7312.
[56] Wu S R, Tian X D, Liu S Y, et al. Surface-enhanced Raman spectroscopy solution and solid substrates with built-in calibration for quantitative applications[J]. Journal of Raman Spectroscopy, 2018, 49(4): 659-667.
[57] Zhang X Q, Li S X, Chen Z P, et al. Quantitative SERS analysis based on multiple-internal-standard embedded core-shell nanoparticles and spectral shape deformation quantitative theory[J]. Chemometrics and Intelligent Laboratory Systems, 2018, 177: 47-54.
[59] Zou Y X, Chen L, Song Z L, et al. Stable and unique graphitic Raman internal standard nanocapsules for surface-enhanced Raman spectroscopy quantitative analysis[J]. Nano Research, 2016, 9(5): 1418-1425.
[60] Zhang J, Yin Z H, Gong T C, et al. Graphene/Ag nanoholes composites for quantitative surface-enhanced Raman scattering[J]. Optics Express, 2018, 26(17): 22432-22439.
[61] Peksa V, Jahn M, Štolcova L, et al. Quantitative SERS analysis of azorubine (E 122) in sweet drinks[J]. Analytical chemistry, 2015, 87(5): 2840-2844.
[62] Wei H R. McCarthy A, Song J, et al. Quantitative SERS by hot spot normalization-surface enhanced Rayleigh band intensity as an alternative evaluation parameter for SERS substrate performance[J]. Faraday Discussions, 2017, 205: 491-504.
[63] Ryu Y, Kang G M, Lee C W, et al. Porous metallic nanocone arrays for high-density SERS hot spots via solvent-assisted nanoimprint lithography of block copolymer[J]. RSC Advances, 2015, 5(93): 76085-76091.
Article Outline
邢豪健, 尹增鹤, 张洁, 朱永. 基于内标法的表面增强拉曼散射定量分析[J]. 激光与光电子学进展, 2020, 57(3): 030002. Haojian Xing, Zenghe Yin, Jie Zhang, Yong Zhu. Quantitative Analysis of Surface-Enhanced Raman Scattering Based on Internal Standard Method[J]. Laser & Optoelectronics Progress, 2020, 57(3): 030002.


![典型金属纳米结构[19,36-40]](/richHtml/lop/2020/57/3/030002/img_3.jpg)





