激光微加工技术制备生物医用器械的现状与进展  下载: 2433次
下载: 2433次
1 引言
激光微加工起源于半导体制造工艺,是通过超短脉冲激光切割、打孔、焊接等方法对材料进行加工,进而获得微纳米尺度二维(2D)或三维(3D)结构的工艺过程[1]。1976年首次在染料激光器中实现飞秒级的脉冲输出[2],使得激光微加工在技术上成为了可能,1981年激光输出脉冲宽度突破100 fs[3],1995年Pronko等[4]首次将波长为800 nm的飞秒激光应用于材料微加工。超短激光的脉冲宽度一般在皮秒(ps)到飞秒(fs)之间,短于绝大多数物理化学过程的特征时间,制造过程中可以达到调控电子状态并实现“冷加工”的目的[5]。相比于长脉冲激光,超短脉冲激光微加工是一个非线性、非平衡过程,阈值效应明显,热影响区极小,可控性高[6-9]。近年来,超短脉冲激光被广泛应用于微流体装置、微传感器、生物医疗等微纳制造领域[10-12]。尤其在生物医疗领域,激光可实现复杂精细的微纳结构加工,能够最大限度地满足生物医疗产品的某些特殊应用要求。在医疗器械加工应用中,传统的加工方法,如长脉冲激光加工、线切割、电火花放电加工、等离子喷涂、烧结、电化学沉积等,由于其高温、高酸或高碱性的加工环境,已不适用于生物材料医疗器械的加工。相比而言,超短脉冲激光微加工具有“冷”加工、能量消耗低、损伤小、准确度高、3D空间上严格定位等优点,在医疗器械加工中有着很好的应用前景。
生物医用材料虽然兼顾了材料的力学性能和生物化学性能,但很难拥有良好的表面性能,对加工方法的要求也极为严苛。植入物的生物相容性是生物医用材料最基本的要求。材料表面改性是提高医用材料生物相容性的有效手段。1999年,Nolte等[13]将钛宝石飞秒激光器的三倍频激光(260 nm)和扫描近场光学显微镜(SNOM)相结合,在金属镉膜表面刻出了线宽仅为200 nm的凹槽,为激光微加工在金属材料表面改性方面的研究奠定了基础。2005年,Liu等[14]利用超短脉冲激光微加工技术在胶原蛋白基质上加工出孔、槽和网格微结构,研究了人类纤维原细胞和白鼠间叶细胞在其表面的增殖、粘附和生存能力,展示了激光微加工在生物材料表面改性上的巨大潜力。无创或微创治疗技术是现代医学领域中的前沿课题,医疗微机电系统(MEMS)是最有可能实现无创或微创、精确安全、快速简便的医学检查、诊断、施药、治疗和手术的系统。利用多光子效应制备聚合物的超精细结构是飞秒激光应用的又一热点。2003年,Maruo等[15]利用负性光刻胶制造出了以光驱动的微型装置,利用激光束控制其尖端的开放和闭合实现了更精确的运动控制,展示了激光微加工在医疗微机电领域的诱人前景。2006年,Doraiswamy等[16]实现了微针、组织工程支架等3D微结构医疗器械的制备。自1994 年强生公司率先采用316L不锈钢管经激光雕刻加工出世界上首例冠脉支架以来,金属支架在临床治疗心血管狭窄等疾病上取得了令人瞩目的成就。但是金属支架的存在容易导致血栓形成、血管壁损伤、再狭窄等问题,因此,可降解生物材料的血管支架成为研究热点,而对可降解材料的加工是决定该类支架材料应用的关键问题。2002年,Ostendorf等[17]使用飞秒激光微加工技术在生物可降解聚合物材料上突破性地制备出血管内支架结构。
为系统展示超短脉冲激光微加工在生物医疗领域所取得的成就,本文对激光微加工技术在生物材料表面微加工、医学MEMS元件制备、血管支架加工以及生物支架快速成型等方面的研究和应用进行综述和展望。
2 生物材料表面微加工
生物材料表面特征会显著影响细胞的粘附、扩展、增殖、分化等行为[18-21],是影响材料生物相容性的重要因素。常规材料表面改性方法虽能提高生物活性物质的负载,但是存在工艺复杂、涂层在体内溶解速度快、涂层易断裂等问题[22]。激光微加工技术通过在材料表面快速加工出各种微观结构来改变其表面特征,通过变换微米粗糙度和横向间距的方法优化细胞的粘附与分化,从而在改变组织细胞生物特性方面有着重要的作用[23-25]。与其他表面改性方法相比,激光微加工技术改性的生物材料表面改性层薄,对基体影响小,克服了现有改性方法的缺点。
Koufaki等[26]利用飞秒激光扫描在单晶硅表面加工出粗糙度比为2.0~5.9的锥形表面微结构,通过转印方法将微结构复制到聚二甲基硅氧烷(PDMS)、聚乳-羟基乙酸(PLGA)和有机改性陶瓷(ORMOCER)材料表面,如
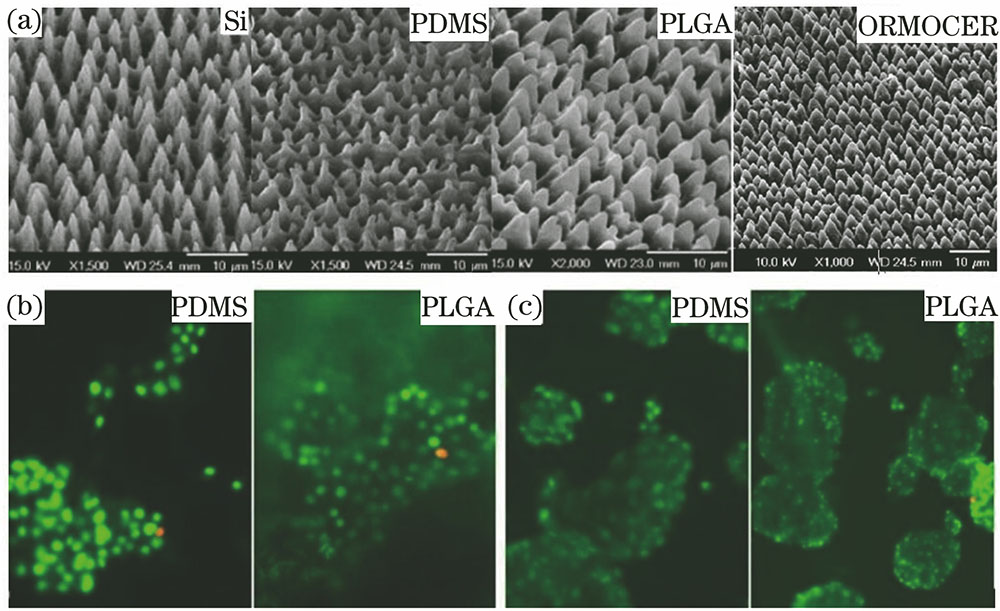
图 1. (a) 利用激光技术在单晶Si、PDMS、PLGA和ORMOCER表面制备的微结构;(b) NIH/3T3活细胞(绿色)和死细胞(黄-红色)在PDMS和PLGA结构表面的荧光显微图;(c) PC12活细胞(绿色)和死细胞(黄-红色)在PDMS和PLGA结构表面的荧光显微图
Fig. 1. (a) Laser created microstructures on the surface of single crystal silicon, PDMS, PLGA and ORMOCER; (b) fluorescence microscopy images of live (green) and dead (yellow-red) NIH/3T3 cells cultured on PDMS and PLGA micro-replicas; (c) fluorescence microscopy images of live (green) and dead (yellow-red) PC12 cells cultured on PDMS and PLGA micro-replicas
钛合金拥有良好的生物相容性,是骨组织修复等骨科疾病治疗的常用材料,研究组织细胞在Ti6Al4V合金表面的生物特性,对提高组织细胞在其表面的粘附性和成骨能力具有重要意义。王瑞等[27]利用飞秒激光在Ti6Al4V合金表面分别制得了纳米波纹结构和微米凸起与纳米波纹相结合的微纳复合结构,在合金结构表面培养成人骨样细胞素MG63,发现纳米波纹结构和微纳复合结构均能够促进细胞在合金表面的粘附性和增殖行为,而微纳复合结构的促进作用更为显著。Dumas 等[28]利用激光微加工技术研究了间充质干细胞(MSCs)在Ti6Al4V合金微纳结构表面的生物性能,如

图 2. (a) 飞秒激光在Ti6Al4V合金表面加工的微纳结构;(b) 细胞在抛光表面及A、B、C 3种结构表面扩展面积随时间的变化;(c) 细胞在抛光表面及A、B、C 3种结构表面培养12天时脂肪形成表达基因的相对值
Fig. 2. (a) fs-laser created micro/nano structures on Ti6Al4V surface; (b) area of cell spreading on the polished surface and surfaces with textures A, B or C versus time; (c) relative value of MSCs adipogenic genes expression on the polished surface and surfaces with textures A, B or C after 12 d
为了研究人类间充质干细胞(hMSCs)在Ti6Al4V合金微纳结构表面的生物特性,Cunha等[29]利用超快激光直写技术在合金表面加工出纳米波纹、纳米柱和微米柱等微纳结构,如

图 3. (a) 激光直写技术在Ti6Al4V表面制得的微纳结构;(b) hMSCs在A、B、C 3种微纳结构表面的形状
Fig. 3. (a) Micro/nano structures on Ti6Al4V surface fabricated via laser direct writing method; (b) hMSCs cell shape on the surface with textures A, B, C

图 4. (a) 经激光加工和酸洗在TC4表面产生的微纳结构;(b) 成骨细胞在TC4抛光表面(1)、微结构表面(2)、微纳结构表面(3)培养4 h后的黏附率
Fig. 4. (a) Micro/nano structures on TC4 surface created via laser and pickling process; (b) adhesion rates of osteoblasts after culturing for 4 h on TC4 samples with polished surface, microstructure surface and micro-nanostructure surface
Zhang等[30]使用激光微加工技术在钛合金(TC4)材料表面制得直径和深度分别为140 μm和35 μm的微坑阵列结构,经过酸洗之后在微坑表面形成宽度为0.5~2 μm的山脊形纳米结构,且在微坑内产生直径为20~100 nm的纳米孔集群,如
在组织工程学领域,研究细胞在生物材料表面的生物特性具有重要的意义,生物材料生物学性能的改进和提高,是当代生物医用材料发展的另一个重点。随着人们对生物材料表面界面的非特异性作用的不断了解,越来越多的研究人员认识到,只有在更加微观的尺度上实现对生物材料表面特异性生物活性作用的精确控制才是从根本上解决生物材料生物相容性的关键。激光微加工技术可在生物材料表面产生多种表面结构,如纯纳米结构、各种尺度的纳米、微米结合的复合结构,并可通过进一步激光微加工过程产生特有的、复杂的分层表面形貌。通过变换微米粗糙度、横向间距和其他微结构尺寸参数即可对细胞的粘附和分化进行优化。但是材料表面形貌的变化对细胞的影响比较复杂,其作用机理尚在探索之中,目前相关研究大部分仍处于实验室阶段,激光微加工对生物材料表面改性的效果还需要大量体内外实验进行相互验证。
3 医学微机电系统元件的制备
微机电系统技术是建立在微米、纳米技术基础上的21世纪前沿技术[33],自20世纪80年代应用于医疗行业以来,其相关技术和产品已覆盖到检测、诊断、治疗等生物医学领域。当前,MEMS加工技术主要是利用化学腐蚀或集成电路工艺对硅基材料进行加工的技术[34],但由于医疗用MEMS处理对象的特性与工业用的情况有很大的差别以及新技术、新材料在医疗领域的不断应用,传统的硅基加工方法已不太适用于医疗用MEMS的加工。与传统的硅基加工技术相比,激光微加工技术不仅适用于多种材料,而且能够加工出具有亚微米精度的3D微型结构,在医疗用MEMS的加工中有良好的应用前景。
使用高密度微电极阵列来唤起或记录神经活动是神经假体领域里一项非常复杂且重要的研究课题[35]。Green等[36]用传统的PDMS和铂(Pt)箔材料通过飞秒激光微加工技术加工出可移植的高密度微电极阵列,如

图 5. (a) 激光在PDMS和铂箔材料上加工的可移植高密度微电极阵列;(b) L929细胞在PDMS、铂箔和激光制备的微电极阵列结构上的相对增殖率(计算范围为细胞培养时间t=4 h至t=48 h)
Fig. 5. (a) Implantable high-density microelectrode array fabricated by laser-structuring of Pt foil and PDMS; (b) proliferation of L929 cells in direct contact with PDMS, Pt foil and the laser fabricated microelectrode array (The values are the rate of increase in cell number between t=4 h and t=48 h)

图 6. 激光在PDMS和Pt材料上加工的(a)多层微电极阵列及(b)其表面显微图
Fig. 6. (a) Multi-layer micro-electrode array fabricated by laser-structuring of Pt foil and PDMS and (b) its surface micrograph
氮化铝(AlN)材料在生物环境里的反应性很低,非常适用于制作生物相容性器件。以蓝宝石为基体材料,在AlN薄膜表面加工出波导阵列结构,可与微流体系统结合用于药物传送。Safadi等[38]利用准分子激光微加工技术在以蓝宝石为基体的AlN薄膜上加工出波导结构,该结构与微流体结合可在神经组织的药物传送方面发挥重要作用。通过研究激光脉冲数量和单脉冲能量对波导结构刻蚀速率的影响,结果表明,刻蚀速率随脉冲数量或脉冲能量的增加几乎呈线性关系增加。聚甲基丙烯酸甲酯(PMMA)和PDMS聚合物具有良好的生物相容性,是制备微流体生物器件的重要材料[39-40]。Criales等[41]利用激光微加工技术分别在PMMA和PDMS上制备了微通道结构,如

图 7. 应用激光微加工技术分别在PDMS和PMMA上加工的微流道结构。(a) PDMS; (b) PMMA
Fig. 7. Microchannels fabricated on PDMS and PMMA via laser micromaching, respectively. (a) PDMS; (b) PMMA
微创外科手术工具在生物医学诊断和治疗过程中扮演重要角色,而在很多微创外科手术工具中会涉及导管的使用。相比于传统的被动式导管,主动控制尖端式导管能够达到更高的精度和效率[42-43]。Lee等[44]通过激光微加工技术制备出聚吡咯(PPy)基人工肌肉驱动导管,并通过二维弯曲运动展示了所制取的四电极导管的可控性,如

图 8. 激光微加工制备的PPy基主动导管。(a) 四电极导管设计结构;(b) 激光微加工技术制备的四电极导管扫描电镜图;(c) 导管一端的PPy弯曲运动
Fig. 8. Laser fabricated PPy-based active catheter. (a) Designed model of four-electrode PPy-based active catheter; (b) scanning electron microscope photograph of four-electrode PPy-based active catheter fabricated via laser micromachining; (c) bend motion of PPy actuators strips on one end of the catheter
硅晶片是制备生物医学元件常用的生物材料,Wongwiwat等[45]研究了采用激光微加工技术在硅晶片表面加工的微通道阵列结构和方形结构对硅晶片生物特性的影响,表明硅晶片表面的微结构能够增强蛋白质的吸收。虽然这会促使心血管或血液相关的医疗器件在应用过程中产生血栓,但蛋白质吸收性能增强也可以促进细胞扩展,这对于生物医学移植微机电器件,如微芯片、压力传感器及给药系统等[46]的应用是非常有益的。通过进一步研究在激光微加工结构表面增加类金刚石(DLC)或聚乙二醇二丙烯酸(PEGDA)薄膜对蛋白质吸收特性产生的影响后,发现两种涂层均可显著降低微结构表面的蛋白质吸收性能。
3D形状的微纳纤维结构的制备问题一直是其在组织工程领域无法得到有效应用的难题[47]。Kim等[48]采用飞秒激光加工技术,在通过静电纺丝法[49]制取的3D微纳纤维结构上加工出3D孔隙结构,如

图 9. 在3D微纳纤维结构上制得的(a)孔隙阵列结构与(b)光学显微结构图;(c)激光微加工孔隙阵列结构表面的细胞分布共聚焦显微图像与(d)快速成型支架结构表面细胞分布SEM图,其中图(c)中蓝色代表细胞核,红色代表F-肌动蛋白
Fig. 9. (a) Porous arrays and (b) its optical microstructures on 3D micro/nanofibrous structure; (c) confocal microscope image of cell distributions on porous structures fabricated via laser micromachining (the blue and red colours indicate nuclei and F-actin, respectively ) and (d) SEM image of cell distributions on scaffold fabricated via laser rapid prototyping
周围神经再生元件是一种由聚D乳酸(PDLA)和聚乙烯醇(PVA)等生物材料制作而成的多层聚合物结构,其中PDLA薄膜在4~6个月可降解,而PVA薄膜在37 ℃条件下约两周内即可溶解。Kancharla等[50]在2002年首次利用激光微加工技术在PDLA和PVA薄膜上分别加工出宽度为10~65 μm、深约10~50 μm的微通道阵列结构和直径为5~10 μm的微孔阵列结构,此实验结果说明激光微加工技术应用于生物可降解微型医学器件制备是可行的。
生物医学元件的小型化,特别是从生物微器械到生物纳器械的转变,是研究人员必将面临的挑战[51]。在医疗器械的改善,疾病的预防、诊断及治疗方面,MEMS有着潜在的巨大应用前景。微小化是MEMS的重要特征,随着MEMS技术在生物医疗领域的不断发展,如何精准、快速地加工出日趋复杂和精密的元器件已成为MEMS在生物医疗领域发展的重要课题。激光微加工技术,使得传统微加工手段无法实现医用微机电产品,如医用导管、微芯片、给药系统等成为了可能。尽管激光微加工技术在生物医疗MEMS中的应用才刚起步,但基于激光烧蚀机理的脉冲激光直接微加工和激光立体平板印刷等技术得到越来越多的重视及研究,激光微加工技术必将推进MEMS在生物医疗上的广泛应用,并推动现代医疗工程的发展。
4 血管支架结构加工
血管支架植入是治疗动脉硬化等血管疾病的有效手段,通过扩张术使血管或腔体在狭窄或闭塞的情况下保证血液能够流入闭塞的动脉,而支架通常是由生物相容性较好的金属合金或有机聚合物加工而成的管网状结构假体[52-54]。金属心血管支架植入是目前治疗冠状动脉阻塞应用最多的方法。Kathuria等[55]使用短脉冲激光微加工方法在SS316L不锈钢环形管上加工出缝宽约100 μm、间距约200 μm的缝隙阵列结构,加工的支架切割表面具有良好的锐度和较低的表面粗糙度。黄远等[56]设计并利用脉冲激光微加工技术制作了如

图 10. (a)激光切割316L不锈钢血管支架与(b)局部结构的SEM图
Fig. 10. SEM photographs of (a) 316L stainless steel stent and (b) its local stent structure
表 1. 支架的溶血实验结果[56]
Table 1. Hemolysis experimental results of stent[56]
|
大多数支架都由金属制成,在植入后会永久存留在动脉中,存在引发严重医疗并发症的风险。为避免引起这类并发症,一个解决方案是使用聚左旋乳酸(PLLA)、聚乳酸(PLA)等材料制作而成的生物可吸收支架,但由于其熔点低,对热效应极其敏感,加工这种生物可吸收材料是一项极具挑战性的任务[60]。Stolberg等[61]利用飞秒激光切割制备出厚度为110 μm、三角切口边长为500 μm的方形PLLA薄片,如

图 11. 飞秒激光切割三角切口结构的(a)PLLA薄片和(b)局部结构
Fig. 11. (a) PLLA sheet with triangular cut-outs fabricated via fs-laser and (b) its zoomed local structure
激光微加工作为一种不受材料限制的无接触“冷”加工技术,极大地降低了加工过程中的熔融区、热影响区、冲击波等多种效应对周围材料造成的影响。利用超短脉冲激光加工支架能够获得精确的网格结构和光滑的切割表面,并使激光束能量对支架材料产生的热影响降到最小。激光微加工非热消融的加工方式,从根本上使得生物可吸收支架技术变得可行。但激光微加工的血管支架造价昂贵、产量较低,如何使用该技术实现血管支架工业化批量生产是研究人员亟需解决的难题。
5 生物支架快速成型
细胞组装技术是生物制造工程的核心,通过所制备支架的材料和结构影响细胞成长,从而间接控制细胞的组装,其关键就是3D基体支架的制造。支架的传统机加工制备方法难以形成微米级可控的孔隙结构,并且难以保证孔隙之间的完全贯通。自1993年Langer等[63]首次将快速成型技术应用于组织工程支架制备以来,快速成型技术在制造生物支架的微细结构方面取得了不断的进步与发展。
骨组织工程学旨在利用支架和细胞等修复损坏的骨组织[64]。支架作为临时的细胞粘附点并最终再生出软组织在修复损坏的骨组织方面有着重要的作用,同时也要具有与骨组织修复位置相似的力学性能和较好的生物相容性[65-67]。通过研究细胞在这些生物相容性材料表面或各种复杂的3D微观结构内部的生物特性是组织工程学领域的重要内容,对生物相容性材料在骨组织工程学领域的应用具有重要意义[68-72]。在骨组织支架或3D实体结构制备过程中,激光快速成型技术已逐渐成为一种重要的加工手段,这主要得益于激光技术的高度可控性和灵活性,制作精度高,几乎不受制作材料的限制,突破了传统制备方法的诸多约束[73-75]。
在治疗由于骨肿瘤、骨不连等造成大段骨缺损的疾病时,常使用植入体替代病患部位,以实现对大段骨缺损部位的修复。李祥等[76]利用激光光固化成型(SL)技术,使用磷酸钙制取了具有可控微管道结构的骨组织支架结构,如

图 14. (a) 利用SLS技术制备的PVDF支架结构;(b) PVDF支架在模拟体液中浸泡后的余重百分比随浸泡时间的变化曲线;(c) MG63在PVDF支架上培养1、3、5天后(从左至右)的生物活性
Fig. 14. (a) PVDF scaffold fabricated by SLS; (b) remaining weight percentage of PVDF scaffolds after immersed in simulated body fluid for different days; (c) bioactivity of MG63 cells after 1, 3, 5 d cultured on PVDF scaffolds (from left to right)
Shuai等[78]使用β-磷酸三钙(β-TCP)粉末(颗粒尺寸0.1~0.3 μm)通过SLS技术制作如

图 16. MG63和hBMSCs在不同晶粒度支架上的SEM形貌图。MG63:(a) 1.32 μm;(b) 0.71 μm;(c) 0.21 μm;hBMSCs:(d) 1.32 μm;(e) 0.71 μm;(f) 0.21 μm
Fig. 16. SEM morphology of MG63 and hBMSCs cultured onto scaffolds with different grain sizes. MG63 cells:(a) 1.32 μm; (b) 0.71 μm; (c) 0.21 μm; hBMSCs cells: (d) 1.32 μm; (e)0.71 μm; (f) 0.21 μm
Van Bael等[79]通过选择性激光熔化技术(SLM)制备了6种不同的Ti6Al4V骨支架实体结构,单元孔几何形状包括三角形、六角形和四边形,孔径为500 μm和1000 μm,壁厚设计值为200 μm,如

图 17. 利用SLM技术制备的不同尺寸与结构的骨支架结构
Fig. 17. SLM fabricated bone scaffold with different sizes and unit structures

图 18. 不同结构骨架(孔径为500 μm和1000 μm)培养细胞1,7,14天后的(a)DNA定量检测结果和(b)细胞代谢活性
Fig. 18. (a) DNA assay results and (b)metabolic activity of cells on different porous scaffolds with the diameters of 500 μm and 1000 μm after 1, 7, 14 d culturing
激光快速成型技术采用激光束对成型材料进行选择性快速扫描,使材料逐层堆积,逐渐形成具有各种内部微观结构的3D实体结构,其加工过程突破了材料内部复杂结构的限制,在制造生物支架的微细结构方面有着其他传统制造工艺不可比拟的优势[80],能够很好地解决传统工艺在成型多孔细胞载体支架结构方面存在的问题。随着激光微立体光刻等激光微成型技术的不断发展,激光微加工成型技术在制造生物医疗领域必将带来新一轮的技术革新。
6 结束语
医疗设备是具有高附加值的产品,在质量方面要求严格,通常要求采用挑战性的工业制造工艺。微加工是当今制造业最为活跃的研究方向之一,微机械技术的发展水平已经成为一个国家综合实力的衡量标准之一。激光微加工是一种高精度、绿色环保的无接触加工工艺,具有很好的灵活性和可控性,超短脉冲激光以其独特的脉冲持续时间短、峰值功率高等优越性能对传统的加工方法产生冲击,在生物医疗领域有着广阔的应用前景。激光微加工技术赋予生物材料新的结构和功能,充分调动人体自主修复的能力,实现被损坏的组织或器官的永久康复,已成为当代生物医学的发展方向。
本文总结了激光微加工技术用于研究生物材料表面组织细胞行为特性的最新研究成果,综述了其在医学MEMS、血管支架加工和3D生物支架结构快速成型等方面的最新应用。利用激光微加工技术改变生物材料表面微结构可以有效提高其生物相容性,增强细胞在微结构表面的粘附性能、增殖和扩展等行为特性。激光微加工技术在生物医学元器件的MEMS加工中扮演着越来越重要的角色,突破了传统加工技术无法实现的诸多约束,并推动医疗领域内元器件的发展和应用。采用激光技术对心血管支架进行加工,提高了加工效率和加工精度,突破了加工材料的限制,使很多微小结构的加工成型得以实现。激光快速成型技术在生物支架结构制备中的应用对研究组织细胞在3D复杂环境中的行为特性具有重要推动作用,生物骨架的快速成型为快速修复损坏的骨组织提供了可能,在生物骨组织工程应用方面具有突出优势。
虽然激光微加工技术可以微处理具有极端精细结构的新一代植入型医疗器械,让下一代植入型医疗器械商用变得可行,但是激光微加工技术在生物医学领域的发展还不够成熟,生产效率较低,工作稳定性还有待提高。对于激光微加工过程,目前还没有形成一套完整的理论可以解释在超快、超短、超强的极端条件下激光与物质相互作用的物理本质,也不能很好地评估出激光微加工对材料结构及其物理化学性能造成的影响,下一步的工作仍需要大量基础性和规律性的研究,同时还需根据激光微加工的特性以及被加工材料的属性,开发模拟分析软件,对微加工过程进行模拟和仿真,优化激光微加工过程的参数。
[4] Pronko PP, VanRompay P A, Singh R K, et al. Laser induced avalanche ionization and electron-lattice heating of silicon with intense near IR femtosecond pulses[C]. MRS Proceedings, 1995, 397: 45- 51.
[5] LiX, JiangL, WangC, et al. Transient localized material properties changes by ultrafast laser-pulse manipulation of electron dynamics in micro/nano manufacturing[J]. MRS Proceedings, 2011, 1365: mrss11-1365-tt01-01.
[11] 成洁, 杨明红, 王闵, 等. 基于飞秒激光加工的马赫-曾德尔干涉氢气传感器[J]. 光学学报, 2012, 32(7): 0706001.
[17] OstendorfA, BauerT, KorteF, et al. Development of an industrial femtosecond laser micromachining system[C]. SPIE, 2002, 4633: 128- 135.
[18] 王桂森, 万熠, 王滕, 等. 植入体微纳结构表面制备及生物相容性研究综述[J]. 表面技术, 2016, 45(5): 8-18.
[27] 王瑞, 周延民. 飞秒激光在钛合金表面改性中的应用及其对成骨细胞黏附和增殖的影响[J]. 吉林大学学报(医学版), 2013, 39(3): 453-457.
[35] JeongJ, ShinS, Lee GJ, et al. Advancements in fabrication process of microelectrode array for a retinal prosthesis using liquid crystal polymer (LCP)[C]. IEEE, 2013: 5295- 5298.
[37] Suaning GJ, SchuettlerM, Ordonez JS, et al. Fabrication of multi-layer, high-density micro-electrode arrays for neural stimulation and bio-signal recording[C]. CNE '07. 3rd International IEEE/EMBS Conference on Neural Engineering, 2007: 5- 8.
[38] Safadi MR, Scott AJ, ThakurJ, et al. Fabrication of a waveguide for biomedical applications using novel micromachining techniques[C]. SPIE, 2004, 5588: 205- 213.
[42] GuoX, TavakoliB, Kang HJ, et al. Photoacoustic active ultrasound element for catheter tracking[C]. SPIE , 2014, 8943: 89435M.
[45] WongwiwatP, Narayan RJ, Lee Y S. Improving biocompatibily of laser micromachined silicon wafer by surface cating with poly ( ethyleneglycol) diacrylate and diamond-like carbon for biomedical devices[C]. ASME, 2010, MSEC2010-34283: 273- 280.
[51] 钟敏霖, 范培迅. 激光纳米制造技术的应用[J]. 中国激光, 2011, 38(6): 0601001.
[54] HendricksF, PatelR, Matylitsky VV. Micromachining of bio-absorbable stents with ultra-short pulse lasers[C]. SPIE, 2015, 9355: 935502.
[56] 黄远, 田筝, 刘文西, 等. 加工工艺对医用心血管支架生物相容性的影响[J]. 天津大学学报(自然科学与工程技术版), 2003, 36(3): 374-379.
[59] Demir AG, PrevitaliB, ColomboD, et al. Fiber laser micromachining of magnesium alloy tubes for biocompatible and biodegradable cardiovascular stents[C]. SPIE, 2012, 8237: 823730.
[60] 张亚臣, 荣烨之. 医用聚乳酸的生物特性及其临床应用[J]. 上海医学, 2005, 28(1): 79-80.
[61] StolbergK, FriedelS, KremserB, et al. IR and green femtosecond laser machining of heat sensitive materials for medical devices at micrometer scale[C]. SPIE, 2014, 8968: 89680E.
[62] 程萍, 位迪, 吴本科, 等. 可降解心脏支架的飞秒激光精密加工[J]. 光学精密工程, 2014, 22(1): 63-68.
[63] Langer R, Vacanti J P. Tissue engineering[J]. Science, 1993, 260(5110): 920-926.
[76] 李祥, 李涤尘, 王林, 等. 基于RP的骨组织工程支架构造及生物学特性分析[J]. 中国机械工程, 2005, 16(12): 1117-1120.
Article Outline
卢立斌, 王海鹏, 管迎春, 周伟. 激光微加工技术制备生物医用器械的现状与进展[J]. 中国激光, 2017, 44(1): 0102005. Lu Libin, Wang Haipeng, Guan Yingchun, Zhou Wei. Laser Microfabrication of Biomedical Devices[J]. Chinese Journal of Lasers, 2017, 44(1): 0102005.









