生物组织黏弹性激光散斑检测方法研究进展  下载: 1411次特邀综述
下载: 1411次特邀综述
1 引言
由于疾病会改变生物组织的力学性质,生物组织的黏弹性测量可以用于监测疾病的发生、发展过程,并进行疾病早期诊断[1-6]。生物组织力学性质测量历史悠久,最古老的方法称为“触诊”,即通过医师手的触摸、按压来感受组织的硬度,判断组织是否发生病变。但这种测量方法只能主观定性检测生物组织的力学性质,其测量准确性受医师诊断经验影响较大[7],所以需要发展客观的医学检测方法,来代替医师的手,以便对生物组织的力学性质进行客观测量[8]。采用超声成像、磁共振成像等医学成像方法可以定量测量生物组织的黏弹性[6,9-10],这些方法已被用于许多疾病(如乳腺癌、肝硬化等)的诊断[9]。光学成像方法的空间分辨率和运动检测灵敏度较高[1,7],也被尝试用于生物组织黏弹性的测量,如光学相干层析成像[1-2,5,9,11]、激光散斑技术[7,12-14]、光声成像[15]和全息成像[16]等。基于光学成像方法的黏弹性成像技术起步较晚,特别是生物组织黏性成像技术还处在发展初期[11]。在众多光学成像方法中,基于光学相干层析成像的黏弹性测量方法相对成熟,相关的综述报道较多[1-2,5,9,11,17],本文着重介绍基于激光散斑技术的生物组织黏弹性测量的研究进展。
本文首先介绍黏弹性测量和激光散斑技术的基本原理,阐述黏弹性测量的基本要素,并根据测量物理量的不同,分别描述弹性波调制下的激光散斑衬比变化、布朗运动下的光强自相关函数和低频交变应力作用下的散斑位移。最后总结3种方法的特点,并对今后的研究方向进行了展望。
2 基本原理
2.1 生物组织的黏弹性
生物组织的力学性质由组织的材料成分和组成结构决定。由于其材料构成和结构形式复杂多样,因而具有复杂的力学性质,表现出不同程度的黏性、孔隙弹性、各项异性和非线性等[6,9]。
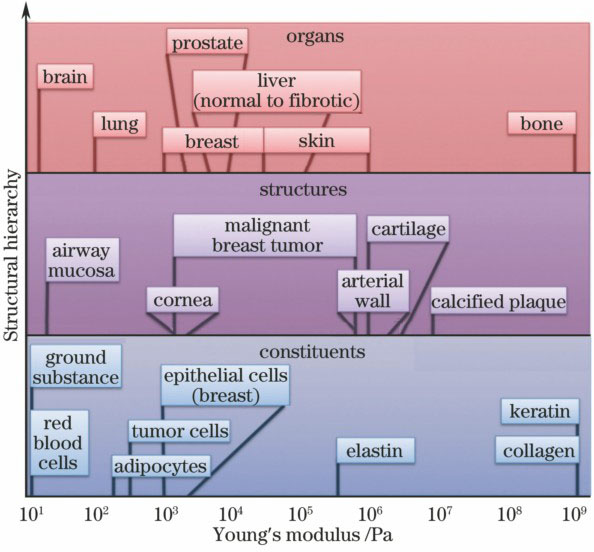
图 1. 生物组织组成成分、结构和器官的杨氏模量
Fig. 1. Young's modulus of tissue constituents, structures, and organs
2.2 生物组织黏弹性测量的基本原理
生物组织黏弹性成像方法一般包括3个环节:被测样本受到力的扰动或激励;利用各种方法测量被测样本在应力激励下的应变、位移或相关的量;在一定的假设条件或模型下计算被测样本的力学参数[6,18]。根据这3个不同的环节,出现了多种多样的黏弹性测量方法。其中,第1步的扰动方式,又可根据扰动的来源、扰动的施加方式和扰动的时域特征进行分类。扰动的来源可以是外部施加的力,也可以是生物组织内部的生理活动自发产生的力,后者如心脏有节律的跳动、呼吸带动肺的扩张和收缩、血流抽运造成血管周边组织的脉动[6]。外部施加的扰动可以分为接触式(如机械振动、声辐射力等)和非接触式(如气压、激光、磁场等)。按照扰动的时域特征可分为静态或准静态,正交变化及瞬态3类。第2步应变、位移和位移相关量的测量方法包括2个层次。一是根据测量装置的不同,可分为超声成像、磁共振成像、光学相干层析成像、激光散斑成像和光声成像等。二是根据求解的物理量的不同,可分为从波传播的角度,求解弹性波的速度、衰减系数等,或是从振动的角度,求解损耗正切、共振频率和振动的时间响应。在第3步求解力学参数的假设条件或模型中,根据是否考虑弹性、黏性、均匀性、各项同性、半无限、分层结构等因素,可以建立简单或复杂的力学模型。实际的生物组织比较复杂,为简单起见,一般将其假设为均匀的各项同性的半无限弹性介质。不过随着研究的深入,越来越多的研究考虑黏性[19]、分层结构[20]和各向异性[21]的影响。本文根据第2步中测量和求解的物理量的不同,分别介绍利用剪切波调制的散斑衬比变化测量弹性波的传播速度或衰减,利用布朗运动下散斑光强自相关函数测量均方位移,以及利用低频振荡作用下散斑位移测量损耗正切的研究进展。
2.3 激光散斑技术
当一束相干光照射在漫反射表面上时,到达成像面的散射光因随机干涉在空间上形成光强随机分布的颗粒状图像,这种现象称为“散斑”[22]。若散射粒子静止不动,相干光经其散射会在成像面发生稳态的随机干涉形成静态的散斑图样,其光强的空间分布不随时间变化。当散射粒子运动时,散斑图样会随时间变化,形成动态散斑。动态散斑由散射粒子运动引起,因此动态散斑包含了粒子的运动信息,散射粒子运动速度越快,散斑图样变化越快。在较小的采样时间内,可以观察到相邻2帧散斑图像的散斑颗粒发生了位移,所以散斑位移可以用来估计样本表面的相对位移[23]。在时间序列上,表现为散斑光强自相关函数逐渐去相关[24]。当采样的积分时间较长时,散斑图像会发生叠加而变得模糊,散射粒子运动得越快,散斑图像变得越模糊。在空间统计窗内通过计算散斑图像的散斑衬比值,来评价散斑图像的模糊程度,估计运动的相对速度[25-26]。激光散斑技术被广泛用于血流成像,也逐渐被用于生物组织的黏弹性测量。

图 2. 一种典型的激光散斑生物组织黏弹性测量系统示意图
Fig. 2. System diagram of a typical viscoelastic measurement of biological tissues based on laser speckle
3 弹性波调制下的激光散斑衬比变化
通过激光散斑衬比变化来追踪弹性波的传播过程,计算弹性波的传播速度或其幅度的衰减,从而定量获取黏弹性参数。
3.1 弹性波速度和衰减与黏弹性的关系
生物组织样本受到外部力学激励后,会产生剪切波和纵波,自激励源向外传播。在样本表面剪切波和纵波叠加形成瑞利波(Rayleigh wave),在层状介质中(如晶状体)形成兰姆波(Lamb wave)[1,11]。实际生物组织高度复杂,为简化处理,一般将生物组织假设成均匀的各向同性的。弹性波(如剪切波、瑞利波和兰姆波)的传播速度及其幅度衰减与被测样本的黏弹性有关。对于纯弹性介质,弹性波的速度可以用来计算剪切模量和杨氏模量。剪切波的传播速度与被测样本的黏弹性的关系为[9]
式中
比较(1)式和(2)式,可以看到剪切波的传播速度稍大于瑞利波的传播速度,在生物软组织中瑞利波的传播速度为1~10 m/s[27]。
由于生物组织的黏性,剪切波会发生频散,频散特性体现在2个方面:一是传播速度的频散,即剪切波传播的相速度与频率有关;二是衰减特性的频散,即不同频率会有不同的衰减系数。根据测得的频散曲线可以定量计算样本的黏弹性参数,如剪切弹性模量和剪切黏性模量[4,28-29]。对于均匀的各项同性介质的Kelvin-Voigt模型,平面剪切波的传播速度
式中
同样,平面剪切波的衰减系数
瑞利波传播的深度与其频率有关,不同频率瑞利波的相速度反映不同深度介质的力学特性。瑞利波的这种性质被广泛用于工程物探领域,被称为表面波频谱分析法,同样也被应用到生物组织的黏弹性测量中[31-32]。
3.2 通过散斑衬比变化测量生物组织的黏弹性
弹性波传播的速度和衰减系数与被测样本的黏弹性有关。生物组织黏弹性测量的关键在于如何测量相应的物理量来表征弹性波的传播过程。在弹性波传播的过程中,散射介质会随着弹性波运动。散射介质中光的超声调制机制一般认为有3种[33-34]。1)超声引起被测样本的光学参数的改变,从而对光进行非相干调制。2)对于相干光,超声引起散射体发生位移,使光程差发生改变,导致光学相位发生变化。3)超声会调制背景折射率,导致相位发生变化。值得注意的是,在声辐射力的作用下,散射介质中光的超声调制会产生在介质中传播的弹性波,也会对光进行调制[35-37]。弹性波对光的调制与超声波有差别[36]。以剪切波为例,一方面,剪切波的压力较小,背景折射率的改变也较小,第3种调制机制可以忽略不计;另一方面,剪切波的周期远大于超声波的周期。
一般只考虑第2种调制机制,可用蒙特卡罗方法来仿真弹性波调制下激光散斑衬比的变化。Lu等[35]研究了在声辐射力激发的剪切波的调制下光相位的变化,通过蒙特卡罗仿真方法计算了在剪切波传播过程中光相位的分布,发现光相位可以追踪剪切波的波前,从而计算剪切波传播的速度。Li等[37]改进了蒙特卡罗模型,计算了剪切波调制下的动态电场和散斑图像的光强分布,通过散斑衬比变化计算了剪切波传播的速度。同样,Li等[36]用蒙特卡罗仿真的方法研究了多个剪切波调制下和考虑边界反射下散斑衬比差的变化。从蒙特卡罗仿真可以看到,散斑衬比会随着剪切波的传播而发生波动,在弹性波传播到光聚焦区域时,散斑衬比值最低,在弹性波离开光聚焦区域时,散斑衬比值逐渐升高。所以散斑衬比的变化可以近似描述剪切波的传播过程。
在实验方面,通过聚焦超声产生声辐射力,作用于样本后产生剪切波,剪切波自激发源向四周传播。利用相机收集后向散射或扩散的光子,采集散斑图像。计算空间散斑衬比,获取剪切波传播过程中散斑衬比的时空分布。计算剪切波传播的速度或衰减系数后,通过模型求得样本的弹性模量和黏性模量[38]。
如
![根据散斑衬比变化测杨氏模量。(a)测量原理;(b)速度计算方法;(c)有硬块仿体的杨氏模量[38]](/richHtml/zgjg/2018/45/2/0207005/img_3.jpg)
图 3. 根据散斑衬比变化测杨氏模量。(a)测量原理;(b)速度计算方法;(c)有硬块仿体的杨氏模量[38]
Fig. 3. Young's modulus measurement based on speckle contrast difference. (a) Measurement principle; (b) velocity calculation method; (c) Young's modulus of phantom with an inclusion
4 布朗运动下散斑光强自相关曲线
散射粒子运动越剧烈,散斑图像变化越快,表现为散斑光强自相关函数快速去相关。在布朗运动下通过散斑光强自相关函数,可以评价布朗运动的剧烈程度,计算样本局部的黏弹性。该方法基于微流变仪的原理。
4.1 微流变仪的原理
被动光学微流变仪通过估计粒子在布朗运动下的位移来计算样本局部的黏弹性[3,41-43]。粒子可以是光学探针(如荧光标记的探针),也可以是内源性的粒子[3]。粒子布朗运动的位移可用其均方位移来估计。均方位移与黏弹性模量的关系可用广义Stokes-Einstein方程[43]来描述:
式中
式中
在生物组织后向散射的激光散斑成像中,认为符合多散斑扩散光谱的条件,散斑光强自相关函数
式中
4.2 通过散斑光强自相关函数测量黏弹性模量
激光散斑成像中,随着散射粒子的运动,散斑光强的相关性会逐渐降低,归一化自相关函数曲线会由1降低到0。自相关函数曲线或相应的去相关时间可以用来估计散射粒子运动的剧烈程度。表现为,在其他条件一定的情况下,样本的黏弹性越低,散斑图像的扰动越大。Tearney等[49]在测量离体人主动脉样本的散斑图像时,发现所测得的不同性质的粥样斑块的去相关时间常数有显著的差异。脆弱的主动脉斑块的去相关时间常数为40 ms,稳定的斑块为400 ms,而正常的动脉组织为500 ms,表明散斑光强自相关函数有望用于评价斑块的性质。另外该文还认为,根据辐射传输理论,采用点光源照明,当源与探测器间距不同时,去相关时间常数反映不同深度的物质的黏弹性。利用这一原理,激光散斑成像也可被用来测量纤维帽的厚度,这对评价斑块的稳定性具有重要的意义[50]。进一步研究发现,散斑光强自相关函数的去相关时间常数对估计斑块类型和识别薄帽纤维粥样斑块具有较高的灵敏度,斑块所在区域的去相关时间常数要低于周围正常的动脉组织,而且纤维粥样斑块的轮廓与病理照片一致[51]。
以散斑光强自相关函数的去相关时间常数来评价样本的黏弹性是一种定性的方法。而结合微变仪的原理,测量散斑光强自相关曲线,求解散射粒子的均方位移,运用(5)式可定量求解样本的黏弹性。Hajjarian等[14]和Nader等[24]通过将传统流变仪测得的黏弹性模量与激光散斑流变仪测得的去相关时间常数作比较,发现两者具有较强的相关性,并根据微流变仪的原理,对散斑光强自相关曲线和组织黏弹性之间的联系做了讨论[14]。不仅如此,散斑流变仪还可用于测量凝血过程中血液黏弹性的变化过程[52],这提供了一种直接的血凝度指标。这种方法被称为光学血栓弹性描计仪[53]。实验发现,血栓弹性描计仪对血液凝结过程早期的微凝结的检测具有高的灵敏度和空间分辨率。

图 4. (a)人的血液样本凝固过程(第0,6,10,12 min)的散斑光强自相关曲线;(b)人的血液样本凝固过程中散斑自相关时间常数和黏弹性模量的变化
Fig. 4. (a) Speckle intensity autocorrelation curves measured during coagulation (at 0, 6, 10, 12 min) of a human blood sample; (b) changes of speckle autocorrelation time constant and viscoelasticity modulus during coagulation process of a human blood sample
绝大多数生物组织是一种浑浊介质,不能满足单次散射或全部多次散射的假设,因此光强自相关函数与均方位移之间的关系不能单纯地用动态光散射和多散斑扩散光谱公式来表示,否则会对均方位移做出错误估计,需要对光学参数的影响做出校正[24,45,55]。Hajjarian等[45,55]通过时间域的平均散斑光强来估计样本的吸收系数和约化散射系数,将求得的光学参数代入到蒙特卡罗射线追踪模型中进行仿真,获得实际光学参数下散斑光强自相关函数与均方位移的关系,从而校正光学参数的影响。当散射强于吸收,且吸收不可忽略时,(7)式可校正为
式中
另外,Hajjarian等[56]将内窥式的激光散斑成像运用到黏弹性的测量中,该仪器直径为1.5 mm,可以深入到动脉中进行测量。在离体的人动脉样本中进行实验,通过与传统的激光散斑流变仪所测得的斑块光强自相关函数的时间常数比较,验证了该内窥散斑流变仪测量动脉黏弹性的可行性,并在活体兔的主动脉中做了初步实验,经测量发现动脉的散斑光强自相关函数的去相关时间常数在主动脉正常侧和扩张侧有所不同。Wang等[46]设计了一种多视角的激光散斑流变仪来测量管状器官的黏弹性,不需要旋转扫描,就可以一次成像多个面,并且在仿体实验中进行了验证。
5 低频交变应力作用下的散斑位移
5.1 施加低频交变应力时线性黏弹性材料的应变响应
对于线性黏弹性固体,在交变应力
式中tan
5.2 通过散斑位移计算应力作用下的应变
组织中散射粒子的运动会改变光程,散斑图像会发生扰动。如果在相机曝光时间内,对散斑图像扰动作积分处理即可得到平均光强。而且若散射粒子是静止的,则会形成稳定的散斑场;若物体运动,则在积分时间内,明暗间隔的散斑在曝光时间内互相平均,运动越剧烈,光强的归一化分布在中间光强越多。在一定的激励下,不同弹性的物体,光强的归一化分布会不同[58]。当采样时间较短时,可以通过散斑位移来估计被测样本的相对位移[23]。各种有参和无参的方法被用来从散斑图像中计算散斑位移,包括互相关、最小均方估计、最大似然估计、最大熵估计等[23,59]。
Kirkpatrick等测量了牛颈背的弹性蛋白[60]和猪皮肤样本的损耗正切[57]。假设猪皮肤样本是半无限且各项同性的黏弹性介质,用扬声器在样本表面振动,产生1 Hz的瑞利波在其表面传播。通过散斑位移来估计样本在简谐应力下的应变,计算了猪皮肤样本的损耗正切。声光弹性成像[13]是通过最大似然估计计算低频扬声器激励下的散斑位移来估计被测生物组织局部的力学性质。实验中发现,后向散射散斑图像的动态位移可被用来表示局部的硬度,如
![(a)交界痣的白光图;(b)交界痣的弹性图[13]](/richHtml/zgjg/2018/45/2/0207005/img_5.jpg)
图 5. (a)交界痣的白光图;(b)交界痣的弹性图[13]
Fig. 5. (a) White light photograph of a junctional nevus; (b) viscoelasticity photograph of a junctional nevus
6 结束语
尽管各种基于激光散斑技术的生物组织黏弹性测量方法所测得的物理量不同,但无论是散斑衬比、光强自相关函数,还是散斑位移,均是在求应力与应变的相互关系。基于工程物探原理,弹性波调制的激光散斑衬比变化,黏弹性参数蕴含在本构方程中。弹性波传播速度和衰减系数与黏弹性有关,是一种定量检测的方法。虽然由于实际生物样本较复杂,该方法目前还主要应用在仿体实验中,但从基于超声成像和光学相干层析成像的黏弹性成像方法的发展来看,其前景广阔。布朗运动下的散斑光强自相关函数基于光学微流变仪的原理,在生物医学领域主要被应用于粥样斑块和血液的黏弹性的检测,是一种定量检测的方法。特别是内窥式的激光散斑流变仪,可用于体粥样斑块的评估,区分有风险的粥样斑块。但该方法作为一种被动式的微流变仪,前提条件为布朗运动,需要解决生物组织中其他定向运动(如血流)的影响。通过测量低频振荡下的散斑位移,即可计算样本的损耗正切和相对硬度,区别不同种类的痣,但不能直接定量求出弹性和黏性。激光散斑成像技术现被广泛用于血流的检测,黏弹性的测量可以为其提供另一种检测参数,有可能结合2种成像参数,同时提供多种信息。相比于超声成像和光学相干层析成像,基于激光散斑技术的生物组织的黏弹性测量发展较晚,还有许多工作要做。一方面,在方法上要考虑更加复杂的组织结构模型,如多层结构、各向异性等;另一方面,在应用上要结合临床应用,检测生物组织在疾病发生和发展过程中的黏弹性变化。
[26] ChenX, WangJ, WangY, et al. Measuring viscoelasticity by tracking vibration based on laser speckle contrast imaging[C]. Asia Communications and PhotonicsConference, 2016, AF3A:AF3A. 7.
[43] WB, Keen S, J P, et al. Rheology-New concepts, applications and methods[M]. London: In Tech, 2013: 3.
Article Outline
陈肖, 陆锦玲, 李鹏程. 生物组织黏弹性激光散斑检测方法研究进展[J]. 中国激光, 2018, 45(2): 0207005. Chen Xiao, Lu Jinling, Li Pengcheng. Viscoelasticity Measurement of Biological Tissues Using Laser Speckle Techniques: a Review[J]. Chinese Journal of Lasers, 2018, 45(2): 0207005.






