相干拉曼散射显微技术及其在生物医学领域的应用  下载: 3088次特邀综述
下载: 3088次特邀综述
1 引言
光学显微是医学成像的主要手段,传统的光学显微镜通常依赖于待测样品自身的一些光学性质,如吸收、散射和折射率等,缺乏足够的特异性。借助荧光标记技术,对待测样品内的不同成分进行标记,通过荧光信号可以获得不同化学成分在待测样品内的分布。20世纪末,绿色荧光蛋白(GFP)的发现,极大地推进了活细胞和生物体内动态成像研究的发展。随后,超分辨荧光成像技术的出现,使得人们在纳米尺度下观察活细胞和生物组织成为可能[1]。但是荧光成像所引入的荧光探针会扰乱生物组织或细胞的结构和功能,而且荧光信号的强度会随着光照时间的延长而减弱,从而影响生物组织或细胞的长时间观察。另外,一些荧光探针的尺寸较大,因此对细胞内小分子的标记较为困难。
相干拉曼散射(CRS)显微成像的信号来源于分子内部振动能级的跃迁,作为一种新型的成像技术,其优势在于无标记和高特异性。相对于自发拉曼散射,CRS成像可以大大提高信号的强度,缩短图像的采集时间,使动态成像成为可能[2]。CRS技术可以通过选择振动光谱,对生物体内的特定小分子及生物大分子进行无标记成像检测,尤其是可以对活细胞中的脂质、胶原、蛋白等的结构组成、构象变化,以及治疗过程中的药物靶点等进行定性分析。随着CRS显微技术的不断发展,其在生物医学领域的应用也取得了长足进展。本文将综述CRS显微技术及其在生物医学领域的应用,并对其存在的局限性和发展前景进行探讨。
2 CRS成像的原理及分类
CRS主要包括相干反斯托克斯拉曼散射(CARS)和受激拉曼散射(SRS)。
CARS过程的能级图如
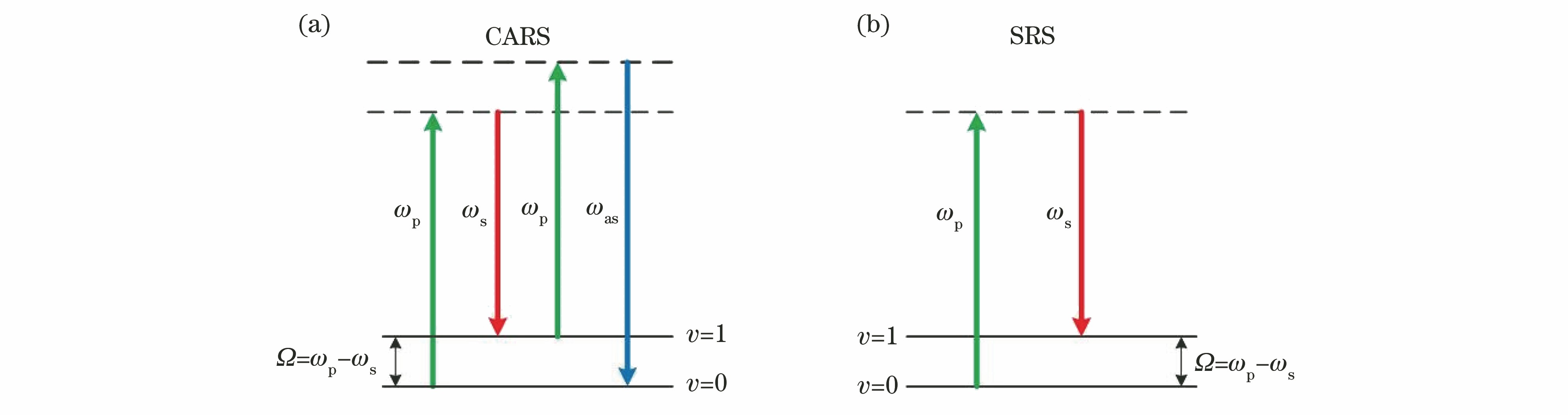
图 1. CARS和SRS过程能级图。(a) CARS能级图;(b) SRS能级图
Fig. 1. Energy level diagrams of CARS and SRS processes. (a) CARS energy level diagram; (b) SRS energy level diagram
与CARS现象不同,SRS是一种非参量的耗散过程,其能级图如
相比较而言,CARS信号通常伴随有非共振背景,这个背景的产生是分子中电子对外界光场的响应造成的。而SRS信号没有非共振背景,而且可以在环境光下进行探测。此外,CARS信号与待测样品浓度之间是平方依赖关系,而SRS信号对浓度是线性依赖关系,这样便使得SRS在定量分析上更简单直接。此外,SRS并不是完全不受背景的影响,自相位调制、瞬时吸收、光热效应都会影响SRS信号,但CARS并不受这些因素的影响。
3 CRS显微成像系统
CRS显微成像最常采用的系统是在激光扫描显微镜上使用两个同步脉冲。CARS和SRS可以使用共同的激光光源和显微镜系统(如
此外,目前的CRS显微成像系统可以用单一激光束代替泵浦光和斯托克斯光来实现CRS显微成像[12-13]。
3.1 CARS显微成像系统
传统的CARS显微成像系统通常由双色激光光源、显微镜和高灵敏度的光电探测器组成。常用的CARS成像模式有单频CARS显微成像、多色CARS显微成像和高光谱CARS显微成像。
与在每个像素点获取整个拉曼光谱的自发拉曼显微成像不同,CRS显微成像通常将能量聚焦到特定的拉曼位移中,进而获取信号。一般来讲,将所有激光能量聚焦到某一特定的拉曼振动位移中的方法称为单频CRS显微成像。虽然单频CRS显微成像可以保证信号的强度,但仍会受到化学特异性的限制。对于单频(或单色)CARS成像,使用皮秒脉冲激光器可以得到最佳的信噪比和最弱的非共振背景[14]。在早期的CARS显微成像中,激光光源是具有同步脉冲的双皮秒激光器。通常,两束光经二向色镜(DM)后在空间和时间上重合,被耦合进共聚焦显微镜。为了最大限度地提高CARS信号的收集效率,通常采用高数值孔径的物镜。CARS过程中产生了比入射光波长更短的反斯托克斯光,因此可以使用二向色镜直接将泵浦光和斯托克斯光滤除,采集反斯托克斯信号,之后可以用显微镜的外置PMT(photomultiplier tube)检测器来收集并检测CARS信号。
多色CRS显微成像利用光谱整形,从宽带泵浦光中提取出多个频率成分,同时使用光栅进行分光,分别探测这几种成分对应的信号。与传统的将PMT作为光电探测器的CARS显微成像不同,多色CARS显微成像通常使用光谱仪和线阵CCD来收集每个像素处产生的宽带频谱[15]。在过去的10年中,多色CARS显微成像不断发展,最快的光谱采集时间为3~5 ms[16]。与视频速率的单频CARS成像相比,多色CARS显微成像的速度在很大程度上受CCD读出速率的限制。
高光谱CARS显微成像通过一次扫描拉曼频移实现光谱成像。实现高光谱CARS显微成像的常用方法为光谱聚焦,即适当地啁啾两个宽带激光光束,并调整它们之间的时间延迟。啁啾后,两个激光脉冲的瞬时重叠具有较低的频率带宽,从而提高了光谱分辨率[17-18]。通过调整两个啁啾脉冲之间的时间延迟,可以改变重叠频率差,从而产生不同的拉曼位移。现在许多研究小组都将光谱聚焦的方法用于高光谱CARS成像[19-22]。
由于CARS信号通常伴随着非共振背景,峰的位置也发生了变化,并扭曲了拉曼谱线的形状,所以CARS光谱需要进行处理后才能进行定量分析。为了提取实际的拉曼光谱,可以利用数学计算方法对高光谱CARS数据进行定量分析[23-24]。如果CARS光谱的差异足够显著,就可以对高光谱CARS图像进行定性分析,而不需要通过复杂的计算来区分化学物质[25]。
3.2 SRS显微成像系统
SRS成像可以在CARS成像系统的基础上,采用光学调制器、光电二极管检测器和解调器,提取与激发光波长相同的信号。采集SRS信号时,透过样品到达探测器的光强很高,常常达到几毫瓦甚至数十毫瓦,因而使用光电二极管作为探测器,而不使用共聚焦或者双光子显微镜中内置的探测器。通常,一束光的强度是由声光调制器或电光调制器进行高频(通常是兆赫兹级)调制的。解调器用于提取SRL或SRG引起的激发光束强度的微小变化,锁相放大器是SRS成像中最常见的解调器。2012年,Slipchenko等[26]研发了一种可以代替传统锁相放大器的可调谐放大器(TAMP),它可以用于对大鼠脊髓中的髓磷脂和血液进行体内成像。常见的SRS成像系统包括高光谱SRS显微成像和多色SRS显微成像。
在拉曼光谱谱带重叠的情况下,高光谱SRS显微成像具有更好的化学特异性,而实现高光谱SRS显微成像的重点在于实现波长或拉曼频移的扫描。目前有三种方法可以通过对拉曼频移扫描实现高光谱SRS成像:第一种是利用皮秒脉冲在一个连续的范围内调整激光波长,可以实现多个拉曼跃迁[27];第二种是基于宽带飞秒光源,利用脉冲整形器对宽频飞秒光谱中的窄光谱成分进行滤波扫描[28-30];第三种方法是利用光谱聚焦[31-32],与之前讨论的高光谱CARS相同。
2012年,Fu等[33]展示了一种多色SRS显微技术,该技术将基于光栅的脉冲整形器和基于光栅的光谱仪结合,用于组织成像和化学成分的定量分析,具有多种化学选择性。同年,Fu研究小组报道了使用单独的锁相放大器对三个光谱通道进行并行检测的多色SRS[34]。
4 CRS显微成像的应用
4.1 CARS显微成像的应用
CARS显微成像已被广泛用于单细胞成像[35-38]、组织成像[16,27,39-46]以及模型生物成像[47-49]。在单细胞成像中,C—H伸展区域的强CARS信号能提供很多有用的信息。2003年,Nan等[35]使用Oil Red染色液对活体成纤维细胞中的中性脂滴进行染色,并观察它的荧光图像,将其与无染色中性脂滴的CARS成像进行对比,证实了CARS成像的准确性。研究人员在用CARS显微系统检查荧光标记过程中发现,固定细胞的Nile Red染色液会使中性脂滴的结构发生变化,而由于中性脂滴是疏水结构,所以用甲醛进行固定对中性脂滴的结构无太大影响。该CARS显微系统也被用于监测3T3-L1细胞的分化过程,在分化早期中性脂滴明显减少,之后,细胞开始在细胞质中以非同步的方式分化和重新积累中性脂滴。结果表明,CARS显微系统不仅可以跟踪活细胞的动态变化,还可以同时研究3T3-L1细胞分化中脂滴的演化过程。2009年,Le等[50]将CARS用于小鼠体外和体内肺癌细胞转移的研究中,发现,高脂肪饮食会促进富含脂质的肺癌细胞的转移。2012年,Mitra等[36]将CARS用于前列腺循环肿瘤细胞的研究中,对小鼠癌症模型中富含脂质的原发性癌细胞和循环肿瘤细胞进行了CARS成像(结果如
最近,高光谱CARS成像在细胞组分的无标记研究中取得了新成果。2014年,di Napoli等[38]将不同比例的棕榈酸(饱和)和α-亚麻酸(不饱和)加入到人脂肪干细胞中,研究人脂肪干细胞中中性脂滴的化学成分,并在振动指纹区域(500~1800 cm-1)和C—H拉伸区域(2600~3300 cm-1)进行双频差分CARS显微成像和高光谱CARS显微成像,定量评估和比较两者的性能。
![用CARS显微镜检测到的富含脂质的前列腺循环肿瘤细胞(上排:前列腺循环肿瘤细胞表现出由细胞内脂质积累引起的强的CARS信号;下排:白细胞表现出主要来自细胞膜的弱的CARS信号)[36]](/richHtml/zgjg/2020/47/2/0207005/img_3.jpg)
图 3. 用CARS显微镜检测到的富含脂质的前列腺循环肿瘤细胞(上排:前列腺循环肿瘤细胞表现出由细胞内脂质积累引起的强的CARS信号;下排:白细胞表现出主要来自细胞膜的弱的CARS信号)[36]
Fig. 3. Detection of lipid-rich prostate CTC with CARS microscopy. (Upper row: prostate CTC exhibits strong CARS signal arising from intracellular lipid accumulation; lower row: leukocytes exhibit weak CARS signal arising mainly from cellular membrane)[36]
目前,CARS成像技术已成为研究组织生物学和疾病诊断的独特工具。它的一个重要应用是中枢神经系统和周围神经系统中髓鞘的可视化[41-42],这为离体研究脊髓损伤和髓鞘疾病提供了一种有效方法。2005年,Wang等[43]使用激光扫描CARS显微系统在生理条件下对神经元髓鞘进行三维成像,表征了活脊髓组织中髓鞘的分子取向和振动光谱分布。CARS显微成像也被用于鉴定患病小鼠[27,44]和人类动脉粥样硬化组织中的胆固醇晶体[45]。2014年,Camp等[16]实现了宽带CARS的三维组织成像,基于其独特的光谱,研究人员能够区分蛋白质和脂质,以及胶原蛋白和DNA。在研究中,通过非共振背景的弱拉曼跃迁的外差放大,500~3500 cm-1的宽拉曼光谱窗口被高光谱CARS覆盖,实现了对健康小鼠胰腺组织的三维高速化学成像(如
![宽带CARS对小鼠胰管的三维组织成像[16]。(a)伪彩色图,蓝色为细胞核(785 cm-1),红色为胶原蛋白(855 cm-1),绿色为脂质和蛋白质的复合物(1665 cm-1),A为腺泡细胞,D为外分泌管,Ep为上皮细胞;(b)小鼠胰管的三维重建图](/richHtml/zgjg/2020/47/2/0207005/img_4.jpg)
图 4. 宽带CARS对小鼠胰管的三维组织成像[16]。(a)伪彩色图,蓝色为细胞核(785 cm-1),红色为胶原蛋白(855 cm-1),绿色为脂质和蛋白质的复合物(1665 cm-1),A为腺泡细胞,D为外分泌管,Ep为上皮细胞;(b)小鼠胰管的三维重建图
Fig. 4. Three-dimensional tissue imaging with wideband CARS for murine pancreatic ducts[16]. (a) Pseudo color chart, in which nuclei (785 cm-1), collagen (855 cm-1), and a composite of lipids and proteins (1665 cm-1) are highlighted in blue, red, and green, respectively. A represents acinar cell, D represents exocrine duct, and Ep represents epithelial cell; (b) three-dimensional reconstruction result of murine pancreatic
秀丽隐杆线虫作为模型生物的代表,已成为研究脂肪储存和脂质代谢的活体测试对象。2007年,Hellerer等[47]使用CARS显微技术监测了生物体的形态和脂滴的几何排列,研究了活体秀丽隐杆线虫中脂质储存的遗传变异与代谢途径之间的关系。2010年,Yen等[48]对秀丽隐杆线虫中的脂肪储存功能分别进行染料标记成像和无标记CARS成像(结果如
![利用标记和无标记成像方法对秀丽隐杆线虫体内脂肪成像的结果[48]。(a)采用苏丹黑、油红O和尼罗红对固定后的线虫进行染色的结果,以及分别采用尼罗红、BODIPY标记的脂肪酸喂养活线虫,并对脂肪进行标记成像的结果; (b)利用CARS和双光子激发荧光(TPEF)对中性脂质和自发荧光颗粒进行无标记成像的结果](/richHtml/zgjg/2020/47/2/0207005/img_5.jpg)
图 5. 利用标记和无标记成像方法对秀丽隐杆线虫体内脂肪成像的结果[48]。(a)采用苏丹黑、油红O和尼罗红对固定后的线虫进行染色的结果,以及分别采用尼罗红、BODIPY标记的脂肪酸喂养活线虫,并对脂肪进行标记成像的结果; (b)利用CARS和双光子激发荧光(TPEF)对中性脂质和自发荧光颗粒进行无标记成像的结果
Fig. 5. Labeled and label-free imaging for fat in C. elegans[48]. (a) Labeled imaging of fat using Sudan Black, Oil Red O, and Nile Red staining of fixed worms and Nile Red and BODIPY-labeled fatty acids fed to live worms; (b) label-free imaging results of neutral lipid species and autofluorescent gut granules using CARS and TPEF
相比之下,CARS显微镜对脂肪储存的无标记成像依赖于C—H的固有分子振动,同时使用CARS和TPEF成像可以实现中性脂滴和自发荧光肠道颗粒的无标记可视化。除了可以测定总的脂肪储存量之外,CARS成像还可以用来定量分析自发荧光颗粒、脂滴的大小和数量,以及脂质链的不饱和度。与标记技术相比,无标记CARS成像为活体秀丽隐杆线虫中脂肪储存量的研究提供了直接可靠的手段。2010年,Le等[49]通过将CARS成像与指纹区共聚焦拉曼分析相结合,分析了野生型和突变体秀丽隐杆线虫中脂质的不饱和水平,并研究了遗传修饰对秀丽隐杆线虫中性脂质储存和脂质不饱和水平变化的影响。
4.2 SRS显微成像的应用
随着SRS显微成像的迅速发展,其在生物医学研究中的应用越来越受到重视,已被广泛用于单细胞成像[32,52]、组织成像[10-11,30,53-61]以及模型生物成像[49,62-66]。
与CARS显微成像相比,SRS显微成像最重要的特点是不存在使拉曼信号失真的非共振背景。与CARS类似,C—H伸缩振动产生强的SRS信号,可利用其特点对生物样品中的脂质和蛋白质进行无标记SRS成像。另外,SRS显微成像已经被扩展至指纹区域(500~1800 cm-1)。2008年,Freudiger等[10]利用皮肤渗透增强剂二甲基亚砜(DMSO )和维生素A的代谢中间产物视黄酸(retinoic acid)分别在670 cm-1和1570 cm-1有明显谱峰的特点,使用SRS成像技术对非标记药物在皮肤内的运输进了追踪。DMSO为亲水分子,可以通过蛋白穿透皮肤,所以其信号集中于角质层。与此相反,视黄酸为亲脂分子,可以通过脂质丰富的细胞间隙进行渗透,所以视黄酸的信号集中于细胞间隙。2012年,Zhang等[52]在部分指纹区域(785 cm-1和1090 cm-1)证明了核酸在活细胞中的分布,并分别对果蝇幼虫的单个唾液腺细胞,以及两种哺乳动物细胞——人胚肾细胞(HEK293)和乳腺癌细胞(MCF7)——进行SRS成像。在果蝇唾液腺细胞中可以清晰地观察到多线染色体的特殊结构。在卵巢癌细胞中检测到了在细胞间期非分裂细胞中存在的核仁,并发现了分裂细胞中发生的DNA浓缩水平增大的现象。这项研究表明,该技术对于鉴定活组织内经历过分裂或凋亡的细胞尤为重要。
SRS成像已经被用来对细胞内的不同成分进行成像,如脂质、蛋白质、核酸等。Fu等[32]使用光谱聚焦方法,利用高光谱SRS显微镜观察了高浓度的伊马替尼和尼罗替尼在小鼠BaF3细胞内的无标记可视化成像(如
![具有高浓度药物的小鼠BaF3细胞的高光谱SRS成像[32]。高浓度伊马替尼(a)和尼罗替尼(b)在小鼠BaF3细胞内的无标记可视化成像,这与仅使用二甲基亚砜处理的对照细胞(c)不同;选定位置的SRS光谱(d)与溶液中两种SRS光谱(e)相似,但与细胞质区域(f)不同](/richHtml/zgjg/2020/47/2/0207005/img_6.jpg)
图 6. 具有高浓度药物的小鼠BaF3细胞的高光谱SRS成像[32]。高浓度伊马替尼(a)和尼罗替尼(b)在小鼠BaF3细胞内的无标记可视化成像,这与仅使用二甲基亚砜处理的对照细胞(c)不同;选定位置的SRS光谱(d)与溶液中两种SRS光谱(e)相似,但与细胞质区域(f)不同
Fig. 6. Hyperspectral SRS imaging of BaF3 cells in mouce with high concentration drug. Unlabeled visualization imaging of high concentrations of imatinib (a) and nilotinib (b) in mouse BaF3 cells, as distinct from control cells treated with dimethyl sulfoxide alone (c); SRS spectrum (d) of the selected location shows similarity to two SRS spectra (e) in solution, but it is different from the cytoplasmic region (f)
目前,SRS已被广泛用于组织成像的检测中。Freudiger等[10,53-54]首次使用SRS对皮肤中的脂质以及体内大脑肿瘤进行了成像(结果如
![小鼠大脑肿瘤的SRS成像[53]。(a)在皮层表面下方的肿瘤中,在对皮层表面成像时,SRS(左)和明场像(右)没有明显异常;(b)去除一部分皮质后可发现肿瘤区域,SRS(左)和明场像(右),能够看到肿瘤与正常大脑之间的界面](/richHtml/zgjg/2020/47/2/0207005/img_7.jpg)
图 7. 小鼠大脑肿瘤的SRS成像[53]。(a)在皮层表面下方的肿瘤中,在对皮层表面成像时,SRS(左)和明场像(右)没有明显异常;(b)去除一部分皮质后可发现肿瘤区域,SRS(左)和明场像(右),能够看到肿瘤与正常大脑之间的界面
Fig. 7. SRS imaging of brain tumors in mice[53]. (a) In tumors below the cortical surface, there were no significant abnormalities in the SRS (left) and brightfield images (right) when imaging the cortical surface; (b) after removing a part of the cortex, tumor regions can be found, and interface between the tumor and the normal brain can be seen in SRS (left) and brightfield images(right)
另外,SRS显微成像也被广泛用来研究多模型生物。例如,Hu等[62]通过对X.laevis蝌蚪进行SRS成像来观察髓磷脂的动态行为。他们通过对髓膜中CH2键的对称拉伸成像进行观察,发现了周围神经系统中神经胶质细胞形成髓磷脂以及髓磷脂鞘降解等的过程。2011年,Wang等[64]比较了秀丽隐杆线虫的CARS和SRS成像(如
![秀丽隐杆线虫的CARS和SRS成像[64]。(a)共振背景下秀丽隐杆线虫肠细胞核的CARS图像;(b)秀丽隐杆线虫肠细胞中的SRS图像;相同位置的秀丽隐杆线虫中的CH2在2845 cm-1处的CARS(c)和SRS(d)放大图像](/richHtml/zgjg/2020/47/2/0207005/img_8.jpg)
图 8. 秀丽隐杆线虫的CARS和SRS成像[64]。(a)共振背景下秀丽隐杆线虫肠细胞核的CARS图像;(b)秀丽隐杆线虫肠细胞中的SRS图像;相同位置的秀丽隐杆线虫中的CH2在2845 cm-1处的CARS(c)和SRS(d)放大图像
Fig. 8. CARS and SRS imaging of in C. elegans. (a) CARS images of C. elegans intestinal cells in resonance background; (b) SRS images of C. elegans intestinal cells; CARS (c) and SRS (d) enlarged images of C. elegans CH2 at 2845 cm-1 in the same location
此外,研究人员已经开发了拉曼标签,它通常具有与细胞固有拉曼信号分离的强拉曼谱带。Zhang等[63]利用细胞对氘代脂肪酸的摄取,对细胞内的脂质成分进行了拉曼光谱分析,氘化化合物有助于可视化细胞中的重要代谢物。Chen等[67]通过对碳同位素标记的细胞进行SRS成像研究了细胞中蛋白质的降解,他们分别用C12和C13标记苯基丙氨酸培养Hela细胞,并进行SRS成像,观察到了旧蛋白质的降解和新蛋白质的合成。2019年,Li等[66]利用一种基于振动标签的SRS显微成像技术来对活体动物的脂质合成和脂质分解进行定量分析,该研究对秀丽隐杆线虫中中性脂滴的代谢动力进行了探索,并通过对中性脂滴的SRS信号进行频谱分析,观察到了成年秀丽隐杆线虫中脂肪酸的去饱和作用。2019年,Seidel等[68]对复杂的天然产物——抗霉素型缩酚酸肽,及其炔标记衍生物进行SRS成像,观察分析后认为化合物在细胞内的富集和分布是由它们的效力、特定蛋白质靶标,以及化合物的亲脂性质驱动的。
5 结束语
相干拉曼显微技术未来将在生物医学领域发挥越来越大的作用。在成像方面,虽然无标记振动成像已被广泛应用,但其检测特异性有限,而且具有相同化学键的分子会有高度重叠的光谱,从而使得对特定分子的成像变得非常困难。为了避免这种情况,可以引入外源性化学键来实现在静默区(1800~2600 cm-1)中产生较强的拉曼峰值。在生物医学应用方面,鉴于脂质在生物学中的重要性,接下来可以对脂质进行全面和系统的研究,尤其是对脂质代谢酶的功能、脂质代谢网络的相互作用,以及脂质代谢途径等进行深入研究。另外,蛋白质的结构变化也会引起显著的拉曼光谱振动,可以针对由蛋白质错误折叠引起的疾病进行深入研究。在把CRS推向临床使用方面,面临的最大挑战是如何用光纤激光器代替目前主要使用的固体激光器,降低系统的成本。
[1] 邓月月, 叶贤其, 曹博, 等. 荧光显微成像用于研究卵母细胞减数分裂过程[J]. 中国激光, 2018, 45(5): 0507002.
[2] 郑世凯, 杨康文, 敖建鹏, 等. 光纤式相干拉曼散射成像光源研究进展[J]. 中国激光, 2019, 46(5): 0508008.
[3] Maker P D, Terhune R W. Study of optical effects due to an induced polarization third order in the electric field strength[J]. Physical Review, 1965, 137: 801-818.
[4] Duncan M D, Reintjes J, Manuccia T J. Scanning coherent anti-Stokes Raman microscope[J]. Optics Letters, 1982, 7(8): 350-352.
[5] Zumbusch A, Holtom G R, Xie X S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering[J]. Physical Review Letters, 1999, 82(20): 4142-4145.
[6] Cheng J X, Book L D, Xie X S. Polarization coherent anti-Stokes Raman scattering microscopy[J]. Optics Letters, 2001, 26(17): 1341-1343.
[7] Cheng J X, Volkmer A, Book L D, et al. Multiplex coherent anti-Stokes Raman scattering microspectroscopy and study of lipid vesicles[J]. The Journal of Physical Chemistry B, 2002, 106(34): 8493-8498.
[8] Woodbury E J, Ng W K. Ruby laser operation in near IR[J]. Proceedings of the Institute of Radio Engineers, 1962, 50(11): 2367.
[9] Ploetz E, Laimgruber S, Berner S, et al. Femtosecond stimulated Raman microscopy[J]. Applied Physics B, 2007, 87(3): 389-393.
[10] Freudiger C W, Min W, Saar B G, et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy[J]. Science, 2008, 322(5909): 1857-1861.
[11] Saar B G, Freudiger C W, Reichman J, et al. Video-rate molecular imaging in vivo with stimulated Raman scattering[J]. Science, 2010, 330(6069): 1368-1370.
[12] Dudovich N, Oron D, Silberberg Y. Single-pulse coherently controlled nonlinear Raman spectroscopy and microscopy[J]. Nature, 2002, 418(6897): 512-514.
[13] Bremer M T, Dantus M. Standoff explosives trace detection and imaging by selective stimulated Raman scattering[J]. Applied Physics Letters, 2013, 103(6): 061119.
[14] Cheng J X, Volkmer A, Book L D, et al. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity[J]. The Journal of Physical Chemistry B, 2001, 105(7): 1277-1280.
[17] Rocha-Mendoza I, Langbein W, Borri P. Coherent anti-Stokes Raman microspectroscopy using spectral focusing with glass dispersion[J]. Applied Physics Letters, 2008, 93(20): 201103.
[18] Hellerer T. Enejder A M K, Zumbusch A. Spectral focusing: high spectral resolution spectroscopy with broad-bandwidth laser pulses[J]. Applied Physics Letters, 2004, 85(1): 25-27.
[19] Langbein W, Rocha-Mendoza I, Borri P. Coherent anti-Stokes Raman micro-spectroscopy using spectral focusing: theory and experiment[J]. Journal of Raman Spectroscopy, 2009, 40(7): 800-808.
[20] Chen B C, Sung J, Wu X X, et al. Chemical imaging and microspectroscopy with spectral focusing coherent anti-Stokes Raman scattering[J]. Journal of Biomedical Optics, 2011, 16(2): 021112.
[22] Pegoraro A F, Ridsdale A, Moffatt D J, et al. Optimally chirped multimodal CARS microscopy based on a single Ti∶sapphire oscillator[J]. Optics Express, 2009, 17(4): 2984-2996.
[23] Vartiainen E M, Rinia H A, Müller M, et al. Direct extraction of Raman line-shapes from congested CARS spectra[J]. Optics Express, 2006, 14(8): 3622-3630.
[24] Liu Y X, Lee Y J, Cicerone M T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform[J]. Optics Letters, 2009, 34(9): 1363-1365.
[25] Garbacik E T, Herek J L, Otto C, et al. Rapid identification of heterogeneous mixture components with hyperspectral coherent anti-Stokes Raman scattering imaging[J]. Journal of Raman Spectroscopy, 2012, 43(5): 651-655.
[29] Wang K, Zhang D L, Charan K, et al. Time-lens based hyperspectral stimulated Raman scattering imaging and quantitative spectral analysis[J]. Journal of Biophotonics, 2013, 6(10): 815-820.
[30] Wang P, Li J J, Wang P, et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated Raman scattering microscopy[J]. Angewandte Chemie International Edition, 2013, 52(49): 13042-13046.
[31] Fu D, Holtom G, Freudiger C, et al. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers[J]. The Journal of Physical Chemistry B, 2013, 117(16): 4634-4640.
[32] Fu D, Zhou J, Zhu W S, et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering[J]. Nature Chemistry, 2014, 6(7): 614-622.
[34] Lu F K, Ji M B, Fu D, et al. Multicolor stimulated Raman scattering microscopy[J]. Molecular Physics, 2012, 110(15/16): 1927-1932.
[35] Nan X L, Cheng J X, Xie X S. Vibrational imaging of lipid droplets in live fibroblast cells with coherent anti-Stokes Raman scattering microscopy[J]. Journal of Lipid Research, 2003, 44(11): 2202-2208.
[36] Mitra R, Chao O, Urasaki Y, et al. Detection of lipid-rich prostate circulating tumour cells with coherent anti-Stokes Raman scattering microscopy[J]. BMC Cancer, 2012, 12: 540.
[37] Okuno M, Kano H, Fujii K, et al. Surfactant uptake dynamics in mammalian cells elucidated with quantitative coherent anti-Stokes Raman scattering microspectroscopy[J]. PLoS One, 2014, 9(4): e93401.
[39] Fu Y, Wang H F, Huff T B, et al. Coherent anti-Stokes Raman scattering imaging of myelin degradation reveals a calcium-dependent pathway in lyso-PtdCho-induced demyelination[J]. Journal of Neuroscience Research, 2007, 85(13): 2870-2881.
[40] Shi Y Z, Kim S, Huff T B, et al. Effective repair of traumatically injured spinal cord by nanoscale block copolymer micelles[J]. Nature Nanotechnology, 2010, 5(1): 80-87.
[41] Huff T B, Cheng J X. In vivo coherent anti-Stokes Raman scattering imaging of sciatic nerve tissue[J]. Journal of Microscopy, 2007, 225(2): 175-182.
[42] Jung Y, Ng J H, Keating C P, et al. Comprehensive evaluation of peripheral nerve regeneration in the acute healing phase using tissue clearing and optical microscopy in a rodent model[J]. PLoS One, 2014, 9(4): e94054.
[46] Galli R, Uckermann O, Koch E, et al. Effects of tissue fixation on coherent anti-Stokes Raman scattering images of brain[J]. Journal of Biomedical Optics, 2014, 19(7): 071402.
[47] Hellerer T, Axang C, Brackmann C, et al. Monitoring of lipid storage in Caenorhabditis elegans using coherent anti-Stokes Raman scattering (CARS) microscopy[J]. Proceedings of the National Academy of Sciences, 2007, 104(37): 14658-14663.
[48] Yen K, Le T T, Bansal A, et al. A comparative study of fat storage quantitation in nematode Caenorhabditis elegans using label and label-free methods[J]. PLoS One, 2010, 5(9): e12810.
[49] Le T T, Duren H M, Slipchenko M N, et al. Label-free quantitative analysis of lipid metabolism in living Caenorhabditis elegans[J]. Journal of Lipid Research, 2010, 51(3): 672-677.
[51] Breunig H G, Weinigel M, Bückle R, et al. Clinical coherent anti-Stokes Raman scattering and multiphoton tomography of human skin with a femtosecond laser and photonic crystal fiber[J]. Laser Physics Letters, 2013, 10(2): 025604.
[53] Ji M, Orringer D A, Freudiger C W, et al. 5(201): 201ra119[J]. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine, 2013.
[55] Li J J, Condello S, Thomes-Pepin J, et al. Lipid desaturation is a metabolic marker and therapeutic target of ovarian cancer stem cells[J]. Cell Stem Cell, 2017, 20(3): 303-314.
[57] Ji MB, ArbelM, Zhang LL, et al., 2018, 4(11): eaat7715.
[58] Yan S, Cui S S, Ke K, et al. Hyperspectral stimulated Raman scattering microscopy unravels aberrant accumulation of saturated fat in human liver cancer[J]. Analytical Chemistry, 2018, 90(11): 6362-6366.
[59] Zhang L L, Zou X, Zhang B H, et al. Label-free imaging of hemoglobin degradation and hemosiderin formation in brain tissues with femtosecond pump-probe microscopy[J]. Theranostics, 2018, 8(15): 4129-4140.
[60] Zhang B H, Sun M X, Yang Y F, et al. Rapid, large-scale stimulated Raman histology with strip mosaicing and dual-phase detection[J]. Biomedical Optics Express, 2018, 9(6): 2604-2613.
[61] Zhang L L, Wu Y Z, Zheng B, et al. Rapid histology of laryngeal squamous cell carcinoma with deep-learning based stimulated Raman scattering microscopy[J]. Theranostics, 2019, 9(9): 2541-2554.
[62] Hu C R, Zhang D L, Slipchenko M N, et al. Label-free real-time imaging of myelination in the Xenopus laevis tadpole by in vivo stimulated Raman scattering microscopy[J]. Journal of Biomedical Optics, 2014, 19(8): 086005.
[63] Zhang D L, Slipchenko M N, Cheng J X. Highly sensitive vibrational imaging by femtosecond pulse stimulated Raman loss[J]. The Journal of Physical Chemistry Letters, 2011, 2(11): 1248-1253.
[64] Wang M C, Min W, Freudiger C W, et al. RNAi screening for fat regulatory genes with SRS microscopy[J]. Nature Methods, 2011, 8(2): 135-138.
[65] Wang P, Liu B, Zhang D L, et al. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations[J]. Angewandte Chemie International Edition, 2014, 53(44): 11787-11792.
[66] Li X S, Li Y, Jiang M J, et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by stimulated Raman scattering microscopy[J]. Analytical Chemistry, 2019, 91(3): 2279-2287.
[68] Seidel J, Miao Y P, Porterfield W, et al. Structure-activity-distribution relationship study of anti-cancer antimycin-type depsipeptides[J]. Chemical Communications, 2019, 55(63): 9379-9382.
Article Outline
李姿霖, 李少伟, 张思鹭, 沈炳林, 屈军乐, 刘丽炜. 相干拉曼散射显微技术及其在生物医学领域的应用[J]. 中国激光, 2020, 47(2): 0207005. Li Zilin, Li Shaowei, Zhang Silu, Shen Binglin, Qu Junle, Liu Liwei. Coherent Raman Scattering Microscopy Technique and Its Biomedical Applications[J]. Chinese Journal of Lasers, 2020, 47(2): 0207005.







