藻细胞显微成像中微流控自动进样分段控制方法
0 引 言
藻类分类鉴别[1-4]及定量分析在水生态环境保护、水质安全监测、生物研究等领域具有重要的应用价值。基于形态学的藻类分类鉴别方法是当前发展方向之一,其中藻细胞图像的高质量自动获取是分类鉴别的基础。
流式细胞术与显微摄像结合是实现藻类显微成像的一种有效方式[5]。微流控芯片具有低成本、易制造、高透光性等优点,被广泛应用在细胞研究方面[6],可与显微成像技术耦合实现细胞显微成像。国外一些研究人员结合手机成像和微流控芯片技术设计了细胞检测装置,并实现了实时图像处理[7-9]。Heo等[10]利用微流控芯片通过极少的硬件获取了单细胞图像,用以分析细胞群。Goudar等[11]利用自组装细胞阵列芯片上获取肿瘤细胞图像自动获取。Fan等[12]通过微流体平台与点阵光片显微镜构建了成像系统,实现了亚细胞分辨率的细胞图像连续获取。国内楚惠[13]基于手机图像采集结合微流控技术实现了海洋藻类细胞形态特征的提取与辨别。显微成像中进样速度与细胞图像质量往往不能兼顾,因此,进样速度较快时,常采用高速相机以获取高质量图像,但此时存在因数据量大而难以储存和处理的缺陷[14];进样速度较慢时,检测效率低[15],实现藻类细胞进入成像区域之前的进样控制,在保证藻细胞成像质量的同时,可快速自动获取藻细胞图像并提高进样效率,将具有重大的应用价值。因此,当样品流中无藻细胞存在时,自动进样可高速进行;当有藻细胞存在时,需降低进样速度以便成像检测,然而其中关键在于如何预知藻细胞进入显微成像区域的时间,以及如何进行进样控制以实现藻细胞图像的有效获取。基于此,本文研究了基于藻细胞通过荧光检测窗口持续时间的样品平均流速检测方法,以及基于体积流量调节的微流控自动进样分段控制方法。
1 实验装置与方法
1.1 实验装置
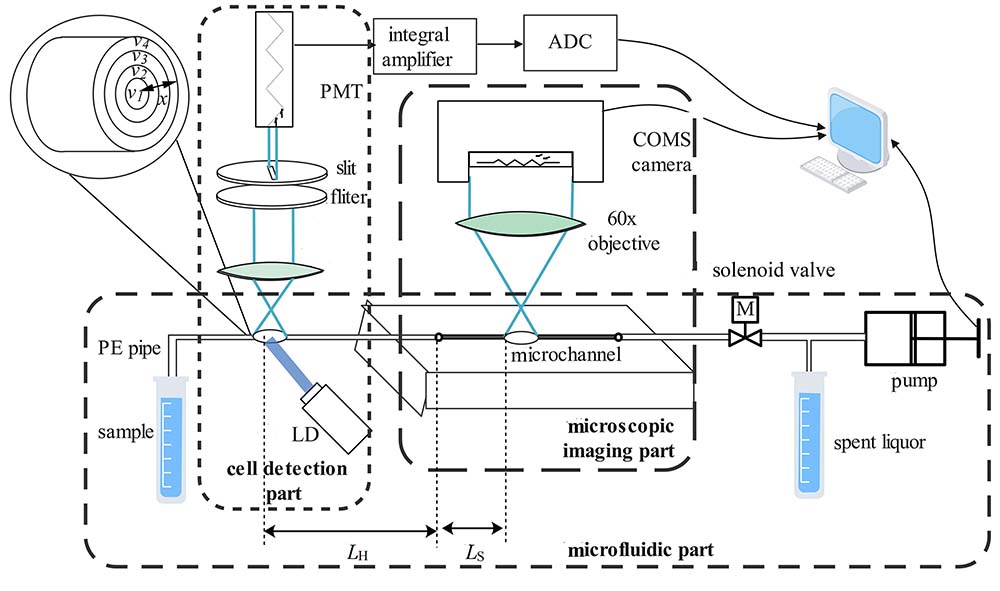
设计的微流控-显微成像藻细胞检测实验装置由细胞检测、显微成像和微流路控制三部分组成,如
1.2 样品流速检测方法
样品流速直接影响细胞成像质量和进样检测效率。细胞进样过程中微流路由于存在层流特性,管道内同截面液体流速并不一致,常规进样控制方式并不能简单适用[16-18]。因此,藻细胞在不同层流内的速度检测是实现快速自动进样的前提。本研究提出了一种基于藻细胞经过荧光检测窗口持续时间反演藻细胞速度方法,并以此计算样品流速,细胞速度检测原理如

图 2. 细胞速度检测原理示意图。(a) 二值化处理的荧光信号; (b) 藻细胞荧光信号; (c) 藻细胞荧光检测过程
Fig. 2. Schematic diagram of cell detection device. (a) Binarized fluorescence signal; (b) fluorescence signal of algal cell;(c) detection process of algal cell fluorescence
1) 记录藻细胞通过荧光检测窗口W时的特征荧光信号[
1.3 自动进样分段控制方法
显微成像区域在微流路中所占体积为0.004 μL,最高成像分辨率为3704 × 2778,曝光时间为10 ms时,COMS相机传出帧率为10,藻细胞经过显微成像区域时间大于1 s时均能获得较高质量图像 (拖影约0.4 μm,可忽略),此时低速运输藻细胞的体积流量不能超过0.24 μL/min。
藻细胞在荧光检测窗口被检测到后,在进入显微成像区域之前,管道分为PE导管长度LH (100 mm) 和微通道长度LS (10 mm) 两个部分,体积分别为6.16 μL和0.10 μL,如
2 结果与讨论
2.1 细胞荧光检测实验分析
2.1.1 荧光检测装置有效性验证
为了验证荧光检测装置具备单个细胞与其被激发的荧光信号一一对应的特性,实现单细胞检测高灵敏度,实验验证如下:降低藻细胞含量进样,利用COMS相机观察管道内藻细胞个数,确定每次通过管道内藻细胞为单个细胞时的藻溶液的细胞含量;利用荧光检测窗口对此细胞含量下的藻液进行检测,由于通道内每次只有单个细胞通过,则此时荧光信号为单个细胞荧光,结果如
由图可以看出,在保证管路中每次只要单个细胞通过时,单个细胞荧光信号显著且具有较高的独立性,细胞间无相互影响,则荧光检测装置检测细胞具有较高检测可靠性。此外,实际实验中气泡的大小是明显与细胞大小相异的,其带来的误检影响可忽略,即使产生类似的信号,在成像过程中气泡与细胞颜色、形状等完全不同,在图像采集中也可规避其带来的误检影响。
2.1.2 样品流速分析
在微尺度上,常规μL/min或μL/s数量级的进样速度条件下微流路中多数流体为低雷诺数层流,各层流间速度差异较大,流体中10 µm以下粒径粒子速度与该粒子所在层流的流速近似相同[19]。基于藻细胞荧光检测得到的细胞速度为某个层流速度,与基于流量计算出的平均流速不能直接对比。通过统计单位时间内通过管路某一截面均匀分布的大量粒子速度概率分布 (

图 5. 单位时间内通过某截面的粒子速度概率分布
Fig. 5. Probability distribution of particle velocity passing through a section in unit time
在流体粒子速度检测实验中,将注射泵体积流量设定为5、10、20、30、40、60、80 μL/min,分别统计了10 min内不同体积流量进样速度下的藻细胞速度分布规律,如

图 6. 不同体积流量进样速度下藻细胞速度分布及拟合曲线。(a) 10 μL/min; (b) 20 μL/min; (c) 30 μL/min; (d) 40 μL/min
Fig. 6. Velocity distribution of algae cells under different volumetric flow rates and fitted curve.(a) 10 μL/min; (b) 20 μL/min; (c) 30 μL/min; (d) 40 μL/min
采用加权平均方法得到单位时间内通过荧光检测窗口藻细胞的平均速度,作为样品平均流速,并与理论平均速度对比分析,结果如
表 1. 样品平均流速与理论结果对比
Table 1. Comparison of sample average flow rate and theoretical rate results
|
2.2 藻细胞成像分析
不同流速下自动获取的藻细胞图像与显微镜检结果如

图 7. 不同流速下藻细胞自动获取图像与显微镜检结果。(a) 0.24 μL/min; (b) 1.50 μL/min; (c) 6.00 μL/min; (d) 镜检图像
Fig. 7. Automatic acquisition of algae cell images at different flow rates and microscopy results. (a) 0.24 μL/min;(b) 1.50 μL/min; (c) 6.00 μL/min; (d) images obtained through microscope
表 2. 成像质量对比
Table 2. Comparision of image quality
|
2.3 分段控制进样效率分析
为了验证进样分段控制效果,实验中高速运动区域体积流速设为10 μL/min,低速运动区域体积流速设为0.24 μL/min,进行8组实验,每次进样三次。对比不同藻细胞运输至显微成像区域所需时间,并与慢速进样时间对比分析,以平均进样时间评价分段控制效果,如
表 3. 分段控制和慢速进样的进样时间对比
Table 3. Comparison of injection times between segmented control and slow injection
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3 结 论
基于藻细胞通过荧光检测窗口持续时间的样品平均流速检测方法能够实现藻细胞的快速移动速度检测,在流速10~30 μL/min范围具有较高检测可靠性;基于体积流量调节的微流控自动进样分段控制方法能够自动获取高质量藻细胞图像,同时样品进样速度提升68%以上;本研究方法解决了样品进样效率与细胞成像质量不能同时兼顾的难题,为微流控-显微成像技术的进一步应用提供了方法基础。
[1] 王世忠, 李继刚, 高 志, 等. 海水藻类和悬浮物浓度测量仪应用研究[J]. 海洋技术, 2001, 20(1): 97-103.
Wang S Z, Li J G, Gao Z, et al. Optical spectral discrimination and titer of phytoplankton & suspension[J]. Ocean Technology, 2001, 20(1): 97-103.
[2] 张前前, 类淑河, 王修林, 等. 浮游植物活体三维荧光光谱分类判别方法研究[J]. 光谱学与光谱分析, 2004, 24(10): 1227-1229.
Zhang Q Q, Lei S H, Wang X L, et al. Research on discrimination of 3D fluorescence spectra of phytoplanktons[J]. Spectroscopy and Spectral Analysis, 2004, 24(10): 1227-1229.
[3] 王海黎, 洪华生, 徐 立. 反相高效液相色谱法分离、测定海洋浮游植物的叶绿素和类胡萝卜素[J]. 海洋科学, 1999, 23(4): 6-9.
Wang H L, Hong H S, Xu L. Separation and determination of chlorophylls and carotenoids from marine phytoplankton by rp-hplc[J]. Marine Sciences, 1999, 23(4): 6-9.
[4] 张 雯. 基于形态学与不完全树形小波分解的藻类图像纹理识别算法的研究 [D]. 青岛: 中国海洋大学, 2012.
ZhangW. Research on Algae Image Texture Recognition Algorithm Based on Morphology and Incomplete Tree Wavelet Decomposition [D]. Qingdao: Ocean University of China, 2012.
[5] Qiao X Y. Research on imbalanced microscopic image classification of harmful algae[J]. IEEE Access, 2020, 8: 125438-125446.
[6] 王立凯, 冯喜增. 微流控芯片技术在生命科学研究中的应用[J]. 化学进展, 2005, 17(3): 482-498.
Wang L K, Feng X Z. Microfluidic network for research and application in life sciences[J]. Progress in Chemistry, 2005, 17(3): 482-498.
[7] Zhu H Y, Mavandadi S, Coskun A F, et al. Optofluidic fluorescent imaging cytometry on a cell phone[J]. Analytical Chemistry, 2011, 83(17): 6641-6647.
[8] Smith Z J, Chu K Q, Espenson A R, et al. Cell-phone-based platform for biomedical device development and education applications[J]. PLoS One, 2011, 6(3): e17150.
[9] Liang C, Liu Y C, Niu A Y, et al. Smartphone-app based point-of-care testing for myocardial infarction biomarker cTnI using an autonomous capillary microfluidic chip with self-aligned on-chip focusing (SOF) lenses[J]. Lab on a Chip, 2019, 19(10): 1797-1807.
[10] Heo Y J, Lee D, Kang J S, et al. Real-time image processing for microscopy-based label-free imaging flow cytometry in a microfluidic chip[J]. Scientific Reports, 2017, 7: 11651.
[11] Goudar V S, Yeh P H, Wu S Y, et al. Live circulating tumour cells selection on digitized self-assembled cell array (Digi-saca) chip by in-parallel/in-situ image analysis, cell capture, and cultivation[J]. Sensors and Actuators B: Chemical, 2020, 316: 128002.
[12] Fan Y J, Hsieh H Y, Tsai S F, et al. Microfluidic channel integrated with a lattice lightsheet microscopic system for continuous cell imaging[J]. Lab on a Chip, 2021, 21(2): 344-354.
[13] 楚 惠. 基于图像流式细胞技术的微藻检测系统设计 [D]. 大连: 大连海事大学, 2016.
ChuH. Design of Microalgae Detection System Based on Image Flow Cytometry [D]. Dalian: Dalian Maritime University, 2016.
[14] Han Y Y, Gu Y, Zhang A C, et al. Review: Imaging technologies for flow cytometry[J]. Lab on a Chip, 2016, 16(24): 4639-4647.
[15] Hassan S U, Tariq A, Noreen Z, et al. Capillary-driven flow microfluidics combined with smartphone detection: An emerging tool for point-of-care diagnostics[J]. Diagnostics (Basel, Switzerland ), 2020, 10(8): 509.
[16] Shoji S, Kawai K. Flow control methods and devices in micrometer scale channels[J]. Topics in Current Chemistry, 2011, 304: 1-25.
[17] Campo-DeañoL. Fluid-flow Characterization in Microfluidics [M]. Francisco J G R.Complex Fluid-Flows in Microfluidics. Cham: Springer International Publishing, 2017.
[18] Huang W H, Cheng W, Zhang Z, et al. Transport, location, and quantal release monitoring of single cells on a microfluidic device[J]. Analytical Chemistry, 2004, 76(2): 483-488.
[19] 姜 楠. 谈谈流体中微粒的“功”与“过”[J]. 力学与实践, 2013, 35(6): 107-110.
Article Outline
陈志浩, 赵南京, 殷高方, 马明俊, 董鸣, 华卉, 丁志超. 藻细胞显微成像中微流控自动进样分段控制方法[J]. 大气与环境光学学报, 2024, 19(1): 38. Zhihao CHEN, Nanjing ZHAO, Gaofang YIN, Mingjun MA, Ming DONG, Hui HUA, Zhichao DING. A subsection control method of microfluidic automatic sampling in algal cell microscopic imaging[J]. Journal of Atmospheric and Environmental Optics, 2024, 19(1): 38.