基于光学相干层析技术的昆虫胚胎影像处理方法  下载: 808次
下载: 808次
Objective Embryonic development has attracted increasing attention in biological research. Monitoring the internal organs and tissues of an embryo is relevant to the study of embryonic development. Generally, two methods are employed to monitor tissues in the embryo: tissue section technology and stereomicroscope observation. Both methods need to kill the embryo and cannot monitor a single living embryo continuously. Therefore, noninvasive real-time monitoring of embryonic development is expected to understand the morphological evolution process. Optical coherence tomography (OCT) is a relatively novel imaging method in the 21st century and is based on the principle of low coherence interference. It uses near-infrared light to scan the sample noninvasively, and then a three-dimensional image reconstruction is performed. OCT can provide internal structure information with a depth of 1--12 mm below the sample surface. Several research groups have reported studies on the embryonic development of different animals, such as Xenopus, mice, and birds, using OCT. However, there are few reports on the application of OCT to insect embryonic development. The main reason is that insect embryos are usually wrapped with eggshells that protect the embryo from external damage. This morphology of the insect embryo significantly affects the real-time monitoring of its development. Therefore, a method that can automatically identify the edge and thickness of the eggshell and intelligently erase it is required.
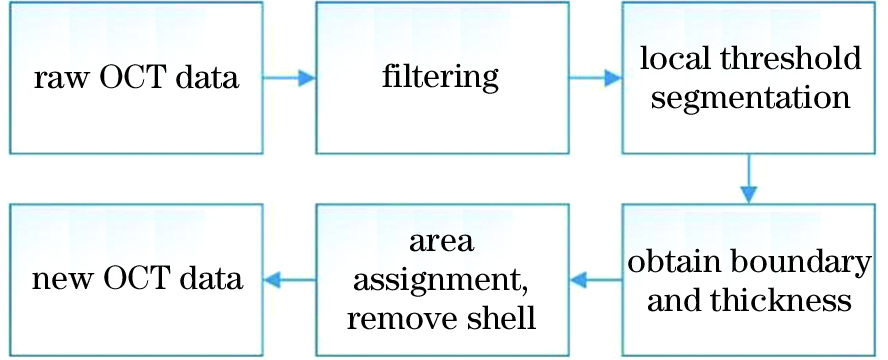
Methods An image processing method is proposed in this paper to eliminate the effect of eggshells on OCT imaging. This method can automatically identify and erase the area of the eggshells so that the clear three-dimensional image of the embryo inside the eggshell is presented. As shown in Fig.1, first, the three-dimensional image is filtered to reduce noise; second, local threshold segmentation and boundary recognition are performed; and then the position and thickness of eggshells can be extracted and erased in the original image. Afterward, the three-dimensional image of the embryo phenotype can be presented. Noise is often introduced during the real-time OCT image acquisition process, which can severely influence the effect of eggshell edge detection. Therefore, the original three-dimensional image denoising is an indispensable operation in image preprocessing. After comparing various image-denoising methods (Fig.2), the median filtering is selected. Figure 5(b) shows that the contrast is higher between the eggshell edge and the internal structure after noise reduction. However, the inner boundary of the eggshell is still connected with the yolk and embryo, which can cause measurement error when extracting the thickness of the eggshell. Therefore, local threshold segmentation is employed to solve the problem, and detailed procedures are shown in Fig. 4. Figure 5(c) shows the binary image in which the grey value of the eggshell is 255, whereas, other regions are 0 after local threshold segmentation. Hence, the first junction between 255 and 0 is the outer boundary of the eggshell, and the second is the inner boundary. Thus, the location and thickness of the outer and inner boundary of the eggshell can be obtained by counting the number of pixel points with a grey value of 255 between the two junctions in each A-scan image. Notably, the eggshell edge is non-smooth after local threshold segmentation. Consequently, the second filtering is used to smoothen the edge, which ensures accurate measurements.
Results and Discussions Figure 6 shows the comparison of OCT imaging results before and after eggshell removal on the 11th day of locust egg development. As shown in Fig. 6 (a), the internal morphology of the embryo is covered by eggshell and is not visible. After using the eggshell removal method to process the image, the head, antennae, abdomen, and feet of the embryo are clearly seen in the three-dimensional projection of XY [Fig. 6(b)]. Figures 6 (c) and (d) are two-dimensional cross-sectional images of XY with depths of 0.67 and 0.88 mm, respectively. Although these cross-sectional images are not affected by the eggshell, they cannot reflect the overall changes of the embryonic development morphology and are significantly different from the three-dimensional image of Fig. 6(b). By contrast, Fig. 6(b) is a suitable three-dimensional image to study embryonic development. Therefore, this is the purpose and significance of the eggshell removal method proposed in this paper. Equipped with the eggshell removal method, Fig. 7 shows the embryonic development process observed on days 6 to 14 clearly.
Conclusions Because the insect embryo is wrapped by an eggshell, the three-dimensional OCT image cannot directly show the whole morphology of the embryo inside the egg. Therefore, in this study, we propose an image processing method to eliminate the effect of eggshell on OCT imaging. This method can automatically determine the boundary and thickness of eggshell and erase it. Compared with traditional invasive detection methods that are complicated in operation, time-consuming, and cannot continuously monitor a single living embryo, OCT has the advantages of noninvasive, real-time, and high-speed nature to obtain more accurate monitoring results of embryonic development. This image processing method is helpful to the application of OCT in the study of insect embryonic development.
1 引言
胚胎发育是生物体研究中的重要组成部分之一,而监测胚胎内部的器官和组织对于胚胎发育研究至关重要。组织切片技术和体视显微镜观察是两种常用的生物胚胎观察手段,前者需要对胚胎进行切片才能观察,而后者则需要解剖样本后才能进行观察[1]。无论是组织切片技术还是体视显微镜观察,都会破坏样本,且不同发育阶段需要制作不同的样本,既耗时又需要大量的样本。此外,在观察时需要将样本固定,因此会人为地改变样本原有的形态和外观,间接影响实验结果。因此,迫切需要一种高效、无创的成像手段用于生物体胚胎发育的监测。
光学相干层析(OCT)技术是21世纪新发展起来的成像技术,不同于计算机断层扫描(CT)、磁共振成像(MRI)、X射线扫描等成像技术,OCT技术主要利用低相干干涉原理,使用近红外光对样本进行无损伤的扫描成像,在保证分辨率的前提下,可以提供样本表面以下1~3 mm深度范围内的内部结构信息。此外,OCT技术还可以实现实时监测,可用于监测活体生物体在不同时间段的胚胎内部发育情况[2]。因此,OCT技术的无创性、高效性、实时性和三维成像等特点可以很好地弥补组织切片技术和体视显微镜观察的不足,成为生物体胚胎发育监测的有力手段。
近年来,OCT技术在生物体中的应用越来越多[3-5],该技术除了可以实现对胚胎发育的实时监测外,还可以对胚胎内器官的形态和功能进行评估。斑马鱼在胚胎和刚孵化阶段是透明的,研究人员使用OCT技术对斑马鱼的胚胎发育情况进行了观察和记录,还清楚地观察到了胚胎的角膜、虹膜、晶状体视网膜等眼部特征[6]。非洲爪蟾中的白化爪蟾是透明的,且爪蟾的胚胎易于处理,因此OCT技术也被用于观察非洲爪蟾的胚胎发育以及心脏功能监测[7]。除此之外,OCT技术也常被用于小鼠和禽类的胚胎检测[8-9]。但是,目前关于应用OCT技术研究昆虫胚胎发育的文献却鲜有报道,其主要原因在于昆虫胚胎多被卵壳包裹(保障胚胎的正常发育)。在使用OCT技术对昆虫卵进行成像时,由于卵壳的存在,其三维图像中内部胚胎的形貌特征会被遮盖,从而影响了对昆虫胚胎发育的实时监测。
本文结合OCT技术的成像特点,选择飞蝗卵作为样本[10],提出了一种可以自动识别昆虫胚胎卵壳位置和厚度并能智能“擦除”卵壳的图像处理方法,消除了卵壳对胚胎三维形貌成像的影响,实现了对昆虫类生物胚胎发育过程的无损、清晰监测。
2 昆虫胚胎卵壳的处理流程
1) 滤波降噪
在使用OCT实时采集图像时,会不可避免地引入噪声,噪声的存在会严重影响卵壳边缘的检测效果。因此,对采集到的原始图像进行降噪处理是图像预处理中不可缺少的操作[11-12]。常用的图像滤波方法有中值滤波、均值滤波、高斯滤波和维纳滤波。
式中:f(x,y)、g(x,y)分别表示中值滤波处理前和处理后该像素点的灰度值;W表示选取的邻域大小;k、l为邻域范围内的位置坐标。从(1)式可以看出,各个像素点最终的灰度值由该点的灰度值及其邻域内所有像素点的灰度值共同决定。这种方法可以有效地去除随机噪声,同时可以很好地保留图像的边缘信息,这种滤波器被称为空间滤波器。除中值滤波器外,其余三种滤波器也均属于空间滤波器,不同的是:均值滤波器选择某一像素点邻域范围内的平均值作为该点的最终输出值;高斯滤波器对整幅图像进行加权平均,每一个像素点的值都由其本身和邻域内的其他像素值经过加权平均后得到;维纳滤波器则是基于最小均方误差准则,使输出像素值与期望值之间的均方误差最小。
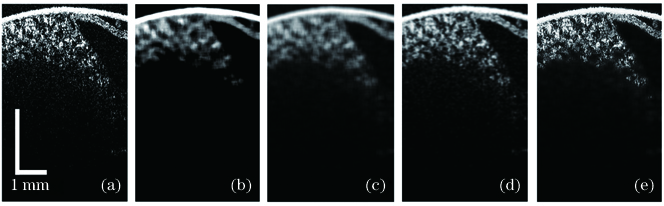
图 2. 不同滤波方法的对比。(a)原始OCT图像;(b)中值滤波;(c)均值滤波;(d)高斯滤波;(e)维纳滤波
Fig. 2. Comparison of different filtering methods. (a) Original OCT image; (b) median filtering; (c) mean filtering; (d) Gaussian filtering; (e) Wiener filtering
无论选择哪种滤波器,邻域范围的选择都会对最终图像的处理结果产生很大影响:邻域范围选择过小,降噪的效果可能不理想;范围选择过大则会造成过度滤波,使原有的信号信息变得模糊。
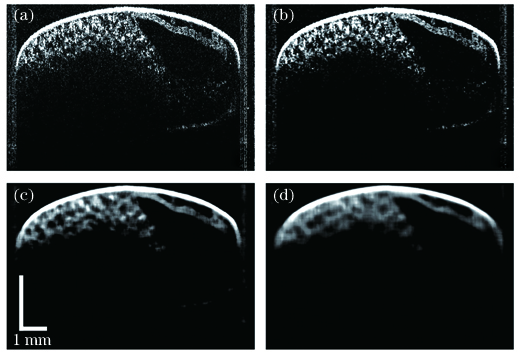
图 3. 选择不同邻域范围进行中值滤波后的图像。(a)原始OCT图像;(b)邻域范围3×3;(c)邻域范围11×11;(d)邻域范围19×19
Fig. 3. Images processed by different neighborhood sizes of median filtering. (a) Original OCT image; (b) neighborhood size of 3×3; (c) neighborhood size of 11×11; (d) neighborhood size of 19×19
2) 局部阈值分割
对原始OCT图像进行采用中值滤波处理后,卵壳边缘与内部结构形成了较高的对比度,但卵壳内边界与卵黄、胚胎依旧连接,这会导致提取卵壳厚度信息时产生误差,因此需要进一步进行处理。这里主要采用局部阈值分割方法对图像进行处理,如
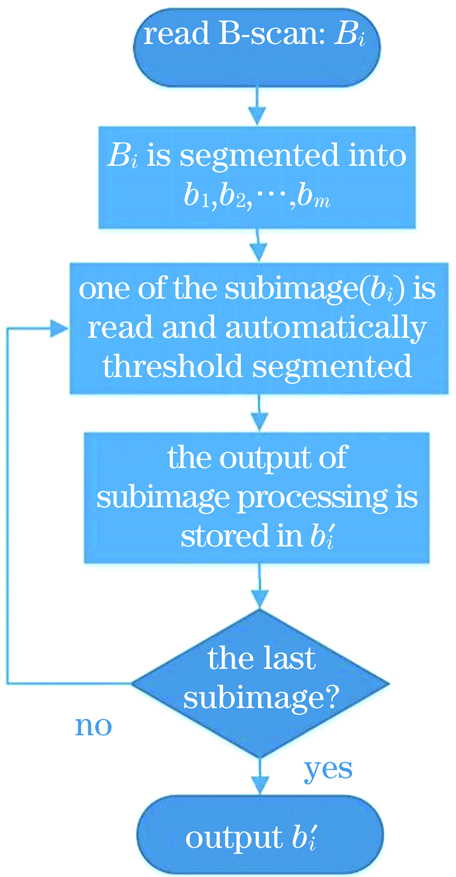
图 4. 原始OCT图像的局部阈值分割方法流程
Fig. 4. Local threshold segmentation method of original OCT images
局部阈值分割方法的步骤如下:
A)设OCT三维图IMG1由n幅B-scan图(二维图)组成,分别为B1,B2,…,Bn。读取其中的某一幅Bi(0<i<n)进行处理。
B)将Bi分割为m幅子图像b1,b2,…,bm。
C)读取子图像bj(0<j<m),对其进行自动灰度阈值分割:a)选取一个初始估计值X;b)用X分割图像,这样便会生成两组像素集合Y1和Y2(Y1由所有灰度值大于X的像素组成,而Y2由所有灰度值小于或等于X的像素组成);c)计算Y1和Y2中所有像素的平均灰度值W1和W2;d)计算新的阈值X,X=
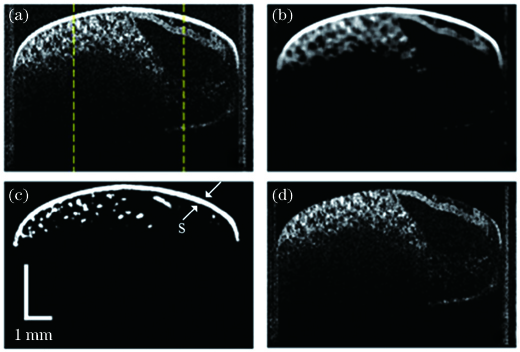
图 5. 昆虫胚胎影像的处理过程。(a)原始OCT图像;(b)滤波;(c)局部阈值分割(S,卵壳);(d)卵壳图像消除
Fig. 5. Image processing of insect embryo. (a) Original OCT image; (b) filtering; (c) local threshold segmentation(S, eggshell); (d) removal of eggshell image
D)返回步骤A),直至将OCT三维图的所有B-scan图处理完毕,得到二值化的三维图IMG2。
3) 卵壳边界识别及厚度检测
由于通过OCT系统样品臂的光首先进入卵壳,因此代表卵壳的白色区域一般在图像的上端。依据此特点可以取局部阈值处理后得到的二值化三维图IMG2中的每一个A-scan图,沿其深度方向逐点对各像素值进行判断。由于二值化后卵壳部分的像素值为“1”(灰度值255),其余部分的像素值为“0”(灰度值0),因此首先检测到的“1”和“0”的交界处即为卵壳的外边界,第二个“1”和“0”的交界处为卵壳内边界。通过统计每一个A-scan图中两个交界处的位置以及其中包含的“1”像素点的个数,即可得到卵壳上下边界的位置及其厚度。
3 实验部分
3.1 实验样本
本次实验选择的对象为飞蝗[14]。雌蝗产卵后,从产卵盆中筛选出卵块,用消过毒的软毛刷将虫卵从卵块中轻轻刷开,并置于蒸馏水中清洗其表面的泥土。将卵取出后再浸于酒精中进行表面杀菌处理,最后使用无尘纸吸干表面的水分。待所有卵都从卵块中剥离后,将卵整齐地排列在含琼脂凝胶的培养皿中,然后将培养皿置于30 ℃的恒温培养箱中进行饲养。在30 ℃的环境下,飞蝗的孵化时间一般为14 d[15]。从蝗卵发育的第4天开始,每日使用OCT对虫卵进行三维扫描成像,并使用上述提出的去除卵壳的方法对原始图像进行处理,观察蝗卵胚胎的发育情况。
3.2 实验仪器及参数
监测蝗卵发育的仪器为扫频OCT系统[16](型号为OCM1300SS-ENG),光源中心波长为1300 nm,扫描频率为16 kHz。当一帧B-scan设置512个A-scan时,成像速度可达25 frame/s。同时,该系统的横向分辨率为25 μm,轴向分辨率为12 μm,最大扫描范围(X×Y)为10 mm×10 mm,检测深度(Z方向)为3 mm,灵敏度为102 dB。在对卵进行监测时,快轴方向(x方向)设置的扫描范围是9 mm,慢轴方向(y方向)设置的扫描范围是2.5 mm。
4 结果与讨论
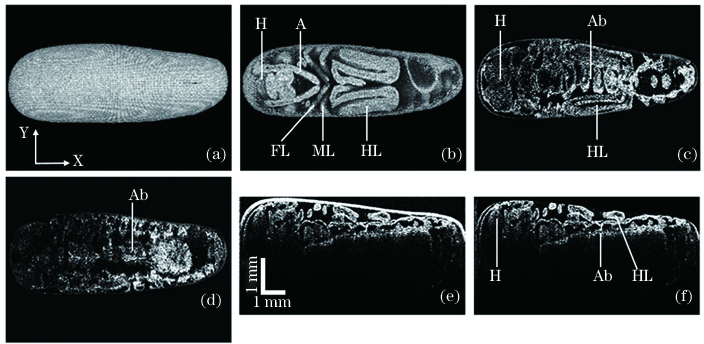
图 6. 去除卵壳前后的OCT图像对比,其中A表示触角,Ab表示腹部,FL表示前足,H表示头部,HL表示后足,ML表示中足。(a)XY面上的蝗卵三维投影图(包含卵壳);(b)XY面上的蝗卵三维投影图(去除卵壳);(c)XY面上的蝗卵二维截面图(深度为0.67 mm);(d)XY面上的蝗卵二维截面图(深度为0.88 mm);(e)XZ面上的蝗卵二维截面图(包含卵壳);(f)XZ面上的蝗卵二维截面图(去除卵壳)
Fig. 6. Comparison of OCT images before and after eggshell removing, where A represents antenna, Ab represents abdomen, FL represents fore legs, H represents head, HL represents hind legs, and ML represents mid legs. (a) Three-dimensional projection of locust egg on XY plane (include eggshell); (b) three-dimensional projection of locust egg on XY plane (erase eggshell); (c) two-dimensional cross-sectional image of locust egg on XY plane with depth of 0.67 mm; (d) two-dimensional cross-sectional image of locust egg on XY plane with depth of 0.88 mm; (e) two-dimensional cross-sectional image of locust egg on XZ plane (include eggshell); (f) two-dimensional cross-sectional image of locust egg on XY plane(erase eggshell)
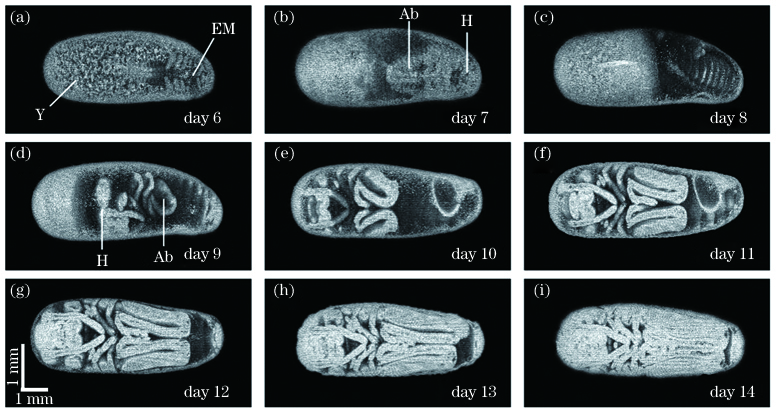
图 7. 去除卵壳后观察到的胚胎第6至第14天的发育过程,其中Y表示卵黄,EM表示胚胎,Ab表示腹部,H表示头部
Fig. 7. Embryonic development process observed on days 6 to 14 after removal of eggshell, where Y represents yolk, EM represents embryo, Ab represents abdomen, and H represents head
5 结论
昆虫胚胎一般由不透明的卵壳包裹,使得OCT扫描的三维图像无法直接呈现卵内部胚胎发育的具体情况。针对这一问题,本文提出了一种结合OCT三维成像特点来去除胚胎外层卵壳的处理方法。该方法可以自动确定卵壳边界所在的图像位置及厚度信息,在去除卵壳的同时不影响内部胚胎的成像。结果表明,采用该方法对昆虫胚胎影像进行处理后,能够准确且清晰地监测到昆虫胚胎发育的具体过程。该方法在应用OCT系统研究昆虫胚胎发育等方面具有重要的参考价值。
[1] 任金龙, 赵莉, 葛婧, 等. 意大利蝗的胚胎发育及卵滞育发生的胚胎发育阶段[J]. 昆虫学报, 2015, 58(11): 1201-1212.
Ren J L, Zhao L, Ge J, et al. Embryonic developmentof diapausing eggs in Calliptamus italicus(L.)(Orthoptera: Catantopidae)[J]. Acta Entomologica Sinica, 2015, 58(11): 1201-1212.
[4] 斯培剑, 王玲, 徐铭恩, 等. 基于光学相干层析成像技术的肿瘤细胞侵袭成像[J]. 中国激光, 2019, 46(9): 0907003.
[5] 汪权, 朋汉林, 汪平河, 等. 光学相干层析成像眼底视网膜三维图像去抖动方法[J]. 光学学报, 2019, 39(3): 0317001.
[9] 马振鹤, 窦世丹, 马毓姝, 等. 基于光学相干层析成像的早期鸡胚心脏径向应变测量[J]. 物理学报, 2016, 65(23): 235202.
Ma Z H, Dou S D, Ma Y S, et al. Measurement of wall strain in embryonic chick heart by spectral domain optical coherence tomography[J]. Acta Physica Sinica, 2016, 65(23): 235202.
[10] 马川, 康乐. 飞蝗的种群遗传学与亚种地位[J]. 应用昆虫学报, 2013, 50(1): 1-8.
Ma C, Kang L. Population genetics and the subspecific taxonomy of the migratory locust[J]. Chinese Journal of Applied Entomology, 2013, 50(1): 1-8.
[11] 何永健, 高应俊, 李逵, 等. 光学相干层析图像的处理研究[J]. 光子学报, 2009, 38(6): 1464-1468.
[12] 高阳, 李中梁, 张建华, 等. 光学相干层析成像图像中角膜厚度的自动测量方法[J]. 光学学报, 2019, 39(3): 0311003.
[13] 贺琪欲, 李中梁, 王向朝, 等. 基于光学相干层析成像的视网膜图像自动分层方法[J]. 光学学报, 2016, 36(10): 1011003.
[14] 景晓红, 康乐. 飞蝗越冬卵过冷却点的季节性变化及生态学意义[J]. 昆虫知识, 2003, 40(4): 326-328.
Jing X H, Kang L. Seasonal changes in the supercooling point of overwintering eggs of Locusta migratoria[J]. Entomological Knowledge, 2003, 40(4): 326-328.
[15] 郭郛. 中国飞蝗生物学[M]. 济南: 山东科学技术出版社, 1991.
GuoF. The biology of the migratory locusts in China[M]. Jinan: Shandong Science & Technology Press, 1991.
[16] 朱毅, 何永红, 李鹏, 等. 光学相干层析图像层状结构的增强与定量测量[J]. 光学学报, 2007, 27(3): 515-520.
Article Outline
买童童, 魏丽亚, 姚晓天, 苏亚, 王秀丽, 杨丽君. 基于光学相干层析技术的昆虫胚胎影像处理方法[J]. 中国激光, 2021, 48(9): 0907002. Tongtong Mai, Liya Wei, Steve Yao X., Ya Su, Xiuli Wang, Lijun Yang. Image Processing Method of an Insect Embryo Based on Optical Coherence Tomography[J]. Chinese Journal of Lasers, 2021, 48(9): 0907002.