无标记显微成像技术的研究进展  下载: 2380次
下载: 2380次
1 引言
显微镜将微小的、肉眼无法直接观测到的对象进行放大,它是人们研究微观世界的重要工具。其发明之初,人们理论上认为只要将显微镜片制作地足够精细优良,就可以观察到任意微小尺寸。1873年阿贝衍射极限的提出,使人们认识到物理衍射极限的存在,即光学显微镜技术的分辨率不可能小于0.61
与此同时,基于荧光标记的成像技术同样受到了人们的广泛关注。但是,荧光标记成像对荧光颗粒和成像样品都有着较为严格的要求,普适性不强,且其存在成像速度慢、易引起生物体排异反应等问题。荧光标记可使特定细胞成分可视化,但会遭遇荧光团的光漂白以及生物体的光毒性损害,带来额外的麻烦。而非荧光标记的超分辨显微方法在活体成像、多类样品成像,以及快速成像等方面具有天然的优势。通过在近场使用纳米尖端扫描物体,近场扫描光学显微镜[3]的空间分辨率已经达到了20 nm。然而,为了避免入侵和扰动,打破衍射极限的远场成像技术[4]较之近场扫描成像似乎更为理想。为了深入了解生物体的生命过程,尽可能降低对细胞系统的精确性、特异性、敏感性的破坏,无损监测待测物,显得尤为重要。
探索并发展宽场、远场且能快速成像的新型非标记显微技术已成为人们关注的难点与热点。在不使用荧光标记的情况下,对细胞水平基于高分辨率的显微技术提供非侵入性的在体组织检测或活细胞动态观察,能够尽可能的不污染待测物且不造成干扰。可以预见,在远场实现各种亚波长物体的宽场、无标记光学成像将是一个重大突破,在生物学、化学和物理学等领域具有广阔的应用前景。
2 无标记显微成像系统
无标记显微成像技术是一种无损、非接触式的检测技术,20世纪60年代引入激光作为成像的光源后,显微成像进入了发展的新时期,随后出现了很多类型的成像技术,并且在化学、生物和物理等领域得到了广泛的应用。光学相干断层扫描(OCT)成像技术探测的是生物体的后向散射光。光声成像是基于光学吸收差异、借用超声波为信息载体,来进行生物医学成像的技术。双光子显微镜可以检测到某些自体荧光物种,二次谐波和三次谐波方法能够分辨纤维结构和脂质体。拉曼显微镜可以检测特定类型的化学键,作为物质的“指纹”光谱,反映的是物质中分子振动和转动的信息,是研究分子结构的一种重要分析方法。微球透镜技术是一种巧妙的利用透明电介质微球耦合近场信息并将信号放大的技术,这种简单的技术为实时、无标记、高分辨的成像提出了创新的想法。这些成像技术运用的是内在的对比机制或者生物组织的自发荧光,无需标记、不干扰生物分子、细胞损伤低,目前无标记成像技术在实验室和医学研究机构中发挥着特有的优势,为临床应用开辟了新的途径。
2.1 OCT技术
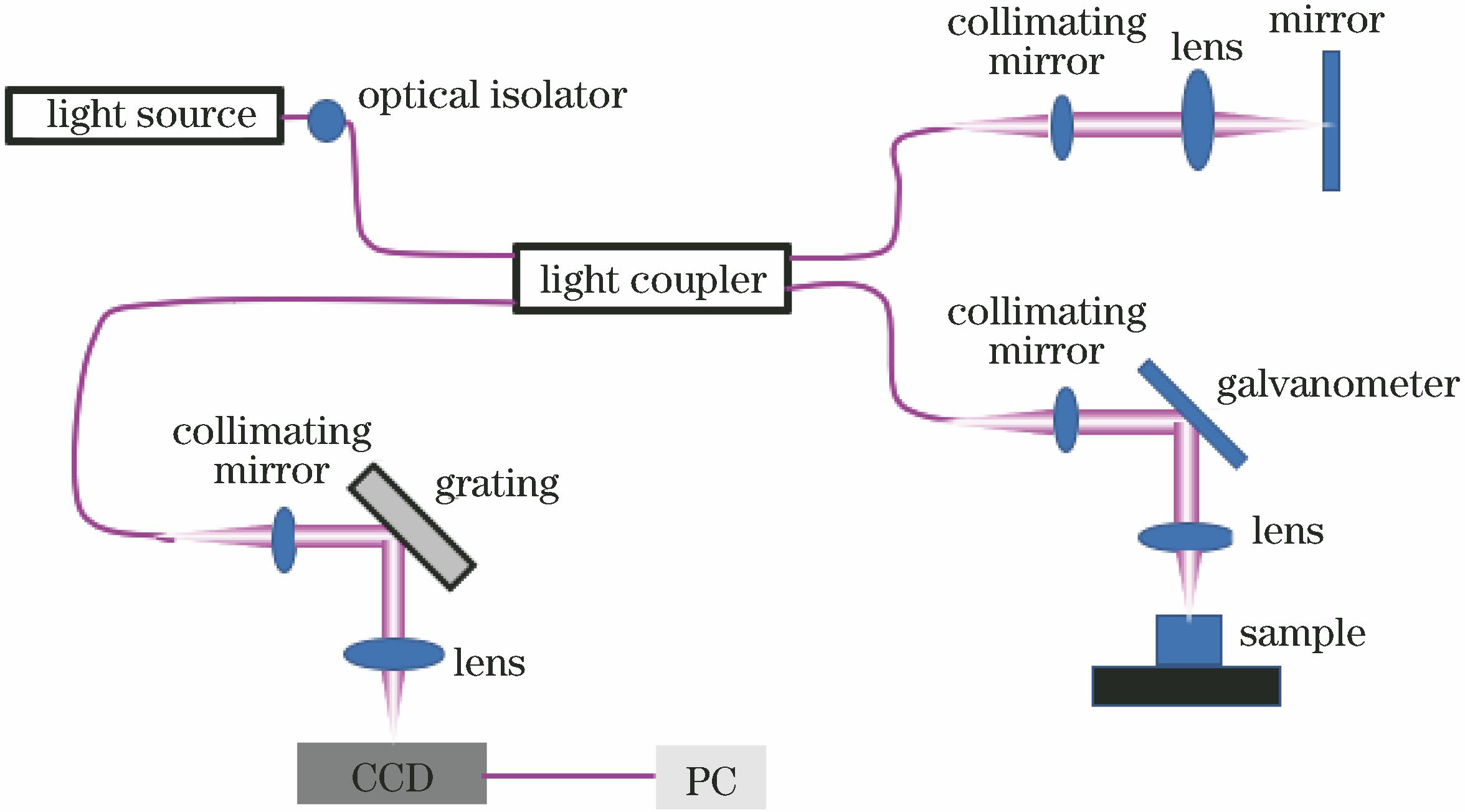
OCT技术最初于20世纪90年代由麻省理工学院的研究团队研制提出[5]。OCT作为一种新型的成像技术,与超声成像、X光成像和核磁共振成像等形式相比,具有无损、非侵入式、非电离化、高分辨率和高灵敏度等优点[6]。被称为“光学活检”的OCT,因不需要进行生理切片等创伤性方法来制备样品,其“无损”的优势被极大地凸显了出来。OCT的成像系统主要基于迈克耳孙干涉仪的原理,
OCT因其无创、三维显示、分辨率高等优点,最早在眼科方面[7]得到了广泛应用。OCT提供的轴向分辨率可对视网膜的层状结构进行层析成像,因此可用于观测引起这种层状结构病变的视网膜疾病,能够发现常规检测无法识别的细微结构异常。OCT还能测量视网膜神经纤维层厚度,精确追踪随访,为视网膜疾病的预后及发展提供了精确性的量化指标。血流作为重要的生理参数,与生物组织的病变息息相关。OCT成像可以实时进行血管成像,并使之可视化,这种技术称为OCT微血管光学造影(Angio-OCT)[8]。
![人眼视网膜Angio-OCT图像。(a)超大视场(12 mm×16 mm)人眼视网膜Angio-OCT图像;(b)视神经乳头图像;(c)中心凹图像;(d)颞区图像(视场为2.0 mm×2.4 mm)[9]](/richHtml/lop/2019/56/7/070005/img_2.jpg)
图 2. 人眼视网膜Angio-OCT图像。(a)超大视场(12 mm×16 mm)人眼视网膜Angio-OCT图像;(b)视神经乳头图像;(c)中心凹图像;(d)颞区图像(视场为2.0 mm×2.4 mm)[9]
Fig. 2. Angio-OCT images of human retina. (a) Large field of view (12 mm×16 mm) for Angio-OCT image of human retina; (b) optic nerve papilla image; (c) fovea image; (d) temporal region image (field of view is 2.0 mm×2.4 mm)[9]
随着OCT技术的发展以及研究的深入,相继出现了几项新兴的应用。例如,耳鼻喉科医师及儿科医师也采用OCT技术作为诊断工具。通常情况下,医生使用耳镜检查耳部、外耳道及鼓膜是否有细菌感染而发红的症状。而OCT可通过表皮及皮下膜的成像判断是否感染致病细菌,以提升诊断准确度。其在药物效用评价方面也发挥了重要作用,如在日常生活中服用几次抗生素后,可使用OCT系统分析抗生素是否发挥效用。如果感染的生物膜已经去除,则患者可以停止服用抗生素,以避免滥用抗生素药物带来的副作用。近年来其应用范围也逐渐扩展到了心血管[10]、呼吸道[11]、生殖道[12]等散射型组织,以及皮肤科[13]、牙科[14]、材料检测等领域。在生物医学领域,传统OCT的成像机制主要基于不均匀生物组织对探测光的散射和吸收差异,因此,只能获得组织的结构信息,然而在临床上,尤其是在疾病治疗的早期诊断阶段,病变组织和正常组织的结构差异并不十分明显,其差异主要体现在血流的变化上,因此血流信息的获取尤为重要[15]。多普勒OCT是将多普勒原理与OCT技术相结合[16],能有效地从静态的组织背景信号中分辨出动态的血流信号,在获得局部生物组织结构信息的同时,获取与血流相关的流速、分布信息等。
随着OCT技术的发展与深入,该技术正在向其他领域推进。OCT技术还可应用于材料科学,利用OCT系统对陶瓷材料进行检测,拓展了OCT技术的应用范围。未来发展方面,OCT已逐渐走向商业化生产与应用,在提高成像分辨率、加快成像速度、优化成像质量基础上,结合其他成像方法,OCT技术将能够实现更广泛的研究应用。
2.2 光声成像技术
光声成像(PAI)[17]是近年来发展迅速的一种新型无损伤、无辐射成像方法,其结合了超声检查的高空间分辨率和光学成像的高对比度的优势,能从大多数组织中采集功能信息和分子信息,提供高特异性的组织影像。因此,PAI技术作为研究生物组织结构和功能信息的新方式,已受到人们的重视。PAI是以1880年Bell发现的光声效应为理论基础,当脉冲激光束照射组织后,入射光子被组织吸收并在组织内部传播,引起组织局部轻微变热进而产生热弹性扩张,这种瞬态的热弹性组织扩张会产生压力波(即超声波),其强度大小取决于吸收光能量的多少,不同的组织有不同的光吸收,产生的超声波强度亦有差异。这种光声信号由超声换能器探测并存储于计算机中,经过处理重建后,形成能反映组织光吸收分布的三维图像。基于成像原理可知,PAI跟踪的是组织的光吸收,而不是散射粒子,因此其深度大且对比度高,无散斑噪声。PAI技术将分子影像探针技术和对比增强成像技术相结合,实现了活体组织分子水平的非侵入性生理及病理成像。既可依赖于组织固有对比,也可利用主动靶向对比剂或被动靶向对比剂来增强成像效果,从而实现对目标组织的无损、实时、多层面、多对比度的可视化动态成像。PAI技术为研究生物组织的形态结构、功能代谢、生理及病理特征提供了重要手段,更是为肿瘤病变的早期检测和治疗监测提供了新方法。
随着PAI技术的提高,其在生物医学领域的分辨率已经从声学分辨率达到了光学分辨率,。2005年,Maslov等[18]首次利用PAI对血管进行成像,采用暗场辐射模式激光,结合一个50 MHz的球形聚焦超声探测器,得到了清晰的血管结构图像,横向及纵向分辨率都比较理想,实现了基于声学分辨率的光声显微成像,开启了光声成像技术领域的重大发展。受到此次结果的启发,该课题组将光声显微成像应用于皮下微血管成像、功能成像和早期肿瘤监测中,实验结果显示,其均具有较高地灵敏度及特异性,并发展出了第一代光学分辨率光声成像技术[19]。但对于弱吸收组织,光声成像能够提供的有效信息相对较少,通常需要其他的成像模式加以判别。2011年,Song等[20]提出多焦点光声显微成像,显著提高了光声显微成像的速度和光声信号的检测的灵敏度,获得了超高的分辨率,并被称之为第二代光声显微成像技术。Aguirre等[21]提出了介观光声成像技术,首次使用基于球面聚焦传感的中心频率为102.8 MHz、宽带较宽的光栅扫描系统,利用此高频超声换能器提高了光声成像的纵向分辨率,实现了皮肤组织的三维精细结构成像,如
![手掌表皮MIP图。(a)表皮-真皮交界处MIP;(b)表皮-真皮交界处的小血管和毛细血管袢MIP;(c)水平神经丛下方的大血管MIP[21]](/richHtml/lop/2019/56/7/070005/img_3.jpg)
图 3. 手掌表皮MIP图。(a)表皮-真皮交界处MIP;(b)表皮-真皮交界处的小血管和毛细血管袢MIP;(c)水平神经丛下方的大血管MIP[21]
Fig. 3. MIP of palm skin.(a)MIP of the epidermal-dermal junction; (b) MIP of the smaller vessels and captllary loops at the epidermal-dermal junction; (c) MIP of the bigger vesels under the horizontal plexus[21]
与OCT技术类似,光声成像也经历了从时域到频域成像的发展过程。在时域光声成像领域,美国华盛顿大学Wang等[22]凭借多篇奠基性文章和大量的研究著作成为目前该领域世界范围内影响力最大的研究团队之一。该团队凭借成熟的技术和理论支持现在已开始将研究的重心放在了光声成像在生物医学上的应用和推广方面,其运用光声成像技术实现了对老鼠深层脑部成像,其成像中心区域的轴向分辨率达到了0.10 mm,切向分辨率达到了0.25 mm,该系统用于小动物体内大脑的功能成像,从而观察老鼠结构、脑损伤、大脑对高氧和缺氧的血流动力学反应。这种成像技术允许在高分辨率下完全无创透皮和神经影像,同时保留皮肤和头骨的完好无损,具有广泛地应用价值。该团队还通过使用基于纳米传感器的光声成像技术监控体内锂离子含量来完成对针对性药物治疗作用的分析,将纳米传感器和治疗性药物结合使用实现对新生血管的成像和治疗。慕尼黑工业大学研究小组将频域光声成像应用于生物活体实验并取得了成功[23]。光学显微镜光毒性低,但是对于不透明组织结果不尽如人意。针对此问题,该团队将光学与光声读数信息合并,对高度散射的离体幼年斑马鱼进行成像,结果表明,该光声成像系统可在扩散的散射深度范围内进行高分辨成像。
在成像技术方面,光声显微成像已经实现了分辨率从亚微米至几十个微米的跨层次成像,成像范围达到了从几个微米到厘米量级的多尺度成像和结构到功能上的多参量成像,成像设备也实现了大型化到小型化轻量化的发展[24]。为了全面、精准地获取生物组织的生理及病理信息,常将光声成像与其他成像模式相结合,如OCT[25]、荧光成像和电子计算机断层扫描(CT)等形成多模态成像等。多模态成像可以克服单一成像形式的局限,提高PAI的成像效果,扩展各个成像方式的功能,使每个成像技术发挥到极致,获得最为理想的成像效果,为生物研究和临床应用提供有利的依据。
2.3 非线性光学成像技术
非线性光学显微成像, 是指激发光与待测物质通过非线性相互作用产生光信号,并利用这些光信号进行显微成像的方式。这种光与物质的相互作用通常受材料的电敏感性以及照明强度的影响,电磁响应相对于入射场的大小呈线性关系。然而,随着入射强度的增加,光与物质之间的相互作用也受到了电磁敏感性中的高阶项影响,导致对入射场显现出非线性响应,称为强光光学。在非线性光学显微镜中,可利用样品中化合物和结构特征的电敏感特性为高强度激光照明成像提供所需的信号,即利用内源性光学标志物获得对比度来成像,从而避免了切片和染色等操作。
非线性光学成像技术在过去的二十年时间里发展迅速,其中谐波产生[二次谐波(SHG)和三次谐波(THG)]最为常见。SHG是相干散射过程,对待测物内部结构的中心对称性非常敏感,SHG信号的波长是激发光波长的1/2,故SHG成像技术使用的是红外激光,对组织穿透能力非常强,可以进行更深层的成像。Chu等[26]早在2003年就利用二次谐波显微成像作为微观对比机制去观察斑马鱼体内晶胚的发育过程,深度高达1.5 mm,并成功观察到了原肠胚及组织的形成过程,且无需对样品进行任何处理。研究表明,细胞外基质中的胶原纤维由于结构特殊具有很高的SHG效率,可以通过探测SHG信号来反映生物组织中的基质形态,含有胶原丰富的组织如结缔组织、肌肉组织、微管等都可以产生强烈的SHG信号,通过此种非线性成像方式来实现区分和成像。1971年Fine等[27]在胶原组织中第一次检测到二次谐波信号。2014年Bancelin等[28]研究员采用二次谐波成像技术获得了比普通光学成像技术高达15倍的分辨率,为非线性超分辨成像技术做出了贡献。
THG是一种内在的对比机制,当激发光频率下的三个光子在三倍频率下转换成一个光子时就会产生THG。最新的一项研究中,Small等[29]使用无标记多光子显微镜在中红外范围内进行激发,得到了动脉粥样硬化病变成像,来自动脉粥样硬化斑块的THG信号可以揭示细胞和细胞外脂质沉积物的形态学细节。其使用中红外波段范围(1300~1700 nm)光源的多光子显微镜对鼠类和人类样品的动脉粥样硬化斑块进行成像,展示了动脉粥样斑块的详细三维结构和THG成像的高分辨能力,如
实现非线性无标记成像的有效策略是采用多模式配置,将各种成像技术组合在单个显微镜中用于同时采集图像。早期生物样本的非线性多模式成像是利用二次谐波生成和双光子激发荧光进行的[30]。这种技术的组合大受欢迎,因为相同的激发源可以用于两种成像模式且向前或向后散射信号可以在光谱上分离以便同时进行图像采集。与此类似,二次和三次谐波生成可以结合在扫描显微镜中进行无创无标记多模态成像,THG可用于检测细胞边界和核膜以及各种内部细胞器的不均匀性,而SHG在有丝分裂过程中解析了中心体和有丝分裂纺锤体在其他有序结构中的光学中心对称性。Mahou等[31]还利用THG和四波混频(FWM)显微镜检查了斑马鱼胚胎,通过添加SHG和双光子激发荧光(TPEF)对THG显微技术进行扩展,使其发挥了更广泛的作用。Segawa等[32]将相干反斯托克斯拉曼散射(CARS)、SHG、THG和三阶和频产生(SFG)结合,对具有多个通道的单个细胞进行成像,展示了四模式非线性显微镜。这里描述的多路复用和多模态非线性成像技术能够以前所未有的速度和化学特异性进行三维细胞成像,并且这些技术在许多方面正在接近荧光显微镜的多功能性。事实上,在更大的生物医学成像背景下,将非线性成像技术归类为荧光显微镜的补充更具启发性。应用先进的图像处理和分析从无标签图像中提取定量信息是该技术的自然延伸。
![THG显微镜揭示的形态特征总结[29]](/richHtml/lop/2019/56/7/070005/img_4.jpg)
图 4. THG显微镜揭示的形态特征总结[29]
Fig. 4. Summary of morphological features revealed by THG microscopy[29]
基于CARS和受激拉曼散射(SRS)的相干拉曼散射也是一种典型的非线性光学技术。CARS过程属于三阶非线性效应,采用两束频率不同的脉冲激光分别作为抽运光和斯托克斯光来激发样品,当两束光脉冲的频率差和样品分子固有的振动模式频率一致时,分子振动得到了共振增强,并在探测光的作用下产生了反斯托克斯信号。SRS是由强激光的光电场与原子中的电子激发、分子中的振动或晶体中的晶格相耦合产生的,具有很强的受激特性,以及受激光发射的强方向性、高散射强度等特征。SRS成像技术是一种新型的、无需荧光标记的成像方法,其为非线性的相干拉曼散射过程,继承了自发拉曼光谱的分子特异性,可以选择性地区分成像各类生物分子;同时克服了自发拉曼信号极其微弱的缺点,极大地增强信号使其能实现快速活体成像。CARS和SRS成像技术不需要额外染料分子或荧光蛋白标记,针对特定的化学键振动进行成像,具有非侵入性的优点,在生物学和医学成像领域有着重要的作用。Nan等[33]发现在仔细考虑激发能量的情况下,CARS显微镜可以有效地用于监测活细胞中脂滴的细胞器运输,同时避免光损伤。在没有荧光标记的情况下,能够追踪细胞间脂滴运动并量化扩散和蛋白介导的小鼠肾上腺皮质细胞转运。SRS具有高灵敏度、高特异性和高分辨率等优势。1962年Eckhardt等[34]报道的SRS是首次发现的非线性光学现象之一。其对分子的选择性来源于分子的内禀振动特性,因而可以针对生物组织中的不同化学组分进行分别成像,如脂质、蛋白和核酸等。该课题组的研究工作初步证明了基于脂质和蛋白的双光谱SRS技术可用于脑肿瘤边界的术中活体成像以及离体标本的病理检测。但目前多光谱成像技术仍依赖于波长调谐或光谱编码等过程,不能实时得到病理图像。而利用锁相放大器的相位敏感性发展而来的双光谱SRS成像技术,结合同步的图像处理算法进行实时的数字病理诊断,发展出了快速无标记病理检测方法。此项技术可以极大地提高肿瘤边界的探测精度、术中病理成像的速度和手术治疗的精准度。经过二十几年的发展,相干拉曼散射显微镜已广泛应用于生命科学和生物医学成像领域。分子振动成像赋予相干拉曼散射显微镜探测分子信息的优势,更便于检测疾病组织中分子组成成分的变化,为诊断疾病发生提供了重要信息。
2.4 微球透镜成像技术
光学显微镜的性能受限于衍射极限,无论一个成像系统在光学性能上有多接近完美,都无法分辨超过阿贝衍射极限的两个物体。研究者们尝试过很多方式方法来突破衍射极限,Lee等[35]采用纳米尺度的球面透镜试图超越这一极限,这些透镜由杯状有机分子由下向上自组装整合而成。与几何光学镜片相比,以此种方式产生的透镜呈现出曲线轨迹的光线,具有非常短的焦距,可以产生超出衍射极限的近场放大效果,使分辨率达到200 nm的数量级。2011年Wang等[36]报道了一种新型的光学纳米镜,该研究方法使用普通玻璃微球体作为远场超透镜,克服了白光衍射极限。将透明电介质微球置于物体表面,微球能够耦合近场信息并将其放大,传输到远场后被物镜接收,生成高放大倍数的虚拟图像,虚拟成像操作模式可以在透射和反射模式下与普通光学显微镜集成,并且在标准白光照明下工作。对于5 μm的粒子,理论上其可以解析低于20 nm的任意结构,使得有可能在白光下直接观察病毒和活细胞内部,而不需要激光激发荧光。该报道已经证明光学透明微球是高性能的光学超透镜,其可以通过在白光源照明下的近场虚拟成像来分辨50 nm的物体。微球纳米镜坚固耐用,并且能适应不同种类的样品,可用于对病毒、DNA和分子等生物物体进行成像。
Li等[37]首次报道的浸没式微球光学纳米显微镜(SMON)是一种简单的直接白光观察纳米级病毒的方法。将标准光学显微镜与折射率为1.9、直径为100 μm的大尺寸微球,浸在水中对75 nm的腺病毒进行成像。成像结果如
![浸没式微球透镜的腺病毒簇成像结果。(a)腺病毒簇的高放大倍数SEM图像;(b)腺病毒簇的低放大倍率SMON图像(100 μm BaTiO3微球与503目标镜片偶联,NA=0.75);(c)腺病毒簇的更高放大倍数SEM图像;(d)腺病毒簇的较高放大倍数SMON图像(100 μm BaTiO3微球与803物镜耦合,NA=0.9)[37]](/richHtml/lop/2019/56/7/070005/img_5.jpg)
图 5. 浸没式微球透镜的腺病毒簇成像结果。(a)腺病毒簇的高放大倍数SEM图像;(b)腺病毒簇的低放大倍率SMON图像(100 μm BaTiO3微球与503目标镜片偶联,NA=0.75);(c)腺病毒簇的更高放大倍数SEM图像;(d)腺病毒簇的较高放大倍数SMON图像(100 μm BaTiO3微球与803物镜耦合,NA=0.9)[37]
Fig. 5. Adenovirus clusters images of immersed microsphere lens. (a) High magnification SEM image of adenovirus clusters; (b) low magnification SMON image of adenovirus clusters (100 μm BaTiO3 microsphere coupled with a 503 objective lens, NA=0.75); (c) higher magnification SEM image of adenovirus clusters; (d) higher magnification SMON image of adenovirus clusters (100 μm BaTiO3 microsphere coupled with an 803 objective lens, NA=0.9)[37]
微球透镜超分辨的主要优势是位于电介质中的显微物镜视野内的高折射率微球可以将光聚焦成光子纳米喷射。2017年,Huszka等[38]提出了一种基于微球的超分辨率扫描光学显微镜(MS-SOM)的新方法,将经典的易于操作的光学显微镜与表面扫描原理的优点相结合。具体为引入超分辨率扫描光学显微镜,使用透明介质微球体,借助传统的显微镜物镜在样品表面上进行平移。首先该报道对样品、微球、介质系统内的光传播进行了有限元模拟,指出样品和微球之间的关键分离距离,研究结果发现,低于该距离才可以实现超分辨成像。因此,若将样品放置在微球体下面,则只能在基底和微球体接触附近的区域内成像,该区域非常有限,仅能达到约10 μm2视野。为了扩大超分辨成像区域,将微球的超分辨成像能力与定制扫描和图像重建算法相结合,可以在显微镜物镜的整个视场范围内创建超分辨图像。该方法已经在具有纳米特征的线性校准样本上完成了测试。在与显微镜物镜相连的框架上固定了一个微球,该微球以分步方式在样品上自动扫描,继而生成了样本区域104 μm2范围内的超分辨图像。与其他技术相比,该显微系统能以高性价比的方式实现超分辨率成像;与传统的光学显微镜相比,分辨率提高了近20%。微球透镜在无标记的前提下,具备不接触微扰的特点,该发现或将成为未来广泛应用扫描超分辨率光学显微镜的基础,同时也将在许多其他研究领域发挥巨大潜力。
3 无标记显微成像技术的应用
3.1 血管成像检测应用
生物组织内部的血流信号与各类疾病都存在着紧密的联系,生物组织功能性血管,如毛细血管的成像对于许多疾病的基础医学研究、早期诊断和治疗都有重要的意义。基于荧光标记的血管造影技术[39]是目前应用较为广泛的组织血管造影方法,但其外源性的造影剂会对生物体产生一定的副作用。由于荧光成像必须注射荧光标记物,常会引发副作用,长期使用会使残留标记物在体内积累,不利于长期、频繁的跟踪检测,也不适用于大规模人群的筛查工作。因此亟需一种有效的血流灌注成像手段,开发一种无创无标记的光学微血管技术,实现无标记、高分辨、实时高速的血流三维形态结构与生理功能信息提取。
OCT微血管造影技术能够实现生物组织内部血流灌注时空分布的三维可视化,该造影技术无需外源性的标记,被广泛应用于眼底视网膜、脉络膜、眼表结膜、大脑皮层、肿瘤和皮肤等基础科学研究、临床疾病诊断及辅助治疗等领域。多普勒OCT[40]和散斑方差OCT[41]是基于循环血细胞提取胚胎血流信息的主要方法。多普勒OCT依赖于由血细胞运动引起的OCT相变,产生可以与轴向流动速度相关联的多普勒频移。在此基础上利用高级处理方法可以进一步降低噪声并提高成像质量。近年来,OCT在早期的小鼠胚胎心脏的结构和功能成像方面均取得了一些技术进步。准确成像和血流动力测量对于研究胚胎心脏至关重要,尤其是血流诱导的剪切应力,它影响着内皮细胞的基因表达,若心脏出现异常或缺陷,则可以通过成像和测量剪切应力来进行评估。Peterson等[42]利用四维(4D)结构和多普勒成像,基于多普勒OCT提供的心脏管内的血流速度分布,准确地测量体内心血管中的血流量,并在生理条件下首次在整个心脏周期中绘制内膜剪切应力。实现了鹌鹑胚胎心跳周期中剪切应力动态的4D映射,获得了胚胎心脏的4D多普勒OCT图像集。作为多普勒OCT的衍生方法,剪切应力测量和胚胎心脏绘图是OCT非常值得关注的生物力学成像能力。Wang等[43]使用OCT研究早期阶段探查活体发育的小鼠胚胎的生物力学。利用OCT的非标记、三维功能和较远工作距离成像特性,研究了包括心脏动力学的直接体积结构和功能成像,4D定量多普勒成像和心脏血流分析,以及从搏动的胚胎心脏中心脏壁组织的4D血流分离等课题。在这篇论文中,基于傅里叶域锁模激光器的优势,使用超高速扫描系统(兆赫兹波长扫描速度),绘制了使用该类高速OCT获得的活体小鼠胚胎中心脏动力学的直接4D成像图,并实现了心血管系统的功能分析,如

图 6. 活体小鼠胚胎的心脏血管内的血流动力学多普勒OCT成像
Fig. 6. Doppler OCT imaging of hemodynamics inside heart tube of a live mouse embryo
血液通过血管传导,将氧气带到体内的各个器官,除了携带氧气外,还含有各种成分,其成分的变化与多种疾病相关。另外,血管结构本身也可反映相关疾病,例如高血压、糖尿病和高血脂等病症引起的动脉粥样硬化。PAI在血管成像方面具有组织穿透深度大的优势,光声成像可反映生物组织吸收信息的成像特性,通过直接测量血红蛋白含量、红细胞流动速度可实现对血氧饱和度、血液流速及力学参数等的成像。Kruger等[44]应用光声断层成像系统(PAT)进行人体乳腺成像,在不使用对比剂的情况下可以显示健康志愿者深度为40 mm的亚毫米级血管。Ku等[45]研发了PAT与热声成像系统(TAT)相结合的非电离射频和近红外激光,以此获得了乳腺组织离子浓度、血容量和血红蛋白(Hb)的氧合水平等相关信息。Matsumoto等[46]开发了一种光声成像系统用来获取乳腺癌诊断图像,使用PAI可以实现小于0.5 mm分辨率的三维成像。该团队使用半球形检测器阵列的PAT仪器分析手掌的血管形态,通过外围血管的结构形态学分析发现,健康受验者的血管是连续的,没有因疾病而引起的血管弯曲和破裂。通过对大数据下的不同年龄段,不同性别人群进行成像测试发现,不同性别的人手掌血管弯曲曲率基本一致,而不同年龄的人曲率表现出不同的数值。该项研究证明,PAT系统可以对手掌血管的三维特征进行可视化,并对动脉曲折进行非侵入性分析。通过对衰老和疾病引起的形态变化的了解分析,建立了一套健康人群手掌血管数字系统,为相关疾病的快速诊断提供依据。
3.2 肿瘤检测中的应用
临床上肿瘤诊断需要一系列血常规、尿常规等检查和肿瘤标记物生化检查,在难以确诊时甚至还需要穿刺活检等。目前,检测肿瘤的最常用的成像技术为CT、核磁共振扫描和活检染色,但这些方法并不能够准确检测到微小肿瘤以及转移的肿瘤。生物成像技术作为肿瘤检测的主要方法之一具有诸多优点,包括实时监测、无组织破坏、不造成侵入性。通过基于成像的筛选尽可能在早期发现癌症是降低某些癌症死亡率的主要方法。因此对肿瘤生物标志物的超灵敏检测成为了癌症临床诊断和治疗的迫切要求[47]。
PAI可对肿瘤的发生、发展以及转移进行直接快速的定位检测和跟踪[48]。早在2006年,光声显微成像技术就已应用于黑色素瘤的检测中,为黑色素瘤的早期诊断提供了可能;多光谱光声分子成像技术能检测血管形态及血液氧饱和度,还可监控药物在脑肿瘤中的渗透情况;显微光声技术能达到单细胞水平,可用来监控药物对肿瘤治疗的效果。OCT能对生物组织内部微观结构进行高分辨断面层析成像,且能实现二维或三维成像,其成像速度快,成像深度深,在皮肤癌诊断方面优于超声检查。而拉曼光谱可在分子水平分辨组织的详细信息,既可以用于在体检测,也可适用于组织样品抽检。目前已经应用于皮肤类的黑色素瘤和其他皮肤癌诊断,在区分良性色素病变和恶性黑色素瘤方面具有较好的灵敏度[49]。恶性黑色素瘤在早期被发现是拯救生命的关键因素,2016年He等[50]开发了一种共聚焦光热显微镜,用于黑色素瘤的无创无标记三维成像。他们发明的共聚焦光热显微镜的轴向分辨率比常用的光热显微镜高出约3倍。利用这种装置直接获得了小鼠皮肤色素损伤中黑色素的三维显微分布,在实验中对16个实验对象(其中8个用于良性黑素瘤,8个用于恶性黑色素瘤)进行成像,并对其三维图像进行分析显示出黑色素瘤生长期间黑色素密度和尺寸有变化,这些结果为监测黑色素瘤生长以及皮肤癌诊断提供了新的手段和选择。
双光子和二次谐波成像技术都属于无损的高分辨成像方法,基于红外的激发光使得该类成像方法深度可到达皮下几百微米,且无需经过传统的切片过程,能直接观察到随着肿瘤病变的发展不同层面厚度和形态的变化,为肿瘤分期诊断提供了可靠的检测依据。在脑肿瘤手术中,识别肿瘤边界是关键。而目前神经外科医生对肿瘤边界进行术中评估比较困难,因此亟需在手术过程中为他们提供病理信息的工具。尽管荧光成像技术已普遍应用于临床手术过程中[51],但仍存在异构递送和非特异性染色等缺点。因此临床检测中亟需在外科医生操作时以“实时”追踪的方式进行反馈的无荧光标记成像技术。OCT[52]和刺激拉曼显微镜检查[53]能够可靠地检测人脑胶质瘤患者大脑中的肿瘤组织,其中,手持式拉曼光谱仪甚至可用于切除术前评估脑组织[54]。这些技术在密集的肿瘤浸润区域中检测敏感度很高,其中拉曼光谱学装置可在150 μm×150 μm区域中达到检测17个肿瘤细胞的灵敏度极限。拉曼技术的区分能力是基于肿瘤组织和健康组织的振动光谱的微妙差异,并且需要将实验光谱与参考光谱库作大量比较,拉曼技术可以区分脑癌和正常脑,能从固定组织的组织病理学分析到原位光学活组织检查的转换,相比更为简单容易。拉曼技术是术中胶质瘤检测的理想选择,它占地面积小、采集时间快、精度高,可以作为脑癌手术期间术中指导,最大限度的减少手术后剩余的癌细胞数量,提高手术的有效性并提高患者的存活率。
Kuzmin等[55]致力于多光子手持式活检方法的研究,希望通过THG/SHG形式的活检针,神经外科医生能够直接在手术的大脑中进行光学活检。THG和SHG成像模式仅需要单一激光束,并且允许背散射光子的相对高速成像,故而特别适合于结合到手持式活检针中,包括基于SHG和THG在内的多光子成像模式已成功的转化为能够实现组织原位分析的微型内窥镜多光子成像设备。该团队筹划建造一个THG/SHG离体桌面设备,该设备由紧凑型激光源和激光扫描显微镜组成,通过这种设备,可以对手术过程中快速THG/SHG病理反馈进行定量分析,以便协助完成外科肿瘤切除手术。因此,THG/SHG成像技术对于改善手术程序,提高患者的存活率和生活质量将起到巨大的作用。
![离体人脑组织的THG / SHG内窥显微镜检查。(a)神经元胞体组织;(b)灰质神经毡组织;(c)低细胞性白质区域;(d)高级别胶质瘤[55]](/richHtml/lop/2019/56/7/070005/img_7.jpg)
图 7. 离体人脑组织的THG / SHG内窥显微镜检查。(a)神经元胞体组织;(b)灰质神经毡组织;(c)低细胞性白质区域;(d)高级别胶质瘤[55]
Fig. 7. THG/SHG endomicroscopy results of ex-vivo human brain tissues. (a) Neuronal somata tissue; (b) gray matter neuropil tissue; (c) low-cellularity white matter area; (d) high-grade glioma[55]
3.3 细胞成像的应用
观察细胞在活体中进行的一系列生物过程,可以对生物现象的本质得到细微独到的认识。细胞成像在捕获活细胞相关数据时不可避免会遇到一些难题。一方面,细胞是活动而非静止的,细胞内部的各种微观物质不停地在进行交换、代谢,且细胞的直径小于光学分辨极限;另一方面,活细胞对光损伤很敏感,对环境要求也很高。传统的光学显微镜技术依据各种对比度增强,通过鉴定细胞边界并从个体细胞中提取信息来分析细胞的异质性[56-57]。而荧光染料的使用为细胞显微成像带来了便利:增加了对比度,有助于识别亚分辨率物体(例如蛋白质、DNA、脂质等);能够区分类似的物体;启用多组分分析;并提供定量分析,细胞分割和跟踪。然而,这种荧光染料的使用也存在着无法避免的负面影响:成像过程中会干扰自然细胞状态和正常细胞功能。基于上述问题,鉴于传统荧光标记的局限性,无标记的成像技术在细胞成像中的应用需求迫在眉睫。
在光声成像领域,研究人员在接种过黑色素瘤的小鼠活体中观察到了黑色素瘤细胞的转移。Wang等[58]提出了可视化在活体检测单个红细胞的含氧量及流动速度的方法,进一步推进了光声流式细胞术的发展。He等[59]通过使用高速高分辨率光声显微镜观察到了黑色素瘤细胞,该方法能可视化地记录癌细胞在微血管中的转移过程。生物组织液粘弹特性研究已经引起了生物医学界的广泛关注,癌细胞与正常细胞的粘弹系数会有明显差别。将光声成像技术与粘弹成像技术相结合,对正常组织细胞与癌细胞的研究结果证明,光声粘弹成像在癌细胞诊断方面具有应用的可能性[60]。扫描衍射显微镜可以对细胞给予无标记无污染成像[61],使用扫描衍射显微镜定量相位成像可以完成许多重要的生物学应用,如细胞增殖、跟随细胞周期、检测细胞凋亡和细胞追踪,实现对细胞周期和凋亡的无标记表征,以及细胞增殖的无标记定量。研究结果表明,该技术将有助于早期疾病鉴定和诊断以及药物研发。
应用非线性光学显微技术可以在细胞水平上实现高分辨的三维生物样品成像,只需通过探测来自吸收、散射和自发荧光组织内的内源性光学对比,无需使用荧光标记。在长时间下能够进行无扰动活细胞成像是研究动态生物过程的有力工具,且无标记技术的观察时间不受荧光漂白的限制。在这种情况下,THG显微镜可以发挥巨大用途。THG依赖于组织固有的三阶非线性磁化率的空间变化,在细胞组织中主要来源于富含脂质分子的界面。SHG信号来自微管和胶原中存在的非中心对称分子的光学非线性过程。THG已经成功应用于未标记的细胞组织,Lim等[62]在小动物的脑组织中,通过共同记录SHG信号,THG显微镜显示出可视化细胞、细胞核、轴突内部和外部轮廓,对血细胞和血管进行成像的深度高达350 μm,获取到了无标记实时图像和清晰可辨组织中的细胞增生过程,在无标记细胞成像方面取得了极具潜力的科研成果,足以证明THG成像是光学活检的有效工具。Jüngst等[63]使用CARS显微镜来追踪脂肪形成过程中的脂滴形成和动力学过程,这是干细胞分化成脂肪细胞的过程,如
![CARS显微镜追踪脂滴形成实验。(a)间充质干细胞分化成脂肪的过程;(b)使用Imaris软件包(Bitplane)描绘脂滴的体积变化;(c1)主受体脂滴的表面增加与熔合脂滴提供的净表面之间的比较;(c2)主受体脂滴的体积增加与所有熔合脂滴的净体积之间的比较[63]](/richHtml/lop/2019/56/7/070005/img_8.jpg)
图 8. CARS显微镜追踪脂滴形成实验。(a)间充质干细胞分化成脂肪的过程;(b)使用Imaris软件包(Bitplane)描绘脂滴的体积变化;(c1)主受体脂滴的表面增加与熔合脂滴提供的净表面之间的比较;(c2)主受体脂滴的体积增加与所有熔合脂滴的净体积之间的比较[63]
Fig. 8. CARS microscope tracking lipid droplet formation experiment. (a) Progress of differentiation of mesenchymal stem cells into adipose; (b) volume change of the lipid droplet depicted by the Imaris software (Bitplane); (c1) comparison between the surface increase of the main acceptor lipid droplet and the net surface provided by the fusing lipid droplet; (c2) comparison between the volume increase of the main acceptor lipid droplet and the net volume of all fusing lipid droplets[63]
无标记细胞成像技术,在无荧光标记的基础上利用各种技术实现高对比图像,既要保证图像没有损失,又不会出现标记物带来的创伤和污染,且无标记技术还能与大多数荧光标记成像方法进行很好地结合,从而使特定荧光标记和活细胞内快速结构重组之间的相关显微镜检查成为可能。
3.4 其他领域中的应用
除了在上述生物医学成像方面的应用外,无标记成像技术在其他领域也发挥着重要的作用。2018年,Kim等[64]利用光学衍射层析成像技术对松属花粉粒进行三维无标记成像和分析。该团队针对单个针叶树花粉粒使用光学衍射层析成像(ODT)技术获得了三维折射率图,并利用折射率图来分析花粉粒的三维形态特征,再次明确区分和分析不同的子结构。从折射率图中可以了解到花粉粒的形态和生理化学参数,对花粉粒的形态进一步分析可获得植物生物周期的各项指标;同时也可用于定量研究不同品种花粉粒的种间差异。该团队的研究结果表明,这种无标记的ODT成像方式和快速的三维成像方法为分析、了解花粉粒甚至植物的生殖功能的生理学研究提供了一个新的平台。
浙江大学Liu等[65]开创性地将发光纳米线作为局域光源,巧妙地利用其小尺寸、大表体比、强光局域能力和强倏逝场等特点,首次实现了大视场、远场、无标记超分辨显微成像,其视场目前达数千平方微米,比以往报道的无标记型远场超分辨显微方法扩展了1个数量级以上,且该方法方便快捷,可设计成紧凑式照明模块使普通显微镜轻易地具备超分辨能力。该方法的机理是:通过微纳操控将高荧光效率的半导体纳米线围成环形,并与二维薄膜波导复合,当纳米线环被激发时,荧光会高效耦合进入二维薄膜波导,使其表面形成高波矢、全方向的倏逝场。该倏逝场被置于波导表面的样品调制、散射,使本来只存在于近场的高频空间信息由于移频机制加载到散射光中被远场接收探测,从而实现宽场远场纳米显微成像。纳米线环形显微技术在集成芯片、蓝光DVD、特定癌细胞和二维刻蚀图案等亚波长样品上均实现了超分辨观察,展示了其普适性强、方便使用的优点。此项研究不仅在生物医学、集成芯片、材料等领域具有广阔的应用前景,同时也为推进微纳光源的实际应用打开了新的大门。
4 趋势
OCT成像技术是通过探测待测生物组织的后向散射光信息来实现组织结构的成像,而PAI收集的是生物组织的吸收光信息。所以OCT/PAI的双模式成像技术既可以探测吸收光又可以探测散射光信息,目前已经有很多课题组对该类双模式成像进行了研究,实现了小鼠耳朵组织表面结构及血管分布,得到了血氧饱和度分布图像。而开发无创无标记光学微血管造影法以评估体内血液和体液循环的定量备受关注。2016年,Chen等[66]利用一个低相干迈克耳孙干涉仪在同一平台上构建了可以同时获取生物组织吸收和散射信息的OCT/PAI/荧光显微镜(FLM)多模态成像系统,如

图 9. 多模态成像活体老鼠耳朵。(a)光声成像图像;(b) OCT图像;(c) FLM的荧光最大值投影(MAP);(d) OCT/PAI/FLM融合图像;(e)对应图9(a)中1处的OCT/PAI断层图像;(f)对应图9(a)中2处的OCT/PAI断层图像
Fig. 9. Multimodal imaging of living mouse ears. (a) image of PAI; (b) image of OCT;(c) MAP image of FLM; (d) fused image of PAI, OCT, and FLM; (e) OCT/PAI tomography image corresponding to 1 in Fig. 9 (a); (f) OCT/PAI tomography image corresponding to 2 in Fig. 9(a)[66]
鉴于无标记与荧光标记成像的特点,无标记可以作为荧光显微镜在生物显微成像史上的补充。而多模态成像更是充分发挥了两种成像技术的优势。2017年Meng等[67]主导的双响应小分子探针用于肿瘤靶向成像引导的光动力治疗取得了进展,该研究构建了一例“四合一”多功能的集肿瘤诊疗为一体的简单有机小分子(RhoSSCy)。体外和体内实验证明,RhoSSCy具有近红外荧光成像(NIRF)/PA双模态成像和高效的光动力抗癌作用。该多功能诊疗一体化有机小分子结构简单,易于大批量合成,并且结构稳定,便于贮存和运输,有望实现肿瘤靶向的双模态精确成像和精准治疗。
5 结束语
概述了现有的无标记成像技术,包括OCT、PAI、微球超透镜成像,以及利用非线性光学方法实现的无标记成像技术。对各成像技术的优缺点和未来发展方向进行了讨论,并对此种无标记显微成像技术在血管、肿瘤,以及细胞领域的应用作了详细介绍。
相比荧光标记方法,无标记方法具有分子特异性差的缺陷。尽管目前还无法取代荧光显微镜,或满足每个无标记成像实验的要求,但是无标记作为显微成像技术的转折点,为生物显微成像技术发展了开启新篇章。多种生物医学成像技术被用于癌症治疗的各个阶段来提供形态学、结构、代谢和功能信息。与其他诊断工具(如体外组织和液体分析)的协同应用也有助于临床治疗的判断与决策。不仅发挥了无标记优势,还增强了对比度,提高了成像分辨率,使得多模式成像成为未来生物医学检测中的必然趋势。
[5] Huang D, Swanson E A, Lin C P, et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181.
[15] Leitgeb R A, Werkmeister R M, Blatter C, et al. Doppler optical coherence tomography[J]. Progress in Retinal and Eye Research, 2014, 41: 26-43.
[16] Liu G J, Chen Z P. Advances in Doppler OCT[J]. Chinese Optics Letters, 2013, 11(1): 011702.
[24] Park K, Kim J Y, Lee C, et al. Handheld photoacoustic microscopy probe[J]. Scientific Reports, 2017, 7: 13359.
[30] Gauderon R, Lukins P B. Sheppard C J R. Simultaneous multichannel nonlinear imaging: combined two-photon excited fluorescence and second-harmonic generation microscopy[J]. Micron, 2001, 32(7): 685-689.
[34] Eckhardt G, Hellwarth R W. McClung F J, et al. Stimulated Raman scattering from organic liquids[J]. Physical Review Letters, 1962, 9(11): 455-458.
[40] Yang V X D, Gordon M L, Seng-Yue E, et al. . High speed, wide velocity dynamic range Doppler optical coherence tomography (Part II): imaging in vivo cardiac dynamics of xenopus laevis[J]. Optics Express, 2003, 11(14): 1650-1658.
[41] Sudheendran N, Syed S H, Dickinson M E, et al. Speckle variance OCT imaging of the vasculature in live mammalian embryos[J]. Laser Physics Letters, 2011, 8(3): 247-252.
[42] Peterson L M, Jenkins M W, Gu S, et al. 4D shear stress maps of the developing heart using Doppler optical coherence tomography[J]. Biomedical Optics Express, 2012, 3(11): 3022-3032.
[43] Wang S, Lopez A L, Larina I V. Functional optical coherence tomography for live dynamic analysis of mouse embryonic cardiogenesis[J]. Proceedings of SPIE, 2018, 10493: 104930C.
[44] Kruger R A, Lam R B, Reinecke D R, et al. Photoacoustic angiography of the breast[J]. Medical Physics, 2010, 37(11): 6096-6100.
[45] Ku G, Fornage B D, Jin X, et al. Thermoacoustic and photoacoustic tomography of thick biological tissues toward breast imaging[J]. Technology in Cancer Research & Treatment, 2005, 4(5): 559-566.
[46] Matsumoto Y, Asao Y, Yoshikawa A, et al. Label-free photoacoustic imaging of human palmar vessels: a structural morphological analysis[J]. Scientific Reports, 2018, 8: 786.
[47] Ferrari M. Cancer nanotechnology: opportunities and challenges[J]. Nature Reviews Cancer, 2005, 5(3): 161-171.
[48] Yao J J. Wang L H V. Photoacoustic brain imaging: from microscopic to macroscopic scales[J]. Neurophotonics, 2014, 1(1): 011003.
[49] Lui H, Zhao J. McLean D, et al. Real-time Raman spectroscopy for in vivo skin cancer diagnosis[J]. Cancer Research, 2012, 72(10): 2491-2500.
[50] He J P, Wang N, Tsurui H, et al. Noninvasive, label-free, three-dimensional imaging of melanoma with confocal photothermal microscopy: differentiate malignant melanoma from benign tumor tissue[J]. Scientific Reports, 2016, 6: 30209.
[51] Stummer W. 5-aminolevulinic acid-derived tumor fluorescence: the diagnostic accuracy of visible fluorescence qualities as corroborated by spectrometry and histology and postoperative imaging[J]. Neurosurgery, 2015, 76(2): 230-231.
[52] Kut C, Chaichana K L, Xi J F, et al. 7(292): 292ra100[J].
[53] Ji M B, Orringer D A, Freudiger C W, et al. 5(201): 201ra119[J]. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine, 2013.
[54] JermynM, MokK, MercierJ, et al. Intraoperative brain cancer detection with Raman spectroscopy in humans[J]. Science Translational Medicine, 2015, 7(274): 274ra19.
[55] Kuzmin N V. Wesseling P, de Witt Hamer P C, et al. Third harmonic generation imaging for fast, label-free pathology of human brain tumors[J]. Biomedical Optics Express, 2016, 7(5): 1889-1904.
[56] Losick R, Desplan C. Stochasticity and cell fate[J]. Science, 2008, 320(5872): 65-68.
[57] Muzzey D, van Oudenaarden A. Quantitative time-lapse fluorescence microscopy in single cells[J]. Annual Review of Cell and Developmental Biology, 2009, 25(1): 301-327.
[58] Wang L D, Maslov K. Wang L H V. Single-cell label-free photoacoustic flowoxigraphy in vivo[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(15): 5759-5764.
[59] He G, Xu D, Qin H, et al. In vivo cell characteristic extraction and identification by photoacoustic flow cytography[J]. Biomedical Optics Express, 2015, 6(10): 3748-3756.
[60] Zhao Y, Yang S H, Chen C G, et al. Simultaneous optical absorption and viscoelasticity imaging based on photoacoustic lock-in measurement[J]. Optics Letters, 2014, 39(9): 2565-2568.
[61] Marrison J, Räty L, Marriott P, et al. Ptychography-a label free, high-contrast imaging technique for live cells using quantitative phase information[J]. Scientific Reports, 2013, 3: 2369.
[62] Lim H, Sharoukhov D, Kassim I, et al. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(50): 18025-18030.
[63] Jüngst C, Klein M, Zumbusch A. Long-term live cell microscopy studies of lipid droplet fusion dynamics in adipocytes[J]. Journal of Lipid Research, 2013, 54(12): 3419-3429.
[64] Kim G, Lee S, Shin S, et al. Three-dimensional label-free imaging and analysis of pinus pollen grains using optical diffraction tomography[J]. Scientific Reports, 2018, 8: 1782.
[65] Liu X W, Kuang C F, Hao X, et al. Fluorescent nanowire ring illumination for wide-field far-field subdiffraction imaging[J]. Physical Review Letters, 2017, 118(7): 076101.
[66] Chen Z J, Yang S H, Xing D. Optically integrated trimodality imaging system: combined all-optical photoacoustic microscopy, optical coherence tomography, and fluorescence imaging[J]. Optics Letters, 2016, 41(7): 1636-1639.
[67] Meng X Q, Yang Y T, Zhou L H, et al. Dual-responsive molecular probe for tumor targeted imaging and photodynamic therapy[J]. Theranostics, 2017, 7(7): 1781-1794.
Article Outline
张佳, 洪亮, 任升, 周非凡, 胡睿, 屈军乐, 刘丽炜. 无标记显微成像技术的研究进展[J]. 激光与光电子学进展, 2019, 56(7): 070005. Jia Zhang, Liang Hong, Sheng Ren, Feifan Zhou, Rui Hu, Junle Qu, Liwei Liu. Research Progress on Label-Free Microscopic Imaging Technology[J]. Laser & Optoelectronics Progress, 2019, 56(7): 070005.