幼年到成年斑马鱼大脑的OCT活体三维可视化  下载: 1335次
下载: 1335次
1 引言
大脑是人体最为复杂的器官,阿尔茨海默病、帕金森综合征、癫痫等脑疾病仍严重影响着人类的健康,对大脑结构和功能的探索是当今科学研究的热点,各国相继推出了脑研究计划[1-2]。模型动物在脑相关研究中起着关键的作用,猴、大小鼠等常见哺乳动物存在体型大、发育慢和成本高等问题,寻找新的模型动物是解决这些问题的捷径。
作为脊椎动物,斑马鱼与人的基因重合度高达85%,且具备相似的器官,近几年已经成为一种广泛认可的新模型动物[3-6]。幼年斑马鱼体型小且通体透明,适用于光学显微成像[7-10]。但成年斑马鱼的体长可达3cm,且表皮由于色素沉积而透明度较差[11],光学显微成像技术不足以对成年斑马鱼的大脑进行活体成像。因此,目前基于成年斑马鱼的大脑相关研究主要是通过切片染色的方法来观察大脑的结构。但开展切片染色之前必须处死模型动物,这显然对大脑发育研究是不利的。
作为独特的散射光成像技术,光学相干层析术(OCT)是基于低相干干涉原理并结合共焦扫描模式的一种新型光学成像技术,可对生物组织或其他散射介质内部的微观结构进行高分辨率的断面层析成像[12-14]。其显著优点包括:远高于白光成像和荧光成像的穿透深度,微米级分辨率的三维成像能力,以及无需标记非接触式无损检测模式[15-17]。目前OCT已成功应用在心脏内科和眼科的临床诊断中[18-20]。本课题组前期的研究表明,OCT非常适用于成年斑马鱼的大脑成像[21-24]。本文利用OCT对幼年(>7日龄)到成年阶段的斑马鱼大脑进行活体三维可视化处理,并将OCT成像结果与切片染色结果进行对比分析,以评估OCT用于大脑发育相关研究的可行性。
2 材料和方法
2.1 OCT成像装置
本文采用一套频域OCT系统(TEL210, Thorlabs, 美国),该OCT系统的结构如
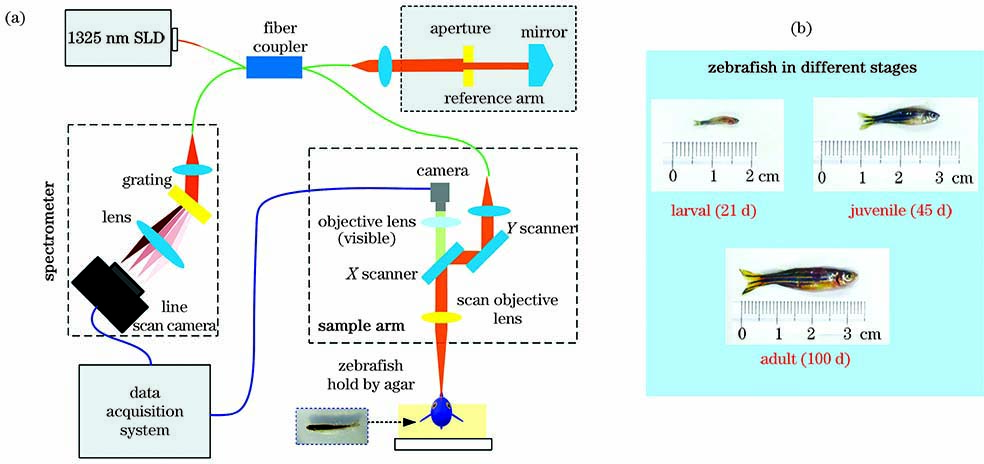
图 1. OCT系统和斑马鱼样品。(a)OCT装置图以及凝胶固定的斑马鱼照片;(b)三个年龄段的斑马鱼样品照片
Fig. 1. OCT system and zebrafish samples. (a) Schematic of OCT setup and photograph of zebrafish hold by agar; (b) photograph of zebrafish samples from three age groups
2.2 斑马鱼样品
实验是在广州医科大学伦理委员会指导下开展的,种鱼引自南方医科大学张译月教授课题组,所有样品鱼是在本实验室自建饲养系统中繁殖的,系统保持水体(28 ± 0.5) ℃的温度,并给予规律的明暗(14h/10h)照明。斑马鱼发育主要分为四个阶段,本文选取孵化后21,45,100d的野生型斑马鱼用于OCT活体成像。三组体长分别为1 ,2 ,3cm,每个年龄点选三条行为正常的斑马鱼用于研究,斑马鱼的照片如
2.3 试剂配制
麻醉剂的配制:将Tricaine(A5040,Sigma,美国)粉末溶于Holtfreter 缓冲液中,制成Tricaine质量分数为0.4%的25× 储备液,后取适量储备液稀释为1×(Tricaine质量分数为0.01%)的工作液以用于麻醉斑马鱼。琼脂溶液的配制:称取1g的琼脂粉(广州环凯微生物科技公司)并加入到100mL的蒸馏水中,充分搅拌混匀,加热至琼脂粉完全溶解,用于固定被麻醉的斑马鱼。
2.4 病理实验
斑马鱼样品完成OCT活体成像后,采用冰水浸泡的方法进行安乐死,然后置于Bouin氏液中固定24h,再置于流水中冲洗24h。将经过流水冲洗处理的斑马鱼样品按照标准流程进行脱水处理并被包埋成蜡块。将包埋好的蜡块固定于旋转切片机(RM 2245,Leica,德国)上,并被切成厚度为4μm的薄片。染色前将切片放入60 ℃恒温箱中烤2h,再按H&E染色标准进行切片,最后利用数字病理玻片扫描仪(CS2,Leica,德国)对染色后的切片进行图像采集。对斑马鱼头部进行了连续的切片,尽可能多地获取头部的横断面和水平面染色图片,便于后期用于与OCT结果进行对比。
2.5 数据测量和分析
二维OCT图像是采集系统生成的,斑马鱼头部的三维OCT图像是利用Image J软件重建的。斑马鱼大脑的面积是利用Image J软件测量的,MATLAB软件用于二维OCT图像的分割和斑马鱼大脑体积的测量。对同年龄段三个斑马鱼进行测量,在获取大脑面积和体积数据后,使用Origin软件求取平均值和标准差。
3 实验结果
3.1 不同日龄斑马鱼头部的OCT成像
如

图 2. 斑马鱼头部的OCT活体成像。(a)连续的B扫描OCT图像;(b)重建的三维OCT图像;(c)三维OCT图像的虚拟分割结果
Fig. 2. OCT in vivo imaging of zebrafish head. (a) Continuous B-scan OCT images; (b) constructed three-dimensional OCT images; (c) virtual segmentation results of three-dimensional OCT images
3.2 比较OCT断层结果与切片染色结果
病理学切片染色多从冠状面和水平面两个视角观察斑马鱼大脑结构,因此本文从三维OCT图像中提取了冠状面和水平面的OCT断层结果。

图 3. 三个年龄段斑马鱼大脑的冠状面图像。(a) OCT图;(b)切片染色图
Fig. 3. Coronal views of images of zebrafish brains from three age groups. (a) OCT images; (b) sectional staining images
斑马鱼大脑的水平面图像如

图 4. 三个年龄段斑马鱼大脑的水平面图像。(a) OCT图;(b)切片染色图
Fig. 4. Horizontal views of images of zebrafish brains from three age groups. (a) OCT images; (b) sectional staining images
3.3 测量不同日龄斑马鱼大脑的体积
大脑体积是评价脑发育程度的一个重要指标,利用图像分割方法,将脑组织从颅骨和其他组织的包围中剥离出来,结果

图 5. 测量斑马鱼大脑的体积。(a)斑马鱼大脑的三维图;(b)大脑体积测量结果
Fig. 5. Measured brain volume of zebrafish. (a) Three dimensional images of zebrafish brains; (b) measured results of brain volume
4 讨论
与哺乳动物类似,斑马鱼大脑位于颅骨的下方,斑马鱼的大脑尺寸会从幼年阶段的几十微米增大到成年阶段的1mm左右。目前,共聚焦成像、光片显微、光声成像、微计算机断层扫描技术(Mirco-CT)、核磁共振成像(MRI)以及OCT等技术都被用于斑马鱼的活体成像[8, 11, 25-28]。
目前仍然广泛使用的切片染色技术可以高分辨率地显示大脑的组织结构,但切片染色存在周期长、需要处死动物等问题。此外,生物组织会在切片染色过程中发生形变,这对组织尺寸的测量会产生很大的影响。对
表 1. 斑马鱼活体成像技术的对比[8, 11, 25-28]
Table 1. Comparison of in vivo imaging techniques of zebrafish [8, 11, 25-Imaging Contrast source Resolution Penetration Imaging Imaging Label Cost Confocal Fluorescence <1μm <500μm Embryo Low Yes *** Light sheet Fluorescence 1--10μm 0.1--5mm Embryo and Fast Yes *** Photoacoustic Optical 100μm--1mm <10mm Adult Fast No *** Micro-CT X-ray attenuation 2--3mm No limited Adult Medium No *** MRI H+ concentration 2--3mm No limited Adult Low No **** OCT Optical scattering 1--10μm 2--3mm Infant and adult Fast No **
|

图 6. 基于图4 得到的斑马鱼大脑的面积。(a)~(c)切片染色结果和OCT结果的对比;(d)~(f)放大的切片染色结果
Fig. 6. Brain area of zebrafish obtained based on Fig. 4 . (a)--(c) Comparison of sectional staining results and OCT results; (d)--(f) enlarged sectional staining results
5 结论
验证了对孵化后21,45,100d斑马鱼大脑进行OCT活体三维可视化处理的可能性。OCT成像结果和切片染色结果共同证实,从幼年到成年阶段,斑马鱼大脑发育迅速。将虚拟分割技术与三维OCT图像结合,可从冠状面和水平面多层次显示脑结构,并定量测量脑体积。在图像质量媲美病理结果的同时,OCT的活体成像和三维成像能力使其具有独特的优势。OCT作为一种新型大脑活体成像技术,可应用于基于斑马鱼的脑发育和衰退相关的研究中。
[1] 李萍萍, 马涛, 张鑫, 等. 各国脑计划实施特点对我国脑科学创新的启示[J]. 同济大学学报(医学版), 2019, 40(4): 397-401.
Li P P, Ma T, Zhang X, et al. Enlightenment for China's brain science innovation from global brain projects[J]. Journal of Tongji University (Medical Science), 2019, 40(4): 397-401.
[5] 黄春念, 张晶晶. 模式动物斑马鱼在中枢神经系统疾病研究中的应用[J]. 中国实验动物学报, 2018, 26(3): 392-397.
Huang C N, Zhang J J. Research progress on the application of zebrafish in central nervous system diseases[J]. Acta Laboratorium Animalis Scientia Sinica, 2018, 26(3): 392-397.
[6] 蒋鹏翀, 魏巍, 胡芬, 等. 基于激光消融技术的斑马鱼条纹再生的研究[J]. 中国激光, 2018, 45(2): 0207024.
[7] 朱雨, 杨光, 李思黾, 等. 斑马鱼肌肉结构的定量偏振成像[J]. 光学学报, 2019, 39(8): 0811001.
[8] Randlett O, Wee C L, Naumann E A, et al. Whole-brain activity mapping onto a zebrafish brain atlas[J]. Nature Methods, 2015, 12(11): 1039-1046.
[9] 孙乐, 杜久林. 大脑神经联接图谱的研究进展[J]. 中国科学:生命科学, 2018, 48(3): 253-265.
Sun L, Du J L. Progress in brain neural connectomics[J]. Scientia Sinica (Vitae), 2018, 48(3): 253-265.
[12] Huang D, Swanson E A, Lin C P, et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181.
[13] Fercher A F, Drexler W, Hitzenberger C K, et al. Optical coherence tomography——principles and applications[J]. Reports on Progress in Physics, 2003, 66(2): 239-303.
[14] 韩涛, 邱建榕, 王迪, 等. 光学相干层析显微成像的技术与应用[J]. 中国激光, 2020, 47(2): 0207004.
[15] Yaqoob Z, Wu J G, Yang C. Spectral domain optical coherence tomography: a better OCT imaging strategy[J]. BioTechniques, 2005, 39(6S): S6-S13.
[16] 李培, 杨姗姗, 丁志华, 等. 傅里叶域光学相干层析成像技术的研究进展[J]. 中国激光, 2018, 45(2): 0207011.
[17] 魏波, 袁治灵, 唐志列. 基于光热光学相干层析技术的肿瘤组织三维成像[J]. 光学学报, 2020, 40(4): 0411002.
[18] 潘柳华, 张向阳, 李中梁, 等. 基于光声-光学相干层析成像的血流测量技术[J]. 中国激光, 2018, 45(6): 0607004.
[19] Jang I K, Bouma B E, Kang D H, et al. Visualization of coronary atherosclerotic plaques in patients using optical coherence tomography: comparison with intravascular ultrasound[J]. Journal of the American College of Cardiology, 2002, 39(4): 604-609.
[20] Nassif N, Cense B, Park B H, et al. In vivo high-resolution video-rate spectral-domain optical coherence tomography of the human retina and optic nerve[J]. Optics Express, 2004, 12(3): 367-376.
[21] Østby Y, Tamnes C K, Fjell A M, et al. Heterogeneity in subcortical brain development: a structural magnetic resonance imaging study of brain maturation from 8 to 30 years[J]. The Journal of Neuroscience, 2009, 29(38): 11772-11782.
[22] Divakar Rao K, Alex A, Verma Y, et al. Real-time in vivo imaging of adult zebrafish brain using optical coherence tomography[J]. Journal of Biophotonics, 2009, 2(5): 288-291.
[23] Zhang J, Ge W, Yuan Z. In vivo three-dimensional characterization of the adult zebrafish brain using a 1325nm spectral-domain optical coherence tomography system with the 27 frame/s video rate[J]. Biomedical Optics Express, 2015, 6(10): 3932-3940.
[25] Bai X, Qi Y M, Liang Y Z, et al. Photoacoustic computed tomography with lens-free focused fiber-laser ultrasound sensor[J]. Biomedical Optics Express, 2019, 10(5): 2504-2512.
[26] Seo E, Lim J, Seo S J, et al. Whole-body imaging of a hypercholesterolemic female zebrafish by using synchrotron X-ray micro-CT[J]. Zebrafish, 2015, 12(1): 11-20.
[27] Merrifield G D, Mullin J, Gallagher L, et al. Rapid and recoverable in vivo magnetic resonance imaging of the adult zebrafish at 7T[J]. Magnetic Resonance Imaging, 2017, 37: 9-15.
[28] Lin Y P, Chen T R, Mao G J, et al. Long-term and in vivo assessment of Aβ protein-induced brain atrophy in a zebrafish model by optical coherence tomography[J]. Journal of Biophotonics, 2020, 13(7): e202000067.
Article Outline
毛广娟, 林燕萍, 陈婷如, 张艺晴, 邱婷, 蓝银涛, 向湘, 傅洪波, 张建. 幼年到成年斑马鱼大脑的OCT活体三维可视化[J]. 中国激光, 2020, 47(12): 1207002. Mao Guangjuan, Lin Yanping, Chen Tingru, Zhang Yiqing, Qiu Ting, Lan Yintao, Xiang Xiang, Fu Hongbo, Zhang Jian. OCT in vivo Three-Dimensional Visualization of Zebrafish Brains from Juvenile to Adult[J]. Chinese Journal of Lasers, 2020, 47(12): 1207002.






