光敏剂定量检测方法研究进展  下载: 893次
下载: 893次
Photodynamic therapy (PDT) based on photodynamic reaction has been established as a novel treatment modality for cancers and precancerous lesions. PDT adopts the light with an appropriate wavelength in the presence of oxygen to activate a photosensitizer and generate reactive oxygen species (ROS), which then causes localized cell death or tumor necrosis. Concisely, PDT treatment may be described by specifying the administered photosensitizer dose, treatment light dose, and drug-light interval. As a basic component of PDT, the spatial distribution of photosensitizer may directly influence the efficacy of PDT. In vivo quantitative measurement of photosensitizer concentration provides the basis for personalized PDT. In addition to the purpose of treatment, the information on the spatial distribution of a photosensitizer in tissue can be used to identify the tumor tissue and associated margins better.
Accurate quantification of in vivo photosensitizer concentration remains challenging. In addition to the photosensitizer, fluorescence also originates from other endogenous fluorophores. Furthermore, intrinsic and instrumental factors also affect the measured fluorescence signal, limiting the ability to make accurate and reliable measurements. Hence, various technologies have been developed to quantify the fluorescence of photosensitizers. This review introduces the instrumentation and intrinsic factors impacting the in vivo quantitative detection of photosensitizer concentrations. Here, recent research progress in the fluorescence correction methods and quantitative detection techniques of photosensitizers are summarized. Finally, the potential challenges and the prospects of quantitative detection techniques of photosensitizer in the clinical translational application of PDT are also briefly discussed.
The quantitative detection of photosensitizer concentration is a complex process. The measured fluorescence intensity is influenced by instrumental factors, which include excitation light sources, optical components, detectors, and computers (Fig. 4). Moreover, the measured signal is also significantly impacted by tissue optical properties, which include the scattering and absorption of the excitation light and fluorescence emissions (Fig. 5). Consequently, several techniques have been developed to correct the measured fluorescence for endogenous fluorescence, tissue optical properties, and instrumental factors. The correction techniques can be broadly categorized as empirical, Monte Carlo (MC) simulation, and theoretical methods (Fig. 6).
The empirical methods have been commonly used to compensate for the attenuation triggered by tissue absorption and scattering on the excitation light and measured fluorescence emissions, which mainly include subtraction and ratio techniques. The empirical methods have the potential to enable near real-time data processing, owing to the inherent simplicity of the proposed methods. MC simulations are most widely used to correct fluorescence measurements, and MC modeling can be used to simulate fluorescence signals collected by an isotropic detector placed on a tissue surface with varying optical properties. The parameters for correction factors can be readily obtained from the MC simulations. The conventional theoretical methods mainly include diffusion theory, modified Beer-Lambert law, and Kubelka-Munk theory. The theoretical methods usually necessitate calculating the transfer function relating intrinsic to measured fluorescence.
To date, technologies for fluorescence quantification have used either contact, handheld spectroscopic probes, or non-contact, wide-field imaging systems
In addition to spectroscopic probes and wide-field systems, several novel quantitative techniques have been proposed for fluorescence quantification, including fluorescence tomography, single-cell resolved microscopic system, portable imaging system, and endoscopic imaging system. Fluorescence tomography enables the 3D spatial distribution information of photosensitizer to be obtained. Single-cell resolved microscopic system is an encouraging technique for imaging tissue at cellular resolution and has the potential to reveal intra-tumor heterogeneity. Portable quantitative fluorescence imaging systems (e.g., smartphone-based systems) provide convenient image collection, computation, and quantitative imaging guidance at the point of care. The endoscopic fluorescence quantitative imaging system is intended for in vivo imaging of internal body organs.
In vivo qualification of photosensitizer concentration is crucial for personalized PDT and cancer diagnosis. However, the quantitative detection of photosensitizer concentration is a complex process. Ongoing research attempts to develop the depth-resolved, high-sensitivity, high-resolution optical imaging technique for in vivo real-time quantification of the photosensitizer concentration for pre-, during- and post-PDT.
1 引言
光动力疗法(PDT)是一种基于光敏剂、光和氧分子三要素相互作用,选择性清除病变靶组织的新型微创疗法,具有非侵入性、高选择性、创伤小、副作用小等优势,可在清除病灶的同时,最大限度地保留靶器官结构和功能[1-2],目前已在恶性肿瘤、癌前病变和血管性病变等疾病的治疗上展现出良好的效果[3-4]。
然而,目前PDT主要采用经验剂量,缺乏可靠的剂量评测指标来预测治疗效果,导致其临床治疗效果存在差异,存在疗效低下甚至无效的情况[5]。大量研究表明,在相同光敏剂剂量(mg/kg)、给药-照光时间间隔、光辐照功率密度(mW/cm2)和治疗时间的条件下,PDT疗效往往因患者的个体差异而呈现显著差异[6-7]。PDT剂量涉及局部光敏剂浓度、光通量和组织氧浓度[8],这些因素相互影响且动态依赖。剂量不足可能导致治疗不充分,而剂量过量则可能损伤病灶周围的正常组织。随着PDT基础研究的不断深入及临床应用的广泛开展,如何精准控制PDT剂量以提高PDT疗效已成为亟待解决的关键性难题。光敏剂作为PDT的关键要素之一,其在体浓度分布是PDT核心剂量指标之一,直接影响PDT疗效[9-10]。临床研究表明,在相同光敏剂给药剂量(2 mg/kg)下,光敏剂潴留浓度在相同患者不同部位之间和不同患者之间分别存在2.9和8.3倍的差异[11]。因此,实现光敏剂剂量在体定量检测是开展个性化PDT精准治疗的前提。
激光诱导荧光光谱技术是监测光敏剂在体浓度及光漂白的主要方法,其基本原理为:采用特定波长激光激发病灶中潴留的光敏剂,通过光敏剂发射荧光特征峰的强度变化,评估PDT术前及术中光敏剂的浓度变化。然而,组织中光敏剂荧光强度的测量将受到组织光学特性、内源性荧光及检测仪器等诸多因素的影响,给光敏剂浓度定量检测带来了挑战。本文首先介绍了光敏剂浓度在体定量检测的影响因素;重点总结了目前常用的光敏剂荧光光谱定量校准方法及荧光定量检测技术;最后讨论了光敏剂定量检测技术在PDT临床转化应用中所面临的挑战和发展方向。
2 PDT的原理
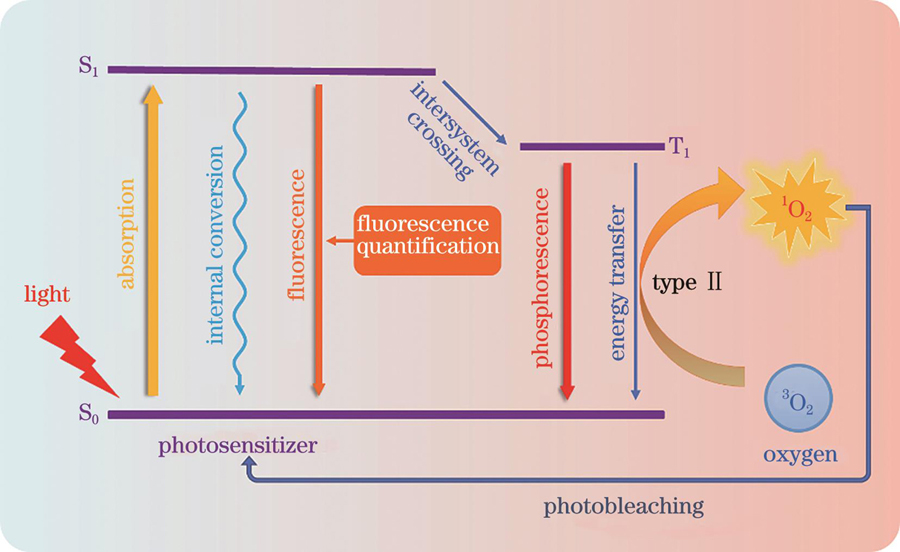
PDT治疗过程为:通过局部涂敷或静脉注射给予患者光敏剂,经特定时间代谢后,光敏剂将选择性潴留于病变组织,与正常组织形成光敏剂浓度差;此时,采用特定波长治疗光源照射病变组织,组织中的光敏剂受激发产生具有细胞毒性的活性氧或自由基等活性物质。其中,单线态氧(1O2)被认为是Ⅱ型光动力反应的主要细胞毒性物质,病变组织因富含光敏剂而被破坏,周围正常组织因光敏剂含量低而不受损伤或损伤较小[12]。II型PDT作用原理如
随着PDT基础研究的不断深入及临床应用的推广,如何精准控制PDT剂量以提高PDT疗效已成为亟待解决的关键性难题。目前PDT剂量学的方法主要分为:显式剂量法、隐式剂量法、直接剂量法、生物学剂量法。
1)直接剂量法:通过1O2近红外发光直接测定PDT过程中产生的1O2含量,从而推算PDT剂量。
2)显式剂量法:通过测量病变靶组织中光敏剂的浓度、光功率密度及组织氧分压,并借助一定的数学模型推算PDT剂量。
3)隐式剂量法:通过监测PDT过程中光敏剂的光漂白速率来间接评估所产生的1O2量,进而推算PDT剂量。
4)生物学剂量法:通过监测PDT治疗前后及过程中的血管损伤程度、组织坏死程度等,评估组织的生物学响应,进而推算PDT剂量。
在上述方法中,由于1O2发光极其微弱且波长位于近红外波段,在人体中极难监测,目前直接剂量法的研究仅限于细胞和动物实验[14]。生物学剂量法主要关注PDT过程中及术后病灶区域的生物学效应(如组织微结构、血流等)变化,通常难以根据这些效应变化预测最终疗效。目前,显式和隐式剂量法已在临床中得到初步应用,这两种方法的关键均是通过在术前及术中对光敏剂浓度进行定量监测以实现PDT剂量的定量评估。
定量检测光敏剂的在体浓度分布还可用于优化给药-照光时间间隔,最大限度地减少PDT对周围正常组织的毒副作用[15]。与此同时,光敏剂的光漂白特性与光敏剂的在体浓度直接相关,其在不同光辐照强度下的光漂白速率不尽相同,因此,在体光敏剂浓度是PDT中最为重要的剂量参数[9,16-17]。此外,基于光敏剂选择性富集于病灶的特点,可将其用于光动力诊断,并根据光敏剂浓度分布引导手术的精准切缘[18-20]。
3 光敏剂定量检测的影响因素
3.1 光敏剂定量检测流程
光敏剂浓度定量检测通常采用激光诱导荧光光谱检测技术,通过建立光敏剂浓度与荧光强度的定量关系曲线,实现光敏剂浓度在体定量检测。然而,测量所得的荧光强度与内源性荧光、光敏剂浓度、荧光量子产量及组织光学特性等内在因素直接相关,也与采用的检测技术及参数设定等检测仪器因素相关[21-23]。其中,荧光信号在组织体中的传输将受到组织光学特性(散射和吸收)的影响,相同浓度的光敏剂产生的荧光经不同生物组织传输后,发射出的荧光强度将完全不同,若无法有效校正组织光学特性对发射荧光的扭曲效应[22],则无法建立在体光敏剂浓度与荧光强度的定量关系,导致难以准确评估光敏剂浓度。因此,建立荧光强度、组织光学特性和光敏剂浓度三者之间的定量关系模型,对于定量检测光敏剂浓度至关重要。
光敏剂(PS)浓度定量检测流程如
3.2 光敏剂定量检测的影响因素
在溶液体系中,当光敏剂浓度较低时,光敏剂荧光强度与其浓度呈线性关系。然而,组织中光敏剂的荧光强度测量受光敏剂浓度、组织内在因素(如组织光学特性、内源性荧光等)及检测仪器因素(如仪器特性、检测光环镜等)的影响,导致荧光强度和光敏剂浓度之间失去线性关系,可能造成光敏剂浓度的高估或低估,增加了光敏剂浓度定量检测的挑战性[24-25]。影响光敏剂浓度定量的因素如

图 3. 影响光敏剂荧光强度测量的因素
Fig. 3. Factors affecting fluorescence intensity measurement of photosensitizers
3.2.1 仪器因素
仪器因素[26-27]主要包括激发光源、光学元件、探测器及仪器的控制与显示[23],具体如
![影响光敏剂荧光强度测量的仪器因素[23]](/richHtml/zgjg/2023/50/3/0307201/img_04.jpg)
图 4. 影响光敏剂荧光强度测量的仪器因素[23]
Fig. 4. Instrumental factors affecting measurement of fluorescence intensity of photosensitizers[23]
激发光源的选取直接决定了光敏剂的激发效率及激发深度,常用的激发光源包括滤波后的宽带光源、激光二极管(LD)、发光二极管(LED)等。激发光源的核心参数包括光源的光谱带宽、输出效率、输出光通量、输出光束的立体角、激发光源与待测组织间的距离等[28-30]。光学元件的设计和选择对于提高荧光检测灵敏度及抑制背景噪声至关重要。荧光检测过程中的光学元件主要包括光学收集系统和滤光片,光学收集系统参数包括视场大小、景深、镜头F数和工作距等,滤光片的核心参数包括截止深度及带宽等。探测器性能直接影响荧光检测灵敏度及成像分辨率,常用的光电探测器包括电荷耦合器件(CCD)、电子倍增CCD(EMCCD)、像增强CCD(ICCD)、互补金属氧化物半导体(CMOS)、科学级CMOS(sCMOS)等。探测器的主要性能参数包括动态范围、暗噪声、像素分辨率、相机增益以及探测器的读出速率等[31]。仪器的软件控制、信息处理、数据存储和硬件显示也与最终成像效果息息相关,这些因素与计算机主机及显示器性能直接相关。
可靠的检测仪器设计可极大提高光敏剂浓度定量测量的准确性[32],通过严格控制检测环境并预先对检测仪器进行定标,可消除以上仪器相关因素对荧光定量的影响。同时,可使用校正方法来消除仪器检测过程中产生的荧光衰减。
3.2.2 内在因素
如

图 5. 影响光敏剂荧光强度测量的内在因素。(a)组织光学特性;(b)内源性荧光
Fig. 5. Intrinsic factors affecting measurement of fluorescence intensity of photosensitizers. (a) Tissue optical properties; (b) endogenous fluorescence
如
内源性荧光团是生物组织内能发射内源性荧光的天然荧光分子,包括可自发荧光的生物分子和生物分子中的某些发光基团,如内源性卟啉、烟酰胺腺嘌呤二核苷酸(NADH)等。如
此外,PDT的给药方式也会对光敏剂浓度定量检测产生影响,系统给药和局部给药分别通过静脉注射和局部涂敷的方式给予光敏剂,两种给药方式下的光敏剂传输过程存在差异,光敏剂浓度定量检测也会受不同因素的影响[13]。
4 荧光光谱校准算法
光敏剂浓度定量检测受到内源性荧光团、组织光学特性(散射和吸收)等多种因素的影响,要消除这些因素的影响,必须建立可靠的荧光光谱校准算法。目前,国内外多个研究团队提出了多种荧光光谱校准算法,这些算法具有各自的适用范围和优缺点。如
4.1 经验法
经验法主要基于被测组织的漫反射光谱和原始荧光光谱,通过获取与组织光学特性相关的校正因子,补偿激发光及荧光在组织传输过程中的衰减[43],进而实现原始荧光信号的校正。
4.1.1 减法技术
早期的经验法主要采用减法技术,该方法假设激发光和发射光被血管完全吸收,通过从原始荧光强度中扣除血红蛋白的吸收效应以补偿血液含量变化引起的荧光变化[21]。1979年,Kramer等[44]研究发现,由于荧光强度的影响因素较为复杂,使用荧光强度和激发光强度的比值来校正荧光强度,相较于减法技术中代数相减的校正方法准确率更高。因此,基于比率技术的荧光光谱校正方法被大量提出并被广泛使用。
4.1.2 比率技术
2012年,Valdés等[45]提出了半经验的光谱约束双波段归一化方法,检测系统采用直径为1.1 mm、内含4根光纤的光纤探头,其中两根光纤分别连接白光LED,一根光纤连接波长为405 nm的荧光激发光源,一根光纤连接光谱仪以采集漫反射光谱和荧光光谱。405 nm激发光敏剂原卟啉(PpIX)荧光的校正公式为
式中:
4.2 基于蒙特卡洛模拟的方法
蒙特卡洛(MC)模型是基于光子传输的模型,可模拟任意光源在生物组织内的传输过程。生物组织的光学传输过程被视为随机散射过程,与MC模拟的过程相似,因此MC模型能够模拟组织吸收和散射特性对荧光激发和发射的影响[33],为光敏剂的定量检测奠定了理论基础,因此得到广泛应用。
2017年,Ong等[11]提出了基于蒙特卡洛模型的组织光学特性校正函数:
式中:
2020年,Zou等[47-48]提出了一种基于双波长(激发与发射)组织荧光光谱的校准算法,并验证了其有效性。校准公式为
式中:
4.3 理论法
理论法通过对组织光学特性的直接估计,测量并计算荧光在激发波长和发射波长处的传递函数,构建荧光传输模型。
4.3.1 扩散理论
在高光衰减条件(
式中:
4.3.2 修正的比尔-朗伯定律
修正后的比尔-朗伯(Beer-Lambert)定律重点描述可测量的出射量(如光强)与物质光学特性参数(吸收和散射系数等)之间的关系,常用于计算并提取组织光学特性参数,如通过提取吸收系数可有效补偿组织表面血液的吸收效应[21]。2009年,Wilson等[50]基于修正的比尔-朗伯定律校正了血红蛋白的吸收效应对胰腺组织荧光光谱的影响,完成了胰腺癌、胰腺炎和正常胰腺组织的分类。2022年,Schmidt等[51]基于修正的比尔-朗伯定律,提取了组织吸收系数,并系统研究了影响漫反射/荧光检测设备定标及组织光学特性提取的主要因素,研究结果表明组织仿体的质量和检测光纤探头性能对于系统定标及组织光学特性提取是最重要的。
4.3.3 Kubelka-Munk模型
Kubelka-Munk模型(K-M模型)是基于光传输的双通量数学模型。该模型假设入射光发生漫反射,且组织折射率与周围介质的折射率相同,考虑吸收漫射辐射和散射漫射辐射两个方向的通量,常用于提取组织光学特性参数。K-M模型计算所得的吸收系数和散射系数可用于计算传递函数,实现荧光光谱的校正。2022年,Hamdy等[52]基于K-M模型估计了组织吸收和散射系数,研究了入射激光的散射随入射激光功率的变化,发现在头骨及皮肤样本中,组织散射会随着入射光功率的增加而减小。
总之,与经验法相比,使用理论法校准荧光光谱具有更高的准确性,理论法常用于单点的荧光定量检测[53]。但理论法须建立可靠的理论模型、提供大量随机的光子轨迹,才能获得可靠的校准结果,且对传递函数的计算速度也有一定要求。为进一步提高光谱校正算法的准确性及临床可用性,出现了多种方法相结合的理论模型,如比尔-朗伯定律和光传输扩散理论相结合的校正算法[54]等。在选取荧光光谱的校准算法时,应根据PDT过程中的光敏剂浓度动态变化速度、吸收峰和荧光峰以及组织的光学特性差异来选取特定的校正算法。
5 光敏剂定量检测技术
如

图 7. 光敏剂定量检测技术结构示意图。(a)接触式光谱探头示意图;(b)非接触式宽场成像系统示意图
Fig. 7. Schematics of quantitative detection techniques of photosensitizer. (a) Schematic of contact spectroscopic probe; (b) schematic of non-contact wide-field imaging system
5.1 接触式光谱探头
接触式光谱探头是临床最常用的荧光定量检测技术,不仅可用于光敏剂荧光定量检测,还可用于肿瘤的诊断和分级[55]。光谱探头主要由用于激发和收集发射光的多通道光纤阵列组成,采用LED或LD作为激发光源,同时利用光谱仪对荧光或者漫反射光谱进行检测。光谱探头通常为手持式探头,将探头前端与待测组织接触便可直接检测荧光信号。该技术可减少待测组织粗糙表面的散射吸收对荧光信号的影响,具有系统简单、检测灵敏度高、操作便捷等优点[56]。典型的接触式光谱探头如
![接触式荧光定量检测光谱探头结构示意图。(a)基于接触式探头的新型荧光剂量计[41];(b)基于多激发多发射系统的在体光动力剂量探头[57];(c)基于多光谱的在体荧光定量检测探头[43]](/richHtml/zgjg/2023/50/3/0307201/img_08.jpg)
图 8. 接触式荧光定量检测光谱探头结构示意图。(a)基于接触式探头的新型荧光剂量计[41];(b)基于多激发多发射系统的在体光动力剂量探头[57];(c)基于多光谱的在体荧光定量检测探头[43]
Fig. 8. Schematics of contact spectroscopic probes for quantitative fluorescence detection. (a) Novel contact probe-based fluorescence dosimeter[41]; (b) in vivo photodynamic dosimeter probe using multi-excitation multi-emission system[57]; (c) in vivo fluorescence quantitative detection probe based on multi-spectrum[43]
2020年,Nishio等[41]开发了一种基于接触式探头的新型荧光剂量计,如
总之,接触式光谱探头具有系统简单、荧光定量检测精度高等优点,目前已在术中肿瘤组织识别、PDT治疗前后光敏剂浓度监测上得到初步应用,未来将进一步提高系统检测灵敏度,并逐步实现术中照明光环镜下的正常使用。此外,还可以将探头进一步小型化,未来用于体腔内光敏剂定量检测。然而,本技术为单点检测技术,单点浓度信息难以反映光敏剂在病灶中的空间分布情况,实际应用中需要通过多点测量才可初步获取光敏剂浓度分布信息。
表 1. 光敏剂荧光定量技术
Table 1. Quantitative detection technologies of fluorescence of photosensitizers
|
5.2 非接触式宽场荧光定量成像
非接触式宽场荧光定量成像主要利用空间频域成像或者多光谱成像等方法,分别对组织光学特性及荧光进行二维成像以实现荧光定量检测[22,59],代表性的非接触式宽场荧光定量成像系统结构如
![非接触式宽场荧光定量成像系统结构图。(a)定量空间频域荧光成像[32];(b)基于空间频域成像的快照式定量荧光成像系统[53];(c)宽场光谱分辨荧光成像系统[62];(d)多模荧光定量成像系统[3]](/richHtml/zgjg/2023/50/3/0307201/img_09.jpg)
图 9. 非接触式宽场荧光定量成像系统结构图。(a)定量空间频域荧光成像[32];(b)基于空间频域成像的快照式定量荧光成像系统[53];(c)宽场光谱分辨荧光成像系统[62];(d)多模荧光定量成像系统[3]
Fig. 9. Schematics of non-contact wide-field imaging systems for quantitative detection of fluorescence intensity. (a) Quantitative spatial frequency domain fluorescence imaging[32]; (b) snapshot quantitative fluorescence imaging system based on spatial frequency domain fluorescence imaging[53]; (c) wide-field spectral-resolved fluorescence imaging system[62]; (d) multimodal quantitative fluorescence imaging system[3]
5.2.1 定量空间频域荧光成像
空间频域成像(SFDI)是一种新兴的非接触式宽场成像技术,主要采用结构光照明与特定光传输模型相结合的方法,定量计算组织的光学特性参数,具有数据采集简单、计算简单等特点[63]。SFDI的基本原理为:将不同频率的正弦光投影至待测组织表面,通过检测空间调制的漫反射图像,计算得到组织吸收和散射空间分布图,照明的空间频率对应不同的生物组织光学特性,其优势在于可生成与荧光图像具有相同分辨率的组织光学特性图像[64-66]。
2005年,Cuccia等[61]提出一种快速、非接触且无须扫描的成像方法,实现了混沌介质中宽场光学特性成像及层析成像,为基于空间频域成像技术的光学特性分析奠定了基础。2011年,Saager等[32]开发了基于LED照明的SFDI系统,系统结构如
5.2.2 快照式定量荧光成像
快照式定量荧光成像是对成像探测器拍摄得到的病灶区域的荧光进行定量检测的成像技术,侧重于成像的实时性和硬件的高灵敏性。2015年,Valdes等[69]提出了基于单次快照光学特性(SSOP)的实时(视频帧率)成像技术。该技术在激发和发射光波长处同步采集漫反射图像,并同时采集荧光图像,通过漫反射图像提取组织光学特性参数,利用所提取的组织光学特性参数对荧光图像进行校准以获取荧光定量图。2017年,Valdes等[53]基于SSOP进一步开发了基于空间频域成像的组织光学特性和荧光同步快照式成像技术即QF-SSOP,如
5.2.3 宽场光谱分辨荧光成像
宽场光谱分辨荧光成像主要基于多光谱或高光谱成像技术,实现检测区域逐个像素点的光谱检测,通过对漫反射光谱及荧光光谱的同步检测,实现光敏剂浓度的精确定量检测。2012年,Valdés等[40]提出了基于光谱分辨数据的定量荧光成像,同步获取了光谱分辨的荧光图像及漫反射光谱图像,并使用光谱约束双波段归一化算法完成了组织光学特性的近实时校正,在组织仿体实验中,该系统对PpIX的检测灵敏度为20 ng/mL。2017年,Xie等[62]利用第二代科学CMOS相机和改进的光谱约束归一化算法,基于高光谱图像实现了高分辨的PpIX定量成像,检测灵敏度为10 ng/mL,系统结构如
如
表 2. 非接触式宽场荧光定量成像技术
Table 2. Non-contact wide-field imaging technologies for quantitative detection of fluorescence intensity
|
5.3 新型荧光定量成像技术
5.3.1 层析荧光定量成像技术
层析荧光定量成像技术能够实现深度分辨的光敏剂荧光定量检测,进而获取光敏剂三维空间分布信息,对于精确量化光敏剂剂量至关重要,还可以用于实体肿瘤浸润深度评估,具有巨大的临床应用价值。荧光断层扫描是临床中分子造影剂评估的常用工具,近年来被逐步用于荧光强度定量检测,并初步形成了光敏剂浓度的三维荧光定量技术[73]。2009年,Kepshire等[73]通过时间相关单光子计数技术结合微计算机断层扫描技术(Micro-CT),证明了无创断层扫描PpIX荧光的可行性,为进一步实现荧光的三维定位和定量评估奠定了基础。与CT相比,采用非电离辐射且成本更低的成像方法来获得生物组织中荧光团的浓度分布更为理想。在荧光断层扫描成像时,还可以结合超声、磁共振成像等技术同步获取组织三维结构信息。2010年,Gruber等[74]开发了首个用于皮肤肿瘤成像的高频超声引导荧光层析成像系统,双层组织仿体及皮下小鼠肿瘤模型实验表明,该技术能够定量获取分层的PpIX浓度分布信息。2019年,Mehrabi等[75]开发了基于CCD的温度调制荧光层析成像系统,该系统主要通过高强度聚焦超声扫描温度敏感荧光染料(ThermoDots)实现三维成像,空间分辨率约为1.3 mm,组织成像深度为60 mm,荧光定量误差<3%,具有一定的临床应用潜力。
使用红光激发非接触式宽场成像技术能够获取深度分辨的荧光信息,目前已得到初步应用。2019年,Sibai等[76]采用与高光谱成像相结合的空间频域成像系统实现了基于632 nm红光激发的近表面荧光成像,完成了组织的深度荧光定量估计。使用正向扩散模型估计不同深度处的PpIX浓度,该系统检测深度可至(9.5±0.4)mm,可检测的PpIX质量浓度范围为5~15 μg/mL,与真实浓度相比,检测平均误差为15%,此项工作为三维荧光定量成像技术奠定了基础。2020年,Wirth等[77]将空间频域成像系统和红光激发光源集成到商业手术显微镜上,通过深度传感算法对红光激发下组织中的PpIX进行了深度荧光定量成像,能够在1 min时间内实现深度PpIX荧光图像的采集和处理,在脑组织仿体实验中,在空间分辨率优于1 mm的情况下,深度估计误差小于2 mm。他们首次在体完成了脑瘤手术过程中PpIX荧光的深度分布评估,该工作证明了临床应用三维荧光定量的可行性。
层析荧光定量成像技术能够实现深度分辨的组织荧光成像,可以获取范围更广、更全面的荧光空间分布信息,是荧光定量检测技术的重要发展方向。然而,由于深度分辨荧光成像需要还原的信息较多,其定量检测的精度偏低,且耗时较长,后续还须不断优化算法。因此,在实际应用中,须综合考虑是否需要进行深度分辨荧光定量检测。通常情况下,浅层范围(<150 μm)的成像能力即可满足临床需求。此外,对于肿瘤边界评估,还须考虑不同肿瘤所需的成像深度[78]。
5.3.2 细胞尺度分辨显微荧光定量成像技术
高分辨光学显微镜已成为生命科学重要研究工具,主要包括共聚焦显微镜、单光子显微镜、多光子显微镜等,具有分辨率高等特点,可实现高分辨的显微荧光定量检测[79]。2018年,Belykh等[80]开发了基于宽视场成像的扫描光纤内窥镜(SFE),可定量检测单个肿瘤细胞内的PpIX浓度,也可以得到脑瘤小鼠模型肿瘤区域的PpIX荧光分布图。2021年,Belykh等[81]采用具有细胞尺度分辨率的手持式共焦激光内窥显微镜(CLE),对2-NBDG[2-(N-(7-nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-2-deoxyglucose]荧光进行了定量分析,可基于不同细胞中的荧光分布情况,区分正常和肿瘤细胞,显著提高了肿瘤边缘的诊断精度。2019年,Reinert等[82]搭建了可定量检测PpIX浓度分布的光学显微镜(Qp9),并将检测得到的PpIX浓度进行彩色编码,得到了组织样品表面的PpIX浓度分布图,可辅助医生切除肿瘤时的精准切缘,在光学组织仿体实验中,PpIX检测灵敏度为10 ng/mL。此外,受限于激发光的穿透深度,深层组织的荧光检测仍是挑战性难题,2022年,Imperato等[35]基于自适应光学校正像差实现了深层组织的荧光激发及成像。光学显微镜检测灵敏度高,能够实现低浓度光敏剂的高分辨荧光成像,在细胞尺度同步获取高分辨率的病灶结构及光敏剂浓度分布信息,可提高基于光敏剂荧光的低级别肿瘤的诊断精度,也可用于细胞尺度的PDT剂量学研究。
5.3.3 便携式荧光定量成像技术
为了更便捷地将开发完成的成像技术应用到临床工作中,快速便携的荧光定量成像设备已成为近年来的研究热点,其中,基于智能手机的荧光成像系统是重要发展方向。2018年,Uthoff等[83]开发了基于智能手机的荧光成像系统,用于口腔癌的筛查。2019年,Ruiz等[29]开发了基于智能手机的宽场定量荧光成像仪,用于PDT治疗皮肤疾病的剂量检测,在光学组织仿体中,光敏剂PpIX的检测灵敏度为0.01 μmol/L,该系统具有成本低、可移植性强等特点,易于集成到临床工作流程中。2021年,Hunt等[84]开发了一个简单的夹持式光学附件,将其置于手机摄像头及LED灯的上方,使用手机内置的LED灯作为光敏剂的激发光源,可实现基于智能手机的荧光定量成像;同时开发了基于手机的图像采集分析软件,在光学组织仿体中,光敏剂PpIX的检测灵敏度小于10 nmol/L。此外,他们还进行了小鼠及人类皮肤局部涂敷5-ALA 1 h后PpIX荧光的在体成像验证。便携式荧光定量成像技术解决了大多数荧光成像设备体积笨重及可移植性和便携性不佳的问题,有利于进行临床转化。然而,该类成像系统的成像分辨率及检测灵敏度通常较低,影响了成像质量。
5.3.4 腔内荧光定量成像技术
腔内光敏剂定量检测是实现腔内个性化光动力精准诊治的前提,也可用于腔内病变的早期诊断。2003年,Sujatha等[85]设计了基于全光纤的柔性内窥荧光定量探头,实现了体腔内(特别是胃肠道)的荧光定量,可用于体腔内的病变诊断。2017年,Ong等[11]开发了基于荧光和激发光定量检测的四通道PDT剂量检测系统,可用于胸腔内的光敏剂浓度定量检测,光敏剂Photofrin的最低在体检测浓度(质量浓度)为0.5 mg/kg。2022年,Thapa等[86]开发了基于斜照明方式的荧光成像和光谱的多模态显微内窥系统,可在生物组织的同一位置同步实现组织显微成像、荧光成像、光谱参数定量检测。该系统的空间分辨率、光谱分辨率、视场大小分别为4.38 μm、0.5 nm和2.071 mm×1.548 mm,有望用于口腔癌的诊断。腔内荧光定量成像技术可用于体腔内组织中的荧光定量检测,实现光敏剂浓度定量检测,有望推动腔内个性化光动力精准诊疗技术的发展。
6 结束语
尽管PDT已成为治疗恶性肿瘤、癌前病变等疾病的有效疗法,但PDT剂量学还处于起步发展阶段,其是限制PDT推广应用的主要瓶颈。其中,在体光敏剂剂量作为PDT核心剂量指标之一,其定量检测仍面临诸多挑战:1)通过改进算法及检测技术,消除由成像探头与待测组织间距离变化及周围环境光引入的误差,实现高分辨率、高灵敏度的实时在体宽场荧光定量成像;2)实现腔内(如消化道、呼吸道、泌尿道、胸膜腔、宫颈管等)的光敏剂空间分布定量检测,以实现腔内PDT剂量个性化监测与调控;3)定量获取分层组织(如皮肤及黏膜等)中的光敏剂空间分布信息,实现深度分辨的光敏剂三维空间分布定量检测;4)综合利用光敏剂浓度的三维空间分布、光通量及氧含量信息构建PDT剂量学指标,建立PDT剂量与疗效之间的量效关系。
实现针对体表和体腔的具备深度分辨能力、高灵敏度、高分辨率的光敏剂浓度实时在体检测是光敏剂定量检测技术的发展方向。将定量获取的光敏剂空间分布信息代入针对个体患者病灶的精细化组织光学模型中,结合光分布及氧浓度分布信息,借助数学建模与仿真技术,获取1O2时空分布信息,最终建立个性化PDT剂量学模型,有望为实现个性化PDT精准治疗奠定基础。
[1] Gu Y, Huang N Y, Liang J, et al. Clinical study of 1949 cases of port wine stains treated with vascular photodynamic therapy (Gu’s PDT)[J]. Annales De Dermatologie et De Venereologie, 2007, 134(3): 241-244.
[2] Wilson B C, Patterson M S. The physics, biophysics and technology of photodynamic therapy[J]. Physics in Medicine and Biology, 2008, 53(9): R61-R109.
[3] Beaulieu E, Laurence A, Birlea M, et al. Wide-field optical spectroscopy system integrating reflectance and spatial frequency domain imaging to measure attenuation-corrected intrinsic tissue fluorescence in radical prostatectomy specimens[J]. Biomedical Optics Express, 2020, 11(4): 2052-2072.
[4] 李黎波, 李文敏, 项蕾红, 等. 光动力疗法在中国的应用与临床研究[J]. 中国激光医学杂志, 2012, 21(5): 278-307.
Li L B, Li W M, Xiang L H, et al. Photodynamic therapy: clinical research and application in China[J]. Chinese Journal of Laser Medicine & Surgery, 2012, 21(5): 278-307.
[5] Kim M M, Ghogare A A, Greer A, et al. On the in vivo photochemical rate parameters for PDT reactive oxygen species modeling[J]. Physics in Medicine and Biology, 2017, 62(5): R1-R48.
[6] 李步洪, 陈天龙, 林立, 等. 光动力疗法基础研究与临床应用的新进展[J]. 中国激光, 2022, 49(5): 0507101.
[7] Kim M M, Darafsheh A. Light sources and dosimetry techniques for photodynamic therapy[J]. Photochemistry and Photobiology, 2020, 96(2): 280-294.
[8] Agostinis P, Berg K, Cengel K A, et al. Photodynamic therapy of cancer: an update[J]. CA: A Cancer Journal for Clinicians, 2011, 61(4): 250-281.
[9] Robinson D J, Karakullukçu M B, Kruijt B, et al. Optical spectroscopy to guide photodynamic therapy of head and neck tumors[J]. IEEE Journal of Selected Topics in Quantum Electronics, 2010, 16(4): 854-862.
[10] Sharikova A V, Finlay J C, Liang X, et al. PDT dose dosimetry for pleural photodynamic therapy[J]. Proceedings of SPIE, 2013, 8568: 856817.
[11] Ong Y H, Kim M M, Finlay J C, et al. PDT dose dosimetry for Photofrin-mediated pleural photodynamic therapy (pPDT)[J]. Physics in Medicine and Biology, 2017, 63(1): 015031.
[12] Correia J H, Rodrigues J A, Pimenta S, et al. Photodynamic therapy review: principles, photosensitizers, applications, and future directions[J]. Pharmaceutics, 2021, 13(9): 1332.
[13] Gunaydin G, Gedik M E, Ayan S. Photodynamic therapy-current limitations and novel approaches[J]. Frontiers in Chemistry, 2021, 9: 691697.
[14] Zhao Y B, Moritz T, Hinds M F, et al. High optical-throughput spectroscopic singlet oxygen and photosensitizer luminescence dosimeter for monitoring of photodynamic therapy[J]. Journal of Biophotonics, 2021, 14(11): e202100088.
[15] Wang X N, Luo D, Basilion J P. Photodynamic therapy: targeting cancer biomarkers for the treatment of cancers[J]. Cancers, 2021, 13(12): 2992.
[16] Garcia M R, Requena M B, Pratavieira S, et al. Development of a system to treat and online monitor photodynamic therapy of skin cancer using PpIX near-infrared fluorescence[J]. Photodiagnosis and Photodynamic Therapy, 2020, 30: 101680.
[17] Kruijt B, van der Ploeg-van den Heuvel A, de Bruijn H S, et al. Monitoring interstitial m-THPC-PDT in vivo using fluorescence and reflectance spectroscopy[J]. Lasers in Surgery and Medicine, 2009, 41(9): 653-664.
[18] Samkoe K S, Bates B D, Elliott J T, et al. Application of fluorescence-guided surgery to subsurface cancers requiring wide local excision: literature review and novel developments toward indirect visualization[J]. Cancer Control, 2018, 25(1): 1073274817752332.
[19] García A A, Zhou X N, Bec J, et al. First in patient assessment of brain tumor infiltrative margins using simultaneous time-resolved measurements of 5-ALA-induced PpIX fluorescence and tissue autofluorescence[J]. Journal of Biomedical Optics, 2022, 27(2): 020501.
[20] Kaneko S, Suero Molina E, Ewelt C, et al. Fluorescence-based measurement of real-time kinetics of protoporphyrin IX after 5-aminolevulinic acid administration in human in situ malignant gliomas[J]. Neurosurgery, 2019, 85(4): E739-E746.
[21] Bradley R S, Thorniley M S. A review of attenuation correction techniques for tissue fluorescence[J]. Journal of the Royal Society, Interface, 2006, 3(6): 1-13.
[22] Valdes P A, Juvekar P, Agar N Y R, et al. Quantitative wide-field imaging techniques for fluorescence guided neurosurgery[J]. Frontiers in Surgery, 2019, 6: 31.
[23] DSouza A V, Lin H Y, Henderson E R, et al. Review of fluorescence guided surgery systems: identification of key performance capabilities beyond indocyanine green imaging[J]. Journal of Biomedical Optics, 2016, 21(8): 080901.
[24] Bonnin D A A, Havrda M C, Lee M C, et al. Characterizing the heterogeneity in 5-aminolevulinic acid-induced fluorescence in glioblastoma[J]. Journal of Neurosurgery, 2019, 132(6): 1706-1714.
[25] Huang Z, Xu H P, Meyers A D, et al. Photodynamic therapy for treatment of solid tumors: potential and technical challenges[J]. Technology in Cancer Research & Treatment, 2008, 7(4): 309-320.
[26] Wei L P, Roberts D W, Sanai N, et al. Visualization technologies for 5-ALA-based fluorescence-guided surgeries[J]. Journal of Neuro-Oncology, 2019, 141(3): 495-505.
[27] Belykh E, Miller E J, Patel A A, et al. Optical characterization of neurosurgical operating microscopes: quantitative fluorescence and assessment of PpIX photobleaching[J]. Scientific Reports, 2018, 8: 12543.
[28] Huang Z, Qiu H X, Shi S S, et al. Fluorescence-guided resection of brain tumor: review of the significance of intraoperative quantification of protoporphyrin IX fluorescence[J]. Neurophotonics, 2017, 4(1): 011011.
[29] Ruiz A J, LaRochelle E P M, Gunn J R, et al. Smartphone fluorescence imager for quantitative dosimetry of protoporphyrin-IX-based photodynamic therapy in skin[J]. Journal of Biomedical Optics, 2019, 25(6): 063802.
[30] Saager R B, Cuccia D J, Saggese S, et al. A light emitting diode (LED) based spatial frequency domain imaging system for optimization of photodynamic therapy of nonmelanoma skin cancer: quantitative reflectance imaging[J]. Lasers in Surgery and Medicine, 2013, 45(4): 207-215.
[31] Kholin V V, Chepurna O M, Shton I O, et al. Methods and fiber optics spectrometry system for control of photosensitizer in tissue during photodynamic therapy[J]. Proceedings of SPIE, 2016, 10031: 10031.
[32] Saager R B, Cuccia D J, Saggese S, et al. Quantitative fluorescence imaging of protoporphyrin IX through determination of tissue optical properties in the spatial frequency domain[J]. Journal of Biomedical Optics, 2011, 16(12): 126013.
[33] Keijzer M, Richards-Kortum R R, Jacques S L, et al. Fluorescence spectroscopy of turbid media: autofluorescence of the human aorta[J]. Applied Optics, 1989, 28(20): 4286-4292.
[34] Pal R, Kumar A T N. Comparison of fluorescence lifetime and multispectral imaging for quantitative multiplexing in biological tissue[J]. Biomedical Optics Express, 2022, 13(7): 3854-3868.
[35] Imperato S, Harms F, Hubert A, et al. Single-shot quantitative aberration and scattering length measurements in mouse brain tissues using an extended-source Shack-Hartmann wavefront sensor[J]. Optics Express, 2022, 30(9): 15250-15265.
[36] Bravo J J, Davis S C, Roberts D W, et al. Mathematical model to interpret localized reflectance spectra measured in the presence of a strong fluorescence marker[J]. Journal of Biomedical Optics, 2016, 21(6): 061004.
[37] Hennessy R J, Lim S L, Markey M K, et al. Monte Carlo lookup table-based inverse model for extracting optical properties from tissue-simulating phantoms using diffuse reflectance spectroscopy[J]. Journal of Biomedical Optics, 2013, 18(3): 037003.
[38] Roig B, Koenig A, Perraut F, et al. Multilayered phantoms with tunable optical properties for a better understanding of light/tissue interactions[J]. Proceedings of SPIE, 2015, 9325: 93250B.
[39] Yuan W, Kut C, Liang W X, et al. Robust and fast characterization of OCT-based optical attenuation using a novel frequency-domain algorithm for brain cancer detection[J]. Scientific Reports, 2017, 7: 44909.
[40] Valdés P A, Leblond F, Jacobs V L, et al. Quantitative, spectrally-resolved intraoperative fluorescence imaging[J]. Scientific Reports, 2012, 2: 798.
[41] Nishio N, van Keulen S, van den Berg N S, et al. Probe-based fluorescence dosimetry of an antibody-dye conjugate to identify head and neck cancer as a first step to fluorescence-guided tissue preselection for pathological assessment[J]. Head & Neck, 2020, 42(1): 59-66.
[42] Middelburg T A, Hoy C L, Neumann H A M, et al. Correction for tissue optical properties enables quantitative skin fluorescence measurements using multi-diameter single fiber reflectance spectroscopy[J]. Journal of Dermatological Science, 2015, 79(1): 64-73.
[43] Grygoryev K, Lu H H, Li C L, et al. Multi-spectral clinical prototype for fluorophore detection[J]. Frontiers in Physics, 2021, 9: 724962.
[44] Kramer R S, Pearlstein R D. Cerebral cortical microfluorometry at isosbestic wavelengths for correction of vascular artifact[J]. Science, 1979, 205(4407): 693-696.
[45] Valdés P A, Leblond F, Kim A, et al. A spectrally constrained dual-band normalization technique for protoporphyrin IX quantification in fluorescence-guided surgery[J]. Optics Letters, 2012, 37(11): 1817-1819.
[46] Kanick S C, Davis S C, Zhao Y, et al. Pre-treatment protoporphyrin IX concentration in actinic keratosis lesions may be a predictive biomarker of response to aminolevulinic-acid based photodynamic therapy[J]. Photodiagnosis and Photodynamic Therapy, 2015, 12(4): 561-566.
[47] Zou J, Meng N, Li W J, et al. Quantitative detection of protoporphyrin IX (PpIX) fluorescence in tissues[J]. Proceedings of SPIE, 2020, 11553: 115530V.
[48] 邹健, 谢树森, 孟娜, 等. 光敏剂PpIX的组织荧光光谱校准方法[J]. 福建师范大学学报(自然科学版), 2021, 37(1): 57-61.
Zou J, Xie S S, Meng N, et al. Calibration method for tissue fluorescence spectrum of photosensitizer PpIX[J]. Journal of Fujian Normal University (Natural Science Edition), 2021, 37(1): 57-61.
[49] Kim A, Khurana M, Moriyama Y, et al. Quantification of in vivo fluorescence decoupled from the effects of tissue optical properties using fiber-optic spectroscopy measurements[J]. Journal of Biomedical Optics, 2010, 15(6): 067006.
[50] Wilson R H, Chandra M, Scheiman J, et al. Mathematical modeling of reflectance and intrinsic fluorescence for cancer detection in human pancreatic tissue[J]. Proceedings of SPIE, 2009, 7187: 71870H.
[51] Schmidt I, Nagengast W B, Robinson D J. Characterizing factors influencing calibration and optical property determination in quantitative reflectance spectroscopy to improve standardization[J]. Journal of Biomedical Optics, 2022, 27(7): 074714.
[52] Hamdy O, Mohammed H S. Variations in tissue optical parameters with the incident power of an infrared laser[J]. PLoS One, 2022, 17(1): e0263164.
[53] Valdes P A, Angelo J P, Choi H S, et al. qF-SSOP: real-time optical property corrected fluorescence imaging[J]. Biomedical Optics Express, 2017, 8(8): 3597-3605.
[54] Chang S K, Arifler D, Drezek R A, et al. Analytical model to describe fluorescence spectra of normal and preneoplastic epithelial tissue: comparison with Monte Carlo simulations and clinical measurements[J]. Journal of Biomedical Optics, 2004, 9(3): 511-522.
[55] Lin W C, Mahadevan-Jansen A, Johnson M D, et al. In vivo optical spectroscopy detects radiation damage in brain tissue[J]. Neurosurgery, 2005, 57(3): 518-525.
[56] Braun F, Schalk R, Heintz A, et al. NADH-fluorescence scattering correction for absolute concentration determination in a liquid tissue phantom using a novel multispectral magnetic-resonance-imaging-compatible needle probe[J]. Measurement Science and Technology, 2017, 28(7): 075903.
[57] Mousavi M, Moriyama L T T, Grecco C, et al. Photodynamic therapy dosimetry using multiexcitation multiemission wavelength: toward real-time prediction of treatment outcome[J]. Journal of Biomedical Optics, 2020, 25(6): 063812.
[58] Shukla S, Singh P, Pandey P K, et al. Extraction of thickness and fluorophore concentration of the upper layer in a two-layered solid phantom using spatially resolved fluorescence spectroscopy[J]. Proceedings of SPIE, 2020, 11363: 113631L.
[59] Valdés P A, Roberts D W, Lu F K, et al. Optical technologies for intraoperative neurosurgical guidance[J]. Neurosurgical Focus, 2016, 40(3): E8.
[60] 李文博, 沈毅, 李步洪. 光学成像技术在光动力剂量监测中的应用进展[J]. 中国激光, 2020, 47(2): 0207006.
[61] Cuccia D J, Bevilacqua F, Durkin A J, et al. Modulated imaging: quantitative analysis and tomography of turbid media in the spatial-frequency domain[J]. Optics Letters, 2005, 30(11): 1354-1356.
[62] Xie Y J, Thom M, Ebner M, et al. Wide-field spectrally resolved quantitative fluorescence imaging system: toward neurosurgical guidance in glioma resection[J]. Journal of Biomedical Optics, 2017, 22(11): 116006.
[63] Bodenschatz N, Krauter P, Liemert A, et al. Model-based analysis on the influence of spatial frequency selection in spatial frequency domain imaging[J]. Applied Optics, 2015, 54(22): 6725-6731.
[64] Cuccia D J, Bevilacqua F P, Durkin A J, et al. Quantitation and mapping of tissue optical properties using modulated imaging[J]. Journal of Biomedical Optics, 2009, 14(2): 024012.
[65] Sweer J A, Chen M T, Salimian K J, et al. Wide-field optical property mapping and structured light imaging of the esophagus with spatial frequency domain imaging[J]. Journal of Biophotonics, 2019, 12(9): e201900005.
[66] Angelo J P, Chen S J K, Ochoa M, et al. Review of structured light in diffuse optical imaging[J]. Journal of Biomedical Optics, 2018, 24(7): 071602.
[67] Sibai M, Fisher C, Veilleux I, et al. Preclinical evaluation of spatial frequency domain-enabled wide-field quantitative imaging for enhanced glioma resection[J]. Journal of Biomedical Optics, 2017, 22(7): 076007.
[68] Wirth D J, Sibai M, Olson J D, et al. Feasibility of using spatial frequency-domain imaging intraoperatively during tumor resection[J]. Journal of Biomedical Optics, 2018, 24(7): 071608.
[69] Valdes P A, Angelo J, Gioux S. Real-time quantitative fluorescence imaging using a single snapshot optical properties technique for neurosurgical guidance[J]. Proceedings of SPIE, 2015, 9305: 93050J.
[70] Bravo J J, Olson J D, Davis S C, et al. Hyperspectral data processing improves PpIX contrast during fluorescence guided surgery of human brain tumors[J]. Scientific Reports, 2017, 7: 9455.
[71] Jermyn M, Gosselin Y, Valdes P A, et al. Improved sensitivity to fluorescence for cancer detection in wide-field image-guided neurosurgery[J]. Biomedical Optics Express, 2015, 6(12): 5063-5074.
[72] Hoogstins C, Burggraaf J J, Koller M, et al. Setting standards for reporting and quantification in fluorescence-guided surgery[J]. Molecular Imaging and Biology, 2019, 21(1): 11-18.
[73] Kepshire D S, Gibbs-Strauss S L, O’Hara J A, et al. Imaging of glioma tumor with endogenous fluorescence tomography[J]. Journal of Biomedical Optics, 2009, 14(3): 030501.
[74] Gruber J D, Paliwal A, Krishnaswamy V, et al. System development for high frequency ultrasound-guided fluorescence quantification of skin layers[J]. Journal of Biomedical Optics, 2010, 15(2): 026028.
[75] Mehrabi M, Nouizi F, Algarawi M, et al. CCD-based temperature modulated fluorescence tomography[J]. Proceedings of SPIE, 2019, 10874: 108740Y.
[76] Sibai M, Wirth D J, Leblond F, et al. Quantitative subsurface spatial frequency-domain fluorescence imaging for enhanced glioma resection[J]. Journal of Biophotonics, 2019, 12(5): e201800271.
[77] Wirth D J, Sibai M, Wilson B C, et al. First experience with spatial frequency domain imaging and red-light excitation of protoporphyrin IX fluorescence during tumor resection[J]. Biomedical Optics Express, 2020, 11(8): 4306-4315.
[78] Heeman W, Vonk J, Ntziachristos V, et al. A guideline for clinicians performing clinical studies with fluorescence imaging[J]. Journal of Nuclear Medicine, 2022, 63(5): 640-645.
[79] Ma L, Fei B W. Comprehensive review of surgical microscopes: technology development and medical applications[J]. Journal of Biomedical Optics, 2021, 26(1): 010901.
[80] Belykh E, Miller E J, Hu D, et al. Scanning fiber endoscope improves detection of 5-aminolevulinic acid-induced protoporphyrin IX fluorescence at the boundary of infiltrative glioma[J]. World Neurosurgery, 2018, 113: e51-e69.
[81] Belykh E, Jubran J H, George L L, et al. Molecular imaging of glucose metabolism for intraoperative fluorescence guidance during glioma surgery[J]. Molecular Imaging and Biology, 2021, 23(4): 586-596.
[82] Reinert M, Piffaretti D, Wilzbach M, et al. Quantitative modulation of PpIX fluorescence and improved glioma visualization[J]. Frontiers in Surgery, 2019, 6: 41.
[83] Uthoff R D, Song B F, Sunny S, et al. Point-of-care, smartphone-based, dual-modality, dual-view, oral cancer screening device with neural network classification for low-resource communities[J]. PLoS One, 2018, 13(12): e0207493.
[84] Hunt B, Streeter S S, Ruiz A J, et al. Ultracompact fluorescence smartphone attachment using built-in optics for protoporphyrin-IX quantification in skin[J]. Biomedical Optics Express, 2021, 12(11): 6995-7008.
[85] Sujatha N, Murukeshan V M, Ong L S, et al. An all fiber optic system modeling for the gastrointestinal endoscopy: design concepts and fluorescent analysis[J]. Optics Communications, 2003, 219(1/2/3/4/5/6): 71-79.
[86] Thapa P, Singh V, Bhatt S, et al. Development of multimodal micro-endoscopic system with oblique illumination for simultaneous fluorescence imaging and spectroscopy of oral cancer[J]. Journal of Biophotonics, 2022, 15(6): e202100284.
Article Outline
彭念, 李科锐, 邱海霞, 顾瑛, 陈德福. 光敏剂定量检测方法研究进展[J]. 中国激光, 2023, 50(3): 0307201. Nian Peng, Kerui Li, Haixia Qiu, Ying Gu, Defu Chen. Recent Progress in Methods for Quantitative Measurement of Photosensitizer[J]. Chinese Journal of Lasers, 2023, 50(3): 0307201.



 s algorithm
s algorithm s algorithm
s algorithm s algorithm
s algorithm s algorithm
s algorithm




