校正光通量变化的定量光声内窥成像  下载: 711次
下载: 711次
Photoacoustic imaging (PAI) is an emerging imaging modality that provides structural and functional information on biological tissue, with the advantages of high contrast of optical imaging and high penetration depth of ultrasound imaging. Photoacoustic endoscopic imaging is an endoscopic application of PAI, which combines non-invasive PAI with endoscopic detection technology. This imaging modality is physically based on the photoacoustic effect of biological tissue illuminated by short laser pulses. The absorbed optical energy density is proportional to the product of the optical absorption coefficient and the local light fluence. Therefore, light fluence is related not only to the optical properties of the tissue but also to the distribution of irradiation intensity. The optical properties of the tissue cannot be accurately reflected in the distribution image of absorption energy density. By solving the optical inverse problem, the optical property parameters can be estimated quantitatively to realize quantitative imaging. Due to the complex optical properties of tissue and non-uniform and non-stationary illumination, photoacoustic image reconstruction is subject to non-uniform light fluence, which leads to a reduction in image quality and imaging depth. The purpose of this work is to solve the problem of reduced accuracy of quantitative imaging due to light fluence variation.
A quantitative image reconstruction method for photoacoustic endoscopic imaging is presented to correct light fluence variation. It employs a two-step scheme. Firstly, the distribution of absorbed optical energy density on the cross-section of the tubular object is recovered from the photoacoustic signal measured by the ultrasonic detector with conventional image reconstruction methods such as back projection and time reversion. Secondly, the sparse representation of the distribution of absorbed optical energy density is constructed by the weighted sum of a finite number of discrete Curvelet and Haar joint basis functions. The sparse representations of the absorption coefficient and light fluence are then obtained by the greedy algorithm. In addition, the absorption coefficient and light fluence distributions are reconstructed simultaneously by sparse matrix decomposition.
The method has been verified by simulation and phantom studies. The comparisons with the one-step method, model-based method, and state-of-the-art fluence compensation method demonstrate the superiority of the proposed method in recovering optical coefficient distribution with high accuracy. The simulations show that the one-step method has a large error when estimating the absorption coefficient, and the reconstructed image cannot distinguish different tissue types clearly. In the images reconstructed by the Bregman method, significant overlap between different tissue regions can be observed. The images reconstructed by the perturbation Monte Carlo method show the low contrast of tissue boundaries in the low-fluence region. The proposed method is superior to other methods in recovering the absorption coefficient closest to the ground truth. In the phantom study, due to similar optical properties of the two materials used to fabricate the phantom, the overall contrast of the image representing the distribution of absorbed optical energy density is low, and it is difficult to distinguish the contours of the embedded targets. In contrast, images showing the distribution of absorption coefficients can clearly distinguish the contours of the targets. In addition, compared with other methods, the proposed method can achieve the highest accuracy in absorption efficient estimation. Simulation and experimental results on the phantom reveal that the root mean square error (RMSE) of the absorption coefficient estimated with this method can be reduced by about 48%, and the normalized mean square absolute distance (NMSAD) and structural similarity (SSIM) of the reconstructed images can be reduced by about 25% and increased by about 24%, respectively, compared with the one-step method and model-based method. The comparisons with the state-of-the-art fluence compensation method show significant improvements in RMSE, NMSAD, and SSIM metrics by about 22%, 20%, and 10%, respectively.
This work presents a joint reconstruction method of the absorption coefficient and light fluence distribution based on sparse decomposition to construct the distribution of absorbed optical energy density. The method shows advantages over the one-step method based on exact solutions, the model-based method, and the state-of-the-art fluence compensation method in recovering absorption coefficient distribution with high accuracy. Furthermore, the quantitative reconstruction accuracy of the proposed method is not sensitive to the recovery of the absorbed optical energy density and the similarity measurement of sparse decomposition. It should be noted that the optimization algorithm for sparse reconstruction influences the reconstruction accuracy, among which the accuracy of multi-candidate orthogonal matching pursuit (MOMP) and Dice orthogonal matching pursuit (DOMP) is higher than that of matching pursuit (MP) and basis pursuit (BP). Future work should involve the following two aspects. One is to verify the feasibility of this method in clinical transplantation through in vivo experiments. The reconstruction accuracy should be further improved with comprehensive consideration of non-ideal factors in practical application scenarios, such as limited-view sparse-sampling measurement, acoustic reflection and scattering, motion artifacts caused by cardiac motion in intracoronary photoacoustic imaging, and characteristics of ultrasonic detectors. The other is to attempt to apply deep learning to eliminate the influence of light fluence variation on PAI quality.
1 引言
光声成像(PAI)是一种基于光声效应的新型复合功能成像方法[1]。该方法的原理是用短脉冲(ns量级)激光照射组织,组织吸收部分光能量后受热膨胀,激发出宽带(MHz量级)超声波并向组织表面传播,超声换能器接收声压信号后送入计算机,通过求解声学逆问题重建出初始声压分布图或光吸收能量分布图,从而显示出目标的形态结构。其中,常用的方法有反投影[2]、时间反演(TR)[3]、傅里叶变换法(FTR)[4]和反卷积法(DR)[5]等。由于光吸收能量与光吸收系数和局部光通量的乘积成正比,其中光通量不仅与组织的光学特性有关,还与光强分布有关,因此光吸收能量分布图无法准确反映组织的光学特性。通过求解光学逆问题定量估算组织的光学特性参数(如光吸收系数和散射系数)[6]、热膨胀系数(Grüneisen 系数)和功能特性参数(如发色团质量分数和血氧饱和度)等,可实现定量成像,获得组织的功能成分信息[7]。
定量光声成像(qPAI)是一个非线性病态问题,一般采用基于模型的最优化方案求解,即建立前向成像物理模型,并迭代求解使声压测量值或光吸收能量重建值与前向模型输出的理论值之间误差最小的非线性最小二乘问题,在每次迭代中更新待估计参数,直到前向模型的输出与测量数据相匹配[7-11]。实现qPAI的主要困难是光通量未知,为了简化问题,常规方法通常基于理想照明假设和简单光子传输模式,在光源位置固定的情况下,假设入射光在组织表面和内部形成均匀光照。该假设对于较小的成像目标具有一定的合理性,但对于具有复杂结构的大型目标而言,不合理的照明模式会造成光照不均匀,只有靠近和面向入射光的部分组织可被相对均匀地照射。此外,大部分生物组织都是高散射且不透明的混浊介质,组织结构与成分具有高度复杂性和差异性,不同组织成分对光的吸收和散射存在明显差异,也会导致光通量分布不均匀。同时,随着入射光在组织中传播深度的增加,光的穿透能力在减弱,光能量趋于分散,在不同位置处的光通量呈现不同的衰减趋势。上述原因会导致图像质量和成像深度的下降,在低光通量区域中会出现目标模糊和精度降低等问题。
目前解决非均匀光照问题的方法主要包括优化照明设备、校正光通量变化和估计光通量三种方案[12]。优化照明设备的目的是保证成像目标内各个视角上具有足够的光穿透性,如旋转照明[13]、定制多模光纤照明[14]、光捕捉器[15]和光纤扩散器[16]等,均需改变成像系统。在图像重建过程中对光通量变化进行校正可提高成像精度,如:Rosenthal等[17]将图像分解为低空间频率全局分量和高空间频率局域分量,再通过少量基函数的和逼近图像;Bu等[18]将基于模型的光吸收系数重建与光通量补偿相结合,减少因光通量变化所致的重建误差;Nykänen等[19]采用基于模型的方法利用初始声压和表面光测量数据同时估计光吸收系数、散射系数和Grüneisen系数,但无法确定最小化问题是否具有唯一最优解。对于光声光谱成像,Deán-Ben等[20]利用可逆光开关荧光蛋白的波长开关特性校正散射介质内光通量分布的不均匀性,而Zhou等[21]验证了三种基于模型的光通量校正方法的有效性,即基于一维扩散近似模型、基于扩散偶极子模型和基于蒙特卡罗(MC)模拟的方法。此外,将PAI与其他成像模态相结合,可实现对光通量的估计或测量,如光声-声光(AO)测量[22-23]、光声-超声成像[24]、光声-被动超声成像[25]和光声-扩散光层析成像(DOT)[26]等。双模态成像方法增加了系统及其操作的复杂度,故其应用范围受限。
光声内窥成像将无创的PAI和内窥检测技术相结合,可用于腔体病变(如消化道病变和冠状动脉粥样硬化等)的早期诊断。提出了一种定量光声内窥成像方法,该方法不依赖于前向光传输模型,而是将Curvelet和Haar联合基与傅里叶基作为基函数,对光吸收能量分布进行稀疏表示,通过矩阵分解实现腔体横截面上光吸收系数和光通量分布图的联合重建,从而校正光通量变化对定量重建精度的影响。
2 原理与方法
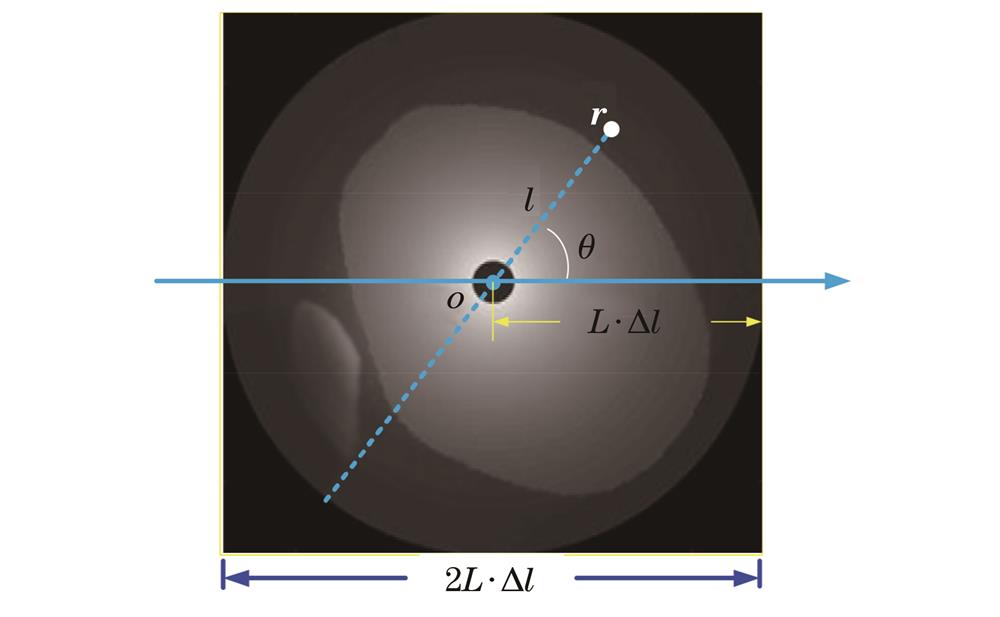
如
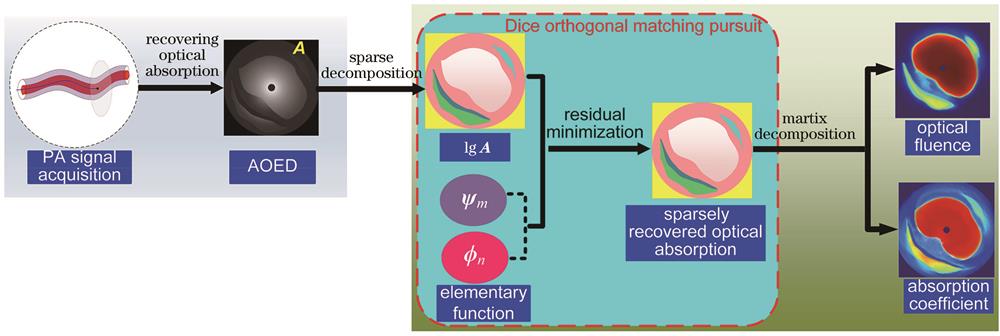
图 1. 联合重建光吸收系数和光通量分布图的流程
Fig. 1. Process for simultaneously reconstructing optical absorption coefficient and optical fluence distribution
在PAI中,光吸收能量、光吸收系数和光通量之间的关系为
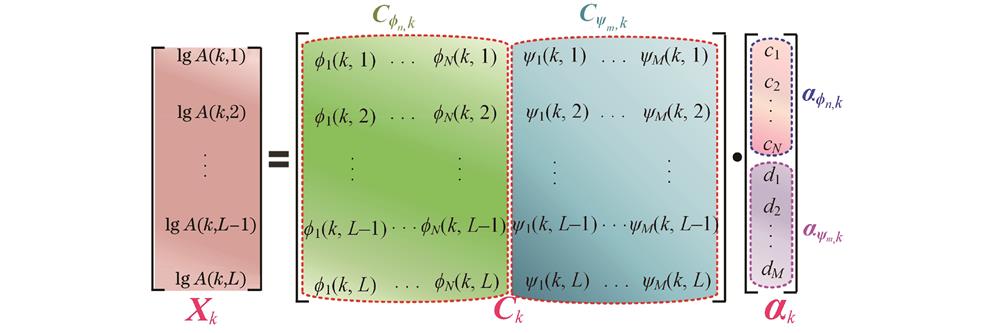
式中:
式中:
基函数需满足稀疏条件,即每个基函数只能单一地表示
式中:
DOMP算法的原理是:在每一次迭代中,根据Dice系数匹配准则求解Dice值最大的一个元素,并加入到稀疏矩阵中,更新残差判定重构结果,达到精度要求或允许的迭代次数时停止迭代。求解
第一步,初始化迭代次数i=1,设置初始稀疏矩阵
残差
第二步,计算第i次迭代后的稀疏矩阵。根据Dice系数匹配准则在基函数矩阵库中搜索与残差相似程度最大的库函数作为最匹配的库函数,即
式中:
式中: xi和yi分别为向量
式中:
第三步,计算第i次迭代后的稀疏分解系数矩阵
式中:
第四步,计算第i次迭代后的残差
第五步,判断迭代是否终止。如果第i次迭代后的误差满足
按照上述步骤求解出稀疏矩阵和稀疏分解系数矩阵,进而得到光吸收系数和光通量对数的向量表示
式中:
3 结果及分析
由于进行生物组织在体实验测量时,无法获知组织光学特性参数的真实值,因此本文分别采用计算机仿真模型和体模成像数据验证所提方法的可行性并评估其性能。实验中的编程环境是MATLAB R2018a,所用计算机的CPU型号为Intel® CoreTM i7-5500,其主频为2.40 GHz、内存为4 GB,所用计算机的操作系统为Windows 10 64位操作系统。
3.1 仿真实验结果
分别构建了简单点阵仿真模型和包含不同组织成分的冠状动脉血管仿真模型,如
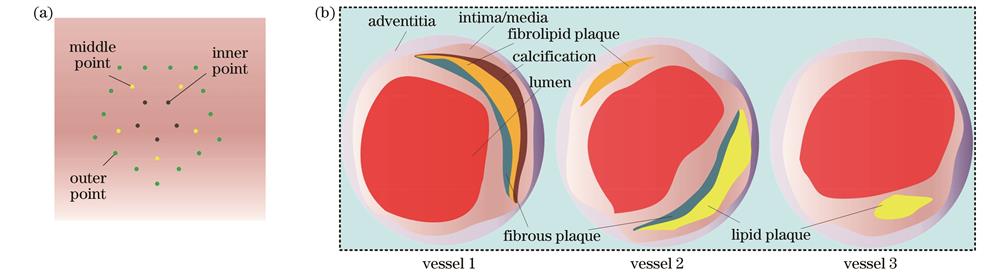
图 4. 仿真点阵模型和仿真血管模型的几何结构。(a)仿真点阵模型;(b)仿真血管模型
Fig. 4. Geometry of simulated grid model and simulated vascular model. (a) Simulated grid model; (b) simulated vascular model
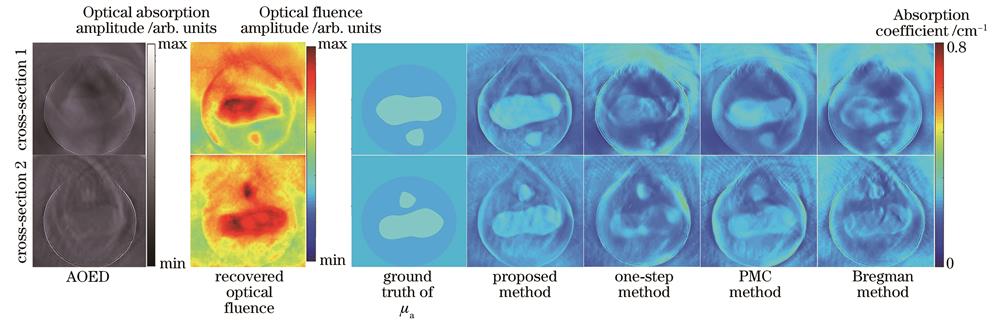
分别采用所提方法、文献[6]中的方法、文献[9]中的方法和文献[11]中的方法对仿真模型进行光吸收系数图像重建,结果如
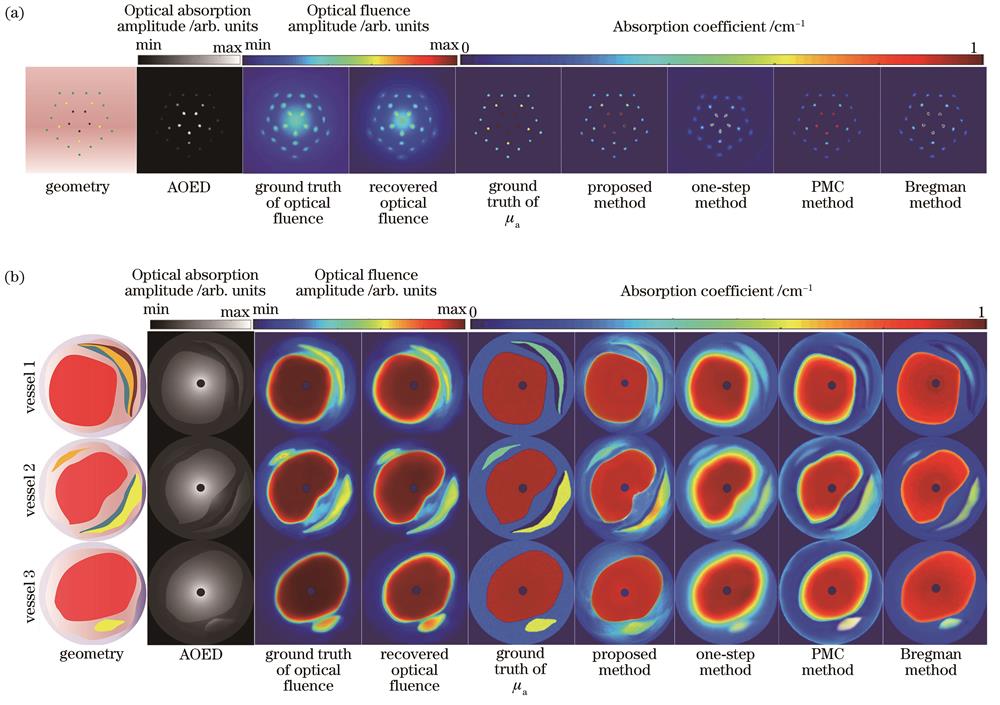
图 5. 仿真模型的图像结果。(a)点阵模型;(b)血管模型
Fig. 5. Image results of simulation models. (a) Grid model; (b) vascular model
除视觉评估以外,本文采用均方根误差(RMSE)、归一化平均绝对距离(NMSAD)和结构相似度(SSIM)作为量化指标,来客观评价光吸收系数估算精度和重建图像质量。RMSE是衡量估计值与真实值之间偏差的量化指标,定义为
式中:W和H分别为图像的宽度和高度(单位为pixel);
式中:
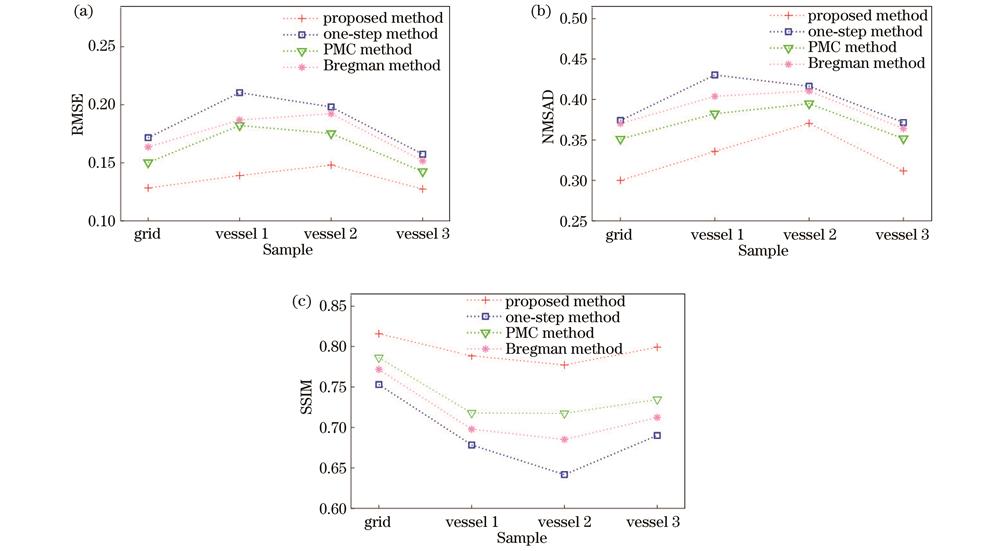
图 6. 仿真模型的光吸收系数估算精度和重建图像定量评价指标。(a) RMSE;(b) NMSAD;(c) SSIM
Fig. 6. Quantitative evaluation metrics for estimation accuracy of optical absorption coefficient and reconstructed images of simulation models. (a) RMSE; (b) NMSAD; (c) SSIM
3.2 体模实验结果
采用3D打印技术制作实体模型(简称体模),如
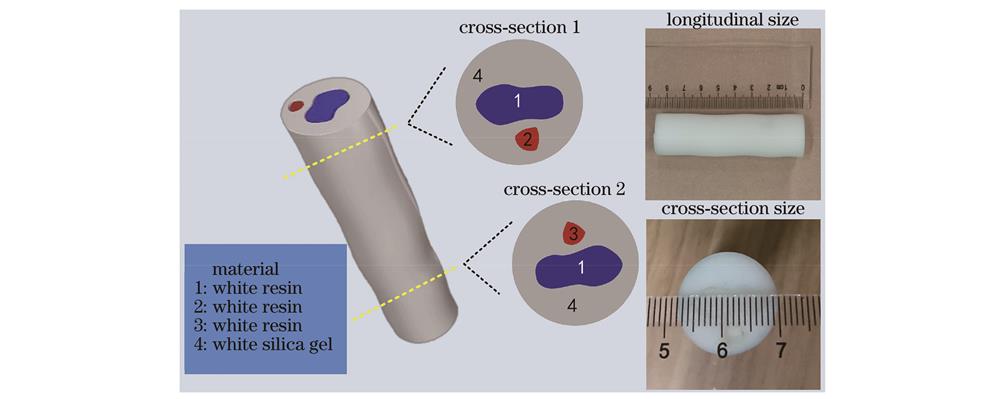
图 7. 体模几何结构示意图和实物照片
Fig. 7. Schematic diagram and photo of geometric structure of actual model
利用MSOT inVision 256多光谱光声断层扫描成像系统(iThera Medical GmbH)采集体模的光声数据。该系统由Nd∶YAG近红外激光器泵浦的可调谐光学参量振荡器组成,入射光波长是680~900 nm,重复频率是10 Hz,激光脉冲持续时间是7 ns,最大脉冲能量是120 mJ,激光切换速度是100 ms。采用270°弧形阵列式超声探测装置,共包含256个换能器阵元,探测器中心频率是5 MHz,带宽为60%。
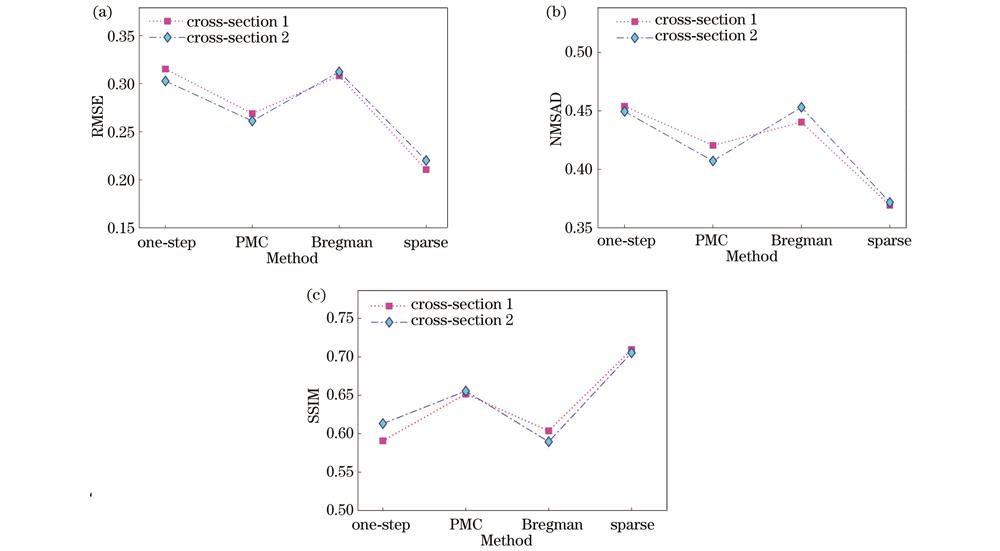
图 9. 体模光吸收系数估算精度和重建图像定量评价指标。(a) RMSE;(b) NMSAD;(c) SSIM
Fig. 9. Quantitative evaluation metrics for estimation accuracy of optical absorption coefficient and reconstructed images of actual model. (a) RMSE; (b) NMSAD; (c) SSIM
4 讨论
本章结合仿真血管模型图像重建结果和定量评价指标,讨论稀疏重构中的相似度测量方法、优化算法和光吸收能量重建方法对光吸收系数重建精度和图像质量的影响,并与其他联合重建方法进行对比。
4.1 影响重建精度的主要因素
4.1.1 相似度测量方法
DOMP是一种根据Dice系数匹配准则计算相似度的贪婪算法。为了讨论所提方法对稀疏重构相似度测量的依赖关系,本节分别采用Dice准则、内积法(IP)[29]、Jaccard系数法[40]和余弦相似法(COS法)[41]求解向量相似性,其余条件不变,重建的光吸收系数分布图和评价指标分别如
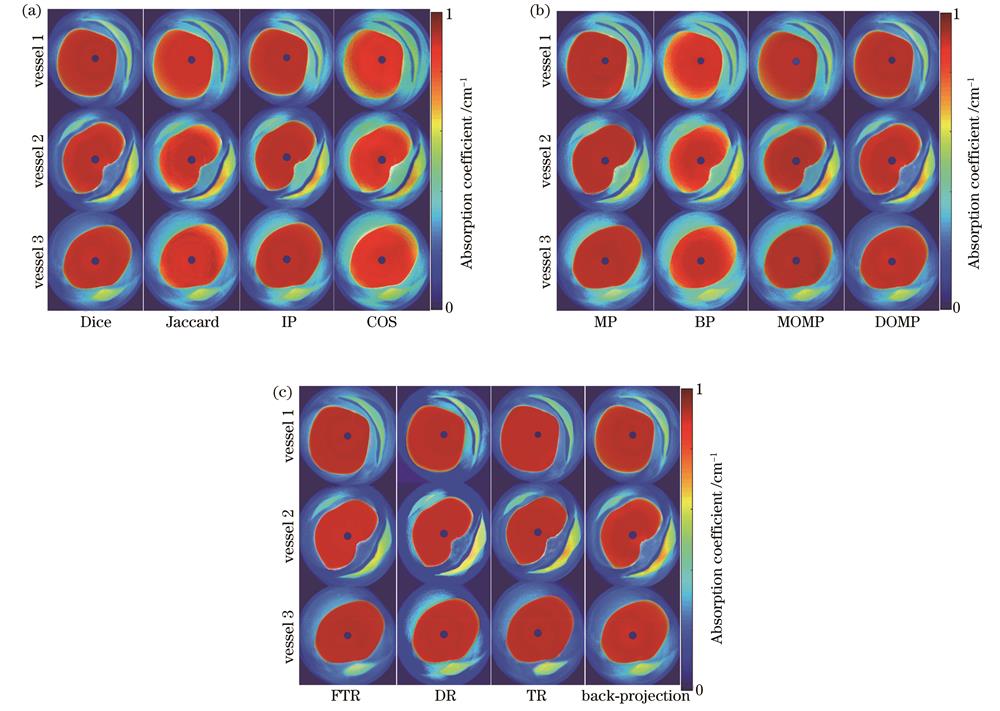
图 10. 采用不同相似度测量法、优化算法和AOED重建方法时重建的光吸收系数分布图。(a)不同相似度测量法得到的结果;(b)不同优化算法得到的结果;(c)不同AOED重建方法得到的结果
Fig. 10. Optical absorption coefficient diagrams reconstructed by different similarity measurement methods, optimization algorithms and AOED recovery methods. (a) Results obtained by different similarity measurement methods; (b) results obtained by different optimization algorithms; (c) results obtained by different AOED recovery methods
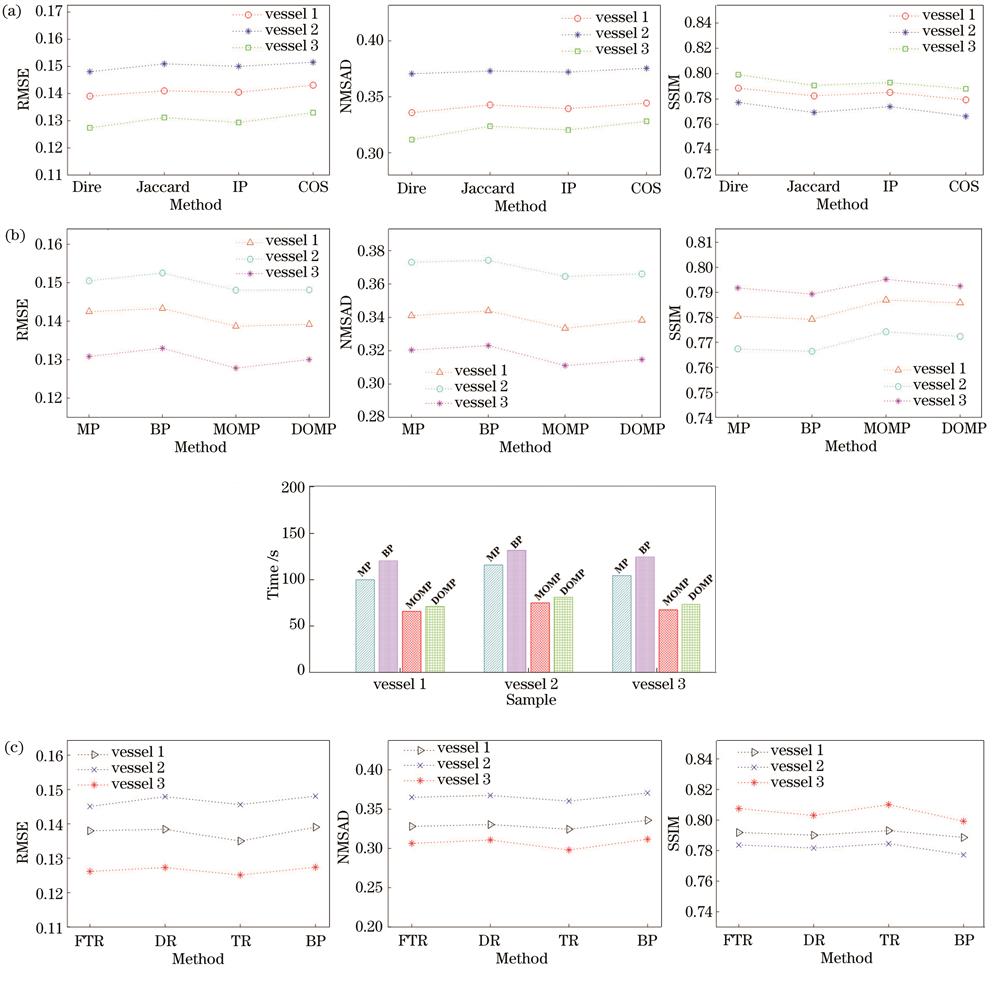
图 11. 采用不同相似度测量法、优化算法和AOED重建方法时重建的光吸收系数分布图的定量评价指标。(a)相似度测量法;(b)优化算法;(c) AOED重建方法
Fig. 11. Quantitative evaluation metrics of optical absorption coefficient diagrams reconstructed by different similarity measurement methods, optimization algorithms and AOED recovery methods. (a) Similarity measurement methods; (b) optimization algorithms; (c) AOED recovery methods
4.1.2 优化算法
分别采用BP[31]、MP[32]、MOMP[33]和DOMP[34]算法求解
4.1.3 光吸收能量重建方法
如第2章所述,所提方法是基于两步策略的,故本节讨论光吸收能量分布图的重建质量对光吸收系数重建精度的影响。分别采用反投影[2]、TR[3]、FTR[4]和DR[5]根据光声信号重建光吸收能量分布图,其余条件不变,最终得到的光吸收系数分布图和定量评价指标如
4.2 与其他联合重建方法对比
比较所提方法和Rosenthal方法[17]重建光吸收系数的精度,结果如
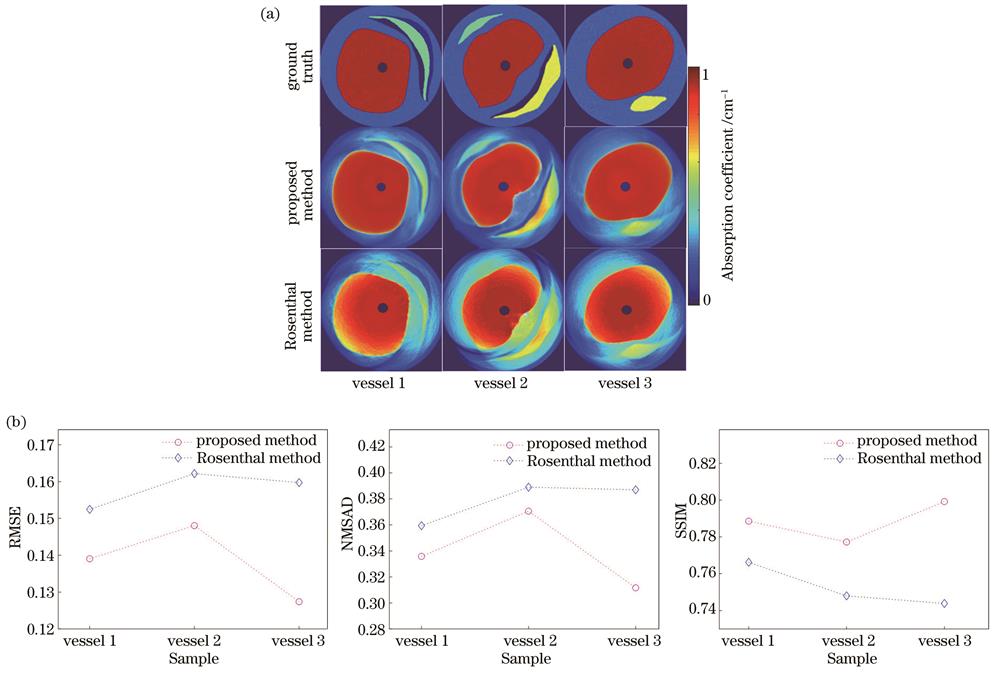
图 12. 采用不同联合重建方法得到的血管模型的光吸收系数分布图和评价指标。(a)重建图像;(b)评价指标
Fig. 12. Optical absorption coefficient diagrams and evaluation metrics of vascular model obtained by different joint reconstruction methods. (a) Reconstructed images; (b) evaluation metrics
4.3 所提方法相对于其他定量成像方案的优势和不足
目前qPAI的主流方案是基于模型的方法,其本质是迭代求解前向问题,即通过使前向成像模型计算的光吸收能量理论值与根据光声信号重建的光吸收能量测量值之间的误差最小化来获得对未知量的最佳估计。所提方案的重建精度取决于前向模型对成像过程描述的准确性,其主要困难是建立用简单方程表示的前向模型来描述光在非均匀散射介质中的传输、热膨胀产生的声压、宽带超声波在声学特性非均匀组织中的传播和超声换能器对光声信号的测量过程。为了使模型更全面、更准确地描述实际成像场景,提高重建精度,应综合考虑各种不理想因素,如非稳定/非均匀的光覆盖、组织随空间变化的声速和密度、超声波在不同类型组织界面处的反射和散射,以及探测器的有限孔径效应、有限带宽效应和有限角度稀疏采样等。由于在迭代过程中需要反复计算前向算子及其伴随算子,故定量成像的计算复杂度取决于前向模型描述成像过程的全面程度,在实际应用中必须在时间成本和重建精度之间进行权衡。为了提高重建效率,通常需要对成像场景进行一些理想化的假设,如组织光学特性分段恒定、背景光学特性均匀分布、光散射系数和Grüneisen系数已知,以及组织中的声速恒定等。然而,在现实应用场景中这些假设多数都不成立,故定量成像精度会下降。
与基于模型的方案不同,所提方法通过对AOED进行稀疏分解估算光吸收系数,可以避免在反复求解前向模型过程中引入的误差,无需依赖前向模型即可实现组织光吸收系数的定量估计,估算结果对成像场景、测量几何和造成光通量不均匀的原因不敏感,且方法的实施不仅限于内窥式的应用中。不足之处在于,所提方法采用两步策略,即先根据探测器采集的光声信号重建光吸收能量分布图(结构成像),再在此基础上估算光吸收系数,从而实现定量成像。两步策略的共同缺点是:光吸收能量的重建误差会累积到光吸收系数的估算结果中,从而间接影响估算精度。特别是,在光声显微[43]和光声断层成像中,由于激光需要穿过皮肤甚至颅骨,因此组织对于光的传播特性影响更大,这种影响会直接体现在光吸收能量分布图的重建中。在体模实验中,利用光声断层扫描成像系统从外部扫描体模,并根据系统输出的光吸收能量分布图估算光吸收系数。
近年来,随着深度学习技术在医学成像领域中应用的日益广泛,基于深度学习的PAI技术也取得了突破性进展[44]。与解析法和迭代法不同,深度学习以数据驱动的方式实现图像重建,利用大量样本数据对复杂成像模型的参数进行监督或无监督学习,实现对多物理场耦合成像过程的建模,在实现快速、高质量图像重建方面展现出了巨大的潜力[45]。在过去4年中,深度学习在qPAI领域中也表现出了优越的性能,如:采用深度神经网络根据不同波长入射光照射下获得的初始声压或光吸收能量数据估计发色团的质量浓度或血氧饱和度[46];采用双路径卷积神经网络在没有标记实验数据的情况下重建深层组织的光吸收系数图像[47]。这些方法在理想的计算机模拟环境或特定数据集中均取得了良好的效果,但关于入射激光、探头设计、校准参数或散射特性的理想假设可能会限制它们在常规PAI中的实际应用,其有效性还需要通过在体动物或临床试验来进一步证明。
5 结论
设计了一种基于光吸收能量稀疏分解的光吸收系数与光通量分布图联合重建方法,用有限数量的基函数之和构造光吸收能量分布的稀疏表达式,并通过稀疏矩阵分解得到光吸收系数和光通量的稀疏表示,从而实现二者的联合重建。仿真和体模实验结果表明,采用所提方法重建的光吸收系数分布图的视觉效果和评价指标均优于基于精确解的一步法、基于模型的方法和Rosenthal方法。讨论结果表明,所提方法的定量重建精度对光吸收能量重建值和稀疏分解相似度测量方法不敏感,即其具有较好的稳定性。稀疏重构优化算法对重建精度有一定的影响,其中MOMP和DOMP相对于MP和BP的精度更高。
在未来的工作中,将通过动物在体实验验证所提方法的临床可移植性,并综合考虑实际应用场景中的多种不理想因素,如有限角度稀疏采样测量、组织非均匀声学特性所致的声反射和散射、成像目标的运动状态(如冠状动脉内PAI中由心脏运动所致的伪影)和超声探测器的非理想特性等,进一步提高重建精度。此外,深度学习等人工智能技术在PAI领域中的应用日益广泛,也为解决光照不均匀问题提供了一种新思路。
[1] 李娇, 李帅, 陈冀景, 等. 非接触光声成像研究进展及其在生物医学上的应用[J]. 中国激光, 2021, 48(19): 1907001.
Li J, Li S, Chen J J, et al. Progress and biomedical application of non-contact photoacoustic imaging[J]. Chinese Journal of Lasers, 2021, 48(19): 1907001.
[2] Xu M H, Wang L V. Universal back-projection algorithm for photoacoustic computed tomography[J]. Physical Review E, 2005, 71(1): 016706.
[3] Sun Z, Han D D, Yuan Y. 2-D image reconstruction of photoacoustic endoscopic imaging based on time-reversal[J]. Computers in Biology and Medicine, 2016, 76: 60-68.
[4] Wang K, Anastasio M A. A simple Fourier transform-based reconstruction formula for photoacoustic computed tomography with a circular or spherical measurement geometry[J]. Physics in Medicine and Biology, 2012, 57(23): N493-N499.
[5] Zhang C, Wang Y Y. Deconvolution reconstruction of full-view and limited-view photoacoustic tomography: a simulation study[J]. Journal of the Optical Society of America A, 2008, 25(10): 2436-2443.
[6] Wang Y, Wang R K. Photoacoustic recovery of an absolute optical absorption coefficient with an exact solution of a wave equation[J]. Physics in Medicine and Biology, 2008, 53(21): 6167-6177.
[7] Cox B T, Laufer J G, Arridge S R, et al. Quantitative spectroscopic photoacoustic imaging: a review[J]. Journal of Biomedical Optics, 2012, 17(6): 061202.
[8] Mohajerani P, Tzoumas S, Rosenthal A, et al. Optical and optoacoustic model-based tomography: theory and current challenges for deep tissue imaging of optical contrast[J]. IEEE Signal Processing Magazine, 2015, 32(1): 88-100.
[9] Zheng S, Lan Z. Reconstruction of optical absorption coefficient distribution in intravascular photoacoustic imaging[J]. Computers in Biology and Medicine, 2018, 97: 37-49.
[10] Javaherian A, Holman S. Direct quantitative photoacoustic tomography for realistic acoustic media[J]. Inverse Problems, 2019, 35(8): 084004.
[11] Leino A A, Lunttila T, Mozumder M, et al. Perturbation Monte Carlo method for quantitative photoacoustic tomography[J]. IEEE Transactions on Medical Imaging, 2020, 39(10): 2985-2995.
[12] 孟琪, 孙正. 生物光声层析成像中不均匀和不稳定照明解决方法[J]. 中国光学, 2021, 14(2): 307-319.
[13] Lou Y, Wang K, Oraevsky A A, et al. Impact of nonstationary optical illumination on image reconstruction in optoacoustic tomography[J]. Journal of the Optical Society of America A, 2016, 33(12): 2333-2347.
[14] Mc Larney B, Rebling J, Chen Z Y, et al. Uniform light delivery in volumetric optoacoustic tomography[J]. Journal of Biophotonics, 2019, 12(6): e201800387.
[15] Yu J, Schuman J S, Lee J K, et al. A light illumination enhancement device for photoacoustic imaging: in vivo animal study[J]. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2017, 64(8): 1205-1211.
[16] Li M C, Lan B X, Liu W, et al. Internal-illumination photoacoustic computed tomography[J]. Journal of Biomedical Optics, 2018, 23(3): 030506.
[17] Rosenthal A, Razansky D, Ntziachristos V. Quantitative optoacoustic signal extraction using sparse signal representation[J]. IEEE Transactions on Medical Imaging, 2009, 28(12): 1997-2006.
[18] Bu S H, Liu Z B, Shiina T, et al. Model-based reconstruction integrated with fluence compensation for photoacoustic tomography[J]. IEEE Transactions on Biomedical Engineering, 2012, 59(5): 1354-1363.
[19] Nykänen O, Pulkkinen A, Tarvainen T. Quantitative photoacoustic tomography augmented with surface light measurements[J]. Biomedical Optics Express, 2017, 8(10): 4380-4395.
[20] Deán-Ben X L, Stiel A C, Jiang Y Y, et al. Light fluence normalization in turbid tissues via temporally unmixed multispectral optoacoustic tomography[J]. Optics Letters, 2015, 40(20): 4691-4694.
[21] Zhou X W, Akhlaghi N, Wear K A, et al. Evaluation of fluence correction algorithms in multispectral photoacoustic imaging[J]. Photoacoustics, 2020, 19: 100181.
[22] Hussain A, Petersen W, Staley J, et al. Quantitative blood oxygen saturation imaging using combined photoacoustics and acousto-optics[J]. Optics Letters, 2016, 41(8): 1720-1723.
[23] Daoudi K, Hussain A, Hondebrink E, et al. Correcting photoacoustic signals for fluence variations using acousto-optic modulation[J]. Optics Express, 2012, 20(13): 14117-14129.
[25] Jin H R, Zhang R C, Liu S Y, et al. A single sensor dual-modality photoacoustic fusion imaging for compensation of light fluence variation[J]. IEEE Transactions on Biomedical Engineering, 2019, 66(6): 1810-1813.
[26] Bauer A Q, Nothdurft R E, Culver J P, et al. Quantitative photoacoustic imaging: correcting for heterogeneous light fluence distributions using diffuse optical tomography[J]. Journal of Biomedical Optics, 2011, 16(9): 096016.
[27] Candès E J, Demanet L. The curvelet representation of wave propagators is optimally sparse[J]. Communications on Pure and Applied Mathematics, 2005, 58(11): 1472-1528.
[28] Grohs P, Keiper S, Kutyniok G, et al. Cartoon approximation with α‑curvelets[J]. Journal of Fourier Analysis and Applications, 2016, 22(6): 1235-1293.
[29] Zwartjes P M, Gisolf A. Fourier reconstruction with sparse inversion[J]. Geophysical Prospecting, 2007, 55(2): 199-221.
[30] 田金鹏, 刘小娟, 刘燕平, 等. 多候选集广义正交匹配追踪算法[J]. 应用科学学报, 2017, 35(2): 233-243.
Tian J P, Liu X J, Liu Y P, et al. Multi-candidate set of generalized orthogonal matching pursuit algorithm[J]. Journal of Applied Sciences, 2017, 35(2): 233-243.
[31] 张繁昌, 李传辉. 非平稳地震信号匹配追踪时频分析[J]. 物探与化探, 2011, 35(4): 546-552.
Zhang F C, Li C H. Matching pursuit time-frequency analysis of non-stationary seismic signals[J]. Geophysical and Geochemical Exploration, 2011, 35(4): 546-552.
[32] Huang S S, Zhu J B. Recovery of sparse signals using OMP and its variants: convergence analysis based on RIP[J]. Inverse Problems, 2011, 27(3): 035003.
[33] Tsaig Y, Donoho D L. Extensions of compressed sensing[J]. Signal Processing, 2006, 86(3): 549-571.
[34] HuangJ J, XuY H, ZhuP, et al. An improved reconstruction algorithm based on multi-candidate orthogonal matching pursuit algorithm[C]//2014 Seventh International Symposium on Computational Intelligence and Design, December 13-14, 2014, Hangzhou, China. New York: IEEE Press, 2014: 564-568.
[35] 陈荣, 谢树森, 陈艳娇, 等. 中国人血液的组织光学参数[J]. 光电子·激光, 2002, 13(1): 92-93, 97.
Chen R, Xie S S, Chen Y J, et al. Optical parameters of Chinese blood[J]. Journal of Optoelectronics·Laser, 2002, 13(1): 92-93, 97.
[36] Jacques S L. Optical properties of biological tissues: a review[J]. Physics in Medicine and Biology, 2013, 58(11): R37-R61.
[37] 高上凯. 医学成像系统[M]. 2版. 北京: 清华大学出版社, 2010: 88-95.
GaoS K. Medical imaging system[M]. 2nd ed. Beijing: Tsinghua University Press, 2010: 88-95.
[38] Treeby B E, Cox B T. k-Wave: MATLAB toolbox for the simulation and reconstruction of photoacoustic wave fields[J]. Journal of Biomedical Optics, 2010, 15(2): 021314.
[39] 庄天戈. CT原理与算法[M]. 上海: 上海交通大学出版社, 1992: 11-12.
ZhuangT G. Principle and algorithm of CT[M]. Shanghai: Shanghai Jiao Tong University Press, 1992: 11-12.
[40] JanaC, KaraaslanF. Dice and Jaccard similarity measures based on expected intervals of trapezoidal neutrosophic fuzzy numbers and their applications in multicriteria decision making[M]//Smarandache F, Abdel-Basset M. Optimization theory based on Neutrosophic and Plithogenic sets. Amsterdam: Elsevier, 2020: 261-287.
[41] Ye J. Cosine similarity measures for intuitionistic fuzzy sets and their applications[J]. Mathematical and Computer Modelling, 2011, 53(1/2): 91-97.
[42] 隆刚, 肖磊, 陈学佺. Curvelet变换在图像处理中的应用综述[J]. 计算机研究与发展, 2005, 42(8): 1331-1337.
Long G, Xiao L, Chen X Q. Overview of the applications of curvelet transform in image processing[J]. Journal of Computer Research and Development, 2005, 42(8): 1331-1337.
[43] 何勇, 廖唐云, 吴俊伟, 等. 基于透明超声换能器的光声显微镜设计[J]. 中国激光, 2022, 49(3): 0307001.
[44] Yang C C, Lan H R, Gao F, et al. Review of deep learning for photoacoustic imaging[J]. Photoacoustics, 2021, 21: 100215.
[45] 沈康, 刘松德, 施钧辉, 等. 基于双域神经网络的稀疏视角光声图像重建[J]. 中国激光, 2022, 49(5): 0507208.
[46] YangC C, LanH R, ZhongH T, et al. Quantitative photoacoustic blood oxygenation imaging using deep residual and recurrent neural network[C]//2019 IEEE 16th International Symposium on Biomedical Imaging, April 8-11, 2019, Venice, Italy. New York: IEEE Press, 2019: 741-744.
[47] Li J, Wang C, Chen T T, et al. Deep learning-based quantitative optoacoustic tomography of deep tissues in the absence of labeled experimental data[J]. Optica, 2022, 9(1): 32-41.
Article Outline
孟琪, 孙正, 侯英飒, 孙美晨. 校正光通量变化的定量光声内窥成像[J]. 光学学报, 2023, 43(1): 0111001. Qi Meng, Zheng Sun, Yingsa Hou, Meichen Sun. Quantitative Photoacoustic Endoscopic Imaging for Correcting Light Fluence Variation[J]. Acta Optica Sinica, 2023, 43(1): 0111001.