内窥光学相干层析成像的研究进展与应用
Optical coherence tomography (OCT) is a label-free optical imaging technique based on the principle of low-coherence interference, which has the advantages of high resolution and fast imaging speed. OCT can image tissue anatomy and microcirculation without physiological sections and exogenous contrast agents. However, the OCT penetration depth is limited to 2?3 mm owing to the optical scattering of biological tissue. Therefore, most OCT applications focus on ocular imaging and endoscopy. OCT has led to a better understanding of ocular structures and has provided efficient treatment of glaucoma, maculopathy, and other ocular diseases. Endoscopy is another important field of OCT application. Combining OCT imaging with an endoscopic micro-probe, endoscopic OCT can obtain three-dimensional morphological microstructures of in vivo internal organs with depth-resolved information and micron-scale resolution, which is advantageous in detecting small lesions under the surface of tissue. With an optical fiber and a miniaturized lens, an endoscopic OCT probe can be inserted into the body through the working channel of a conventional video endoscope. By overcoming the low resolution of ultrasound imaging and the shallow penetration depth of confocal imaging, endoscopic OCT has become an indispensable imaging tool in clinical diagnosis.
First, we summarize the development of endoscopic OCT over recent years. Although ophthalmic OCT still predominates, the research and application of endoscopic OCT techniques are increasing (Fig.1). Three types of OCT systems are described: time-domain OCT, spectral-domain OCT, and swept-source OCT (Fig.2). In contrast to time-domain OCT systems with the mechanical scanning structure in the reference optical path, frequency-domain OCT systems, including spectral-domain OCT and swept-source OCT, record the interference signals as functions of wavelength. The depth information of the sample can be obtained by the Fourier transform of the interference signals at different wavelengths. Frequency-domain OCT improves imaging acquisition speed. Then, various probes are presented, such as the anterior and side-view imaging probes (Figs.2 and 3). An anterior imaging probe with the beam along the optical axis is suitable for guiding surgical procedures. A side-view imaging probe is easily minimalized and is capable of imaging tissue with small inner diameters, such as blood vessels.
Second, the various techniques of endoscopic OCT are summarized, including ultrahigh-resolution OCT and dual-modality imaging. Imaging of porcine coronary arteries with ultrahigh-resolution OCT can detect lesions in the endothelial cell layer, providing a new option for the early diagnosis of coronary atherosclerosis (Fig.5). The alveolar structure in human lung tissue can be observed clearly using ultrahigh-resolution OCT imaging (Fig.6). Ultrahigh-resolution OCT may have more applications in clinical practices if the cost can be deduced. Multimodality imaging has become a popular research area in recent years, which can acquire multiple images simultaneously and overcome the limitations of OCT, providing precision clinical diagnosis. Dual-modality imaging combining OCT with fluorescence imaging compensates for the lack of molecular sensitivity in OCT and provides more detailed information about the tissue (Fig.7). Dual-modality imaging with OCT and ultrasound combines the advantages of the high resolution of OCT and the deep penetration of ultrasound imaging to acquire two types of structural information simultaneously (Fig.8).
Third, we introduce commercialized endoscopic OCT and compare the performance. Many endoscopic OCT devices have emerged over recent years (Table 2). From the clinical applications of endoscopic OCT technology, we review the current advances in cardiology, respirology, gastroenterology, urology, and gynecology. In cardiology, OCT applications for atherosclerosis assessment (Fig.9) and postoperative evaluation of stent implantation procedures have been introduced (Fig.10). In respirology, OCT endoscopy technology has increasing applications in the early diagnosis of lung cancer, chronic bronchial inflammation, bronchial asthma (Fig.12), etc. In gastroenterology, OCT endoscopy can diagnose Barrett’s esophagus lesions early with the risk of esophageal adenocarcinoma (Fig.13). Although endoscopy imaging is challenging for intestinal tissue owing to the large size of the stomach and the long length of the small intestine, endoscopic OCT has promising applications in areas such as intestinal damage diagnosis (Fig. 14) and small intestine allografts (Fig.15). In addition, endoscopic OCT has been used for cancer screening of various tissues, such as the biliopancreatic duct, cervix, and ureter, providing an accurate diagnosis of neoplastic lesions (Fig.17). In gynecology, endoscopic OCT technology offers new ideas for diagnosing gynecological diseases and monitoring of vaginal health status (Fig. 18).
Endoscopic OCT technology has progressed from time-domain OCT to frequency-domain OCT in the past few decades and has become an essential diagnostic tool in addition to traditional endoscopic imaging methods. However, endoscopic OCT technology still requires continuous improvement, including the enhancement of imaging quality, the miniaturization of probes, the extension of imaging depth, the improvement of spatial resolution, reduction in manufacturing costs, and combination with other imaging modalities. With an improvement in performance, endoscopic OCT technology will provide a more significant imaging basis for precision medicine.
1 引言
光学相干层析成像(OCT)技术利用低相干干涉原理,将参考光与来自样品的散射光进行干涉,实现光学散射介质的无标记、高分辨三维成像。自1991年Huang等[1]首次提出OCT的概念以来,OCT技术在过去30多年内发展迅速,并在冠状动脉斑块诊断、人眼视网膜疾病诊断等领域获得了广泛应用[2-5]。
目前,常用的医学成像技术包括磁共振成像[6]、计算机断层扫描成像[7]、超声成像[8]、光声成像[9]、荧光成像[10]、OCT技术[1]等。这些成像方式在不同的临床领域都具有其自身的独特优势,但也都有着各自的不足。例如:荧光成像技术需要对样品进行荧光标记,而且在大多数组织中的成像深度仅为几百微米,因此通常需要对组织进行切片处理;超声成像可以实现深层组织成像,但分辨率约为100 μm,难以满足高分辨成像需求;OCT技术具有约10 μm的分辨率以及1~3 mm的成像深度,不需要引入外源造影剂,也不需要制作组织切片,因此其应用越来越广泛[11]。
在OCT技术诞生之初,研究人员主要将其应用于离体器官和浅表组织的成像。OCT技术的进步以及临床上对高分辨在体成像的迫切需求,促进了OCT内窥技术的发展。1995年,Fujimoto等[12]提出了OCT“光学活检”技术,并使用OCT内窥镜对非切除的组织形态进行了评估。1996年,Tearney等[13]首次发展了OCT扫描导管内窥镜。
自此以后,内窥OCT技术飞速发展。由
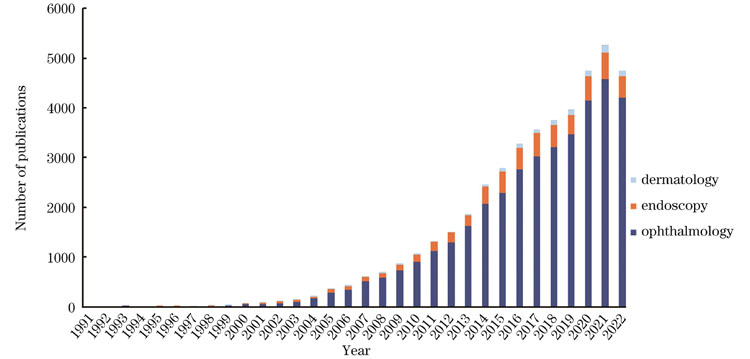
图 1. 1991—2022年,眼科、内窥和皮肤OCT研究的出版文献数量(数据来源于PubMed)
Fig. 1. The number of publications on OCT studies in ophthalmology, endoscopy, and dermatology in 1991‒2022 (data from PubMed)
2 OCT系统类型
2.1 时域OCT系统
第一代OCT又被称为时域OCT(TD-OCT),该系统通过参考臂机械扫描改变参考光路的光程,从而实现不同深度的成像。
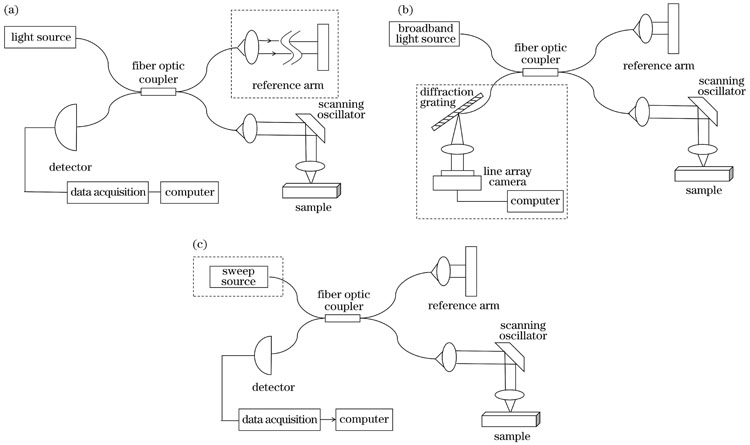
图 2. OCT系统原理图。(a)时域OCT系统原理图;(b)谱域OCT系统原理图;(c)扫频OCT系统原理图
Fig. 2. OCT system schematics. (a) Schematic of a time-domain OCT system; (b) schematic of a spectral domain OCT system; (c) schematic of a swept-source OCT system
2.2 频域OCT系统
1995年,Fercher等[14]提出了一种全新的成像方式:频域OCT系统(FD-OCT),它去除了时域OCT中参考光路的机械扫描结构,通过对不同波长的干涉光信号进行傅里叶变换来获取样品的深度信息。频域OCT又可细分为谱域OCT(SD-OCT)和扫频OCT(SS-OCT)两大类。
谱域OCT系统的光源为宽带光源,采用线阵探测器进行干涉光信号采集,典型的谱域OCT系统结构如
1997年,Chinn等[16]搭建了早期的扫频OCT系统。受限于激光器的性能,直到2004年Yun等[17]研发出了快速扫频光源,扫频OCT才得到了更好的应用。
3 内窥OCT技术的发展
目前,常用的内窥成像技术包括内窥超声、内窥光声、内窥共聚焦显微成像以及内窥OCT技术等。内窥超声技术能够诊断心血管、消化道等组织疾病,具有成像深度大的优点,但由于超声成像的分辨率通常大于100 μm,因此难以实现高分辨的组织内窥成像;内窥光声成像技术具有较高的光学对比度和较大的成像深度,但其轴向分辨率受限于超声成像技术;内窥共聚焦显微成像技术能够实现高分辨成像,但共聚焦显微镜结构精密、造价昂贵,使用和维护门槛较高;内窥OCT技术弥补了OCT只能对生物浅表组织进行成像的缺陷,能够实现对生物体内组织的1~10 μm分辨率成像[18-19]。相较于传统OCT系统,内窥OCT系统将样品臂部分制作成了内窥探头,微型成像探头在导管的配合下伸入生物体内,实现体内组织成像[20]。根据成像光束和扫描方式的不同,OCT内窥探头可以分为侧视成像探头和前视成像探头[21]。
3.1 内窥OCT扫描方式
内窥OCT的扫描方式主要有旋转式扫描、螺旋式扫描以及光栅式扫描。旋转式扫描是最早出现的一种扫描方式,也是现在应用最为广泛的扫描方式。天津大学的李乔等[22]采用自行设计的基于旋转扫描探头的OCT内窥系统获得了盖玻片和洋葱等样品的图像信息,其横向分辨率和纵向分辨率分别为10 μm和15 μm。Malone等[23]和Hemetsberger等[24]先后利用该扫描方法对肺移植和钙化冠状动脉病变患者的手术效果进行了评估,拓展了内窥OCT技术的临床应用。螺旋式扫描在旋转式扫描的基础上增加了一个固定速率的线性平移[25]。2006年,Xie等[26]设计了基于螺旋扫描探头的内窥成像系统,并采用该系统对兔气管进行了成像测试,验证了这种新型内窥镜的潜在临床价值。光栅式扫描利用位移调节器控制光纤头的移动,近些年发展迅速。2017年,Zhang等[27]使用光栅扫描方式对离体大鼠结肠黏膜进行了成像。该方法的优点是可以提供优异的灵敏度来表征结构的变化,因此在肠道成像领域具有广阔的应用前景。除了生物组织外,光栅式扫描也被拓展到一些非生物组织的研究与测试中,如熔石英表面缺陷修复等[28]。
3.2 内窥OCT探头
3.2.1 侧视成像探头
侧视成像探头[29]是应用很广泛的一种OCT内窥探头,其结构如
![不同类型的OCT内窥扫描探头。(a)侧视内窥OCT成像探头[29];(b)近端扫描内窥OCT探头[30];(c)远端扫描内窥OCT探头[31];(d)前视内窥OCT成像探头[33]](/richHtml/zgjg/2023/50/21/2107103/img_03.jpg)
图 3. 不同类型的OCT内窥扫描探头。(a)侧视内窥OCT成像探头[29];(b)近端扫描内窥OCT探头[30];(c)远端扫描内窥OCT探头[31];(d)前视内窥OCT成像探头[33]
Fig. 3. Different types of OCT endoscopic scanning probes. (a) Lateral view endoscopic OCT imaging probe[29]; (b) proximal scanning endoscopic OCT probe[30]; (c) distal scanning endoscopic OCT probe[31]; (d) anterior view endoscopic OCT imaging probe[33]
根据驱动装置位置的不同,侧视成像探头可以分为近端扫描探头和远端扫描探头。Tearney等[13]首次提出并设计了20 μm横向分辨率和38 μm纵向分辨率的近端扫描探头。典型的近端扫描探头的结构[30]如
3.2.2 前视成像探头
1997年,Sergeev等[20]首次提出前视成像探头,其典型结构[33]如
3.2.3 其他类型探头
近年来,OCT内窥探头在结构与应用上不断发展。2013年,Moon等[37]提出了一种超薄光纤内窥探头,其结构如
![其他类型的OCT探头。(a)无透镜内窥探头[37];(b)基于偏振敏感梯度折射率透镜的内窥探头[39];(c)白光显微镜和OCT相结合的双模态内窥镜探头[40];(d)OCT与荧光成像结合的多模态内窥探头[43]](/richHtml/zgjg/2023/50/21/2107103/img_04.jpg)
图 4. 其他类型的OCT探头。(a)无透镜内窥探头[37];(b)基于偏振敏感梯度折射率透镜的内窥探头[39];(c)白光显微镜和OCT相结合的双模态内窥镜探头[40];(d)OCT与荧光成像结合的多模态内窥探头[43]
Fig. 4. Other types of OCT probes. (a) Lens-free endoscopic probe[37]; (b) endoscopic probe based on polarization-sensitive GTIN lens[39]; (c) dual-modality endoscopic probe combining white light microscopy and OCT[40]; (d) multimodality endoscopic probe combining OCT and fluorescence imaging[43]
表 1. 部分代表性内窥OCT成像系统的性能比较
Table 1. Performance comparison of representative endoscopic OCT systems
|
3.3 超高分辨率OCT
超高分辨率OCT(UHR-OCT)是近年来兴起的技术。现阶段大多数内窥OCT成像在800~1300 nm波长范围内进行,高分辨率OCT的轴向分辨率为5.0~7.5 μm[45]。超高分辨率OCT采用800 nm左右的宽带光源,其轴向分辨率能够达到2.0~4.0 μm[46]。2018年,Nishimiya等[47]将UHR-OCT应用于冠状动脉内皮细胞可视化方面,对离体猪冠状动脉进行了成像。从
![UHR-OCT对离体猪冠状动脉成像图[47],其中左图为完整动脉成像效果,右图为剥离内皮层后的动脉成像效果](/richHtml/zgjg/2023/50/21/2107103/img_05.jpg)
图 5. UHR-OCT对离体猪冠状动脉成像图[47],其中左图为完整动脉成像效果,右图为剥离内皮层后的动脉成像效果
Fig. 5. UHR-OCT imaging of in vitro porcine coronary arteries[47], where the left panel shows the image of the intact artery, and the right panel shows the image of the artery after stripping the endothelial layer
除了可以对冠状动脉硬化进行诊断外,超高分辨率OCT在其他疾病的临床诊断中也得到了长足发展。2017年,Kim等[48]设计了一种轴向分辨率为2.49 μm、横向分辨率为2.59 μm的内窥镜探头,并用该探头对兔动脉进行了离体成像,证明了该技术临床应用的可行性。该课题组[49]于2020年设计的另一种外径为1.2 mm的micro-OCT探头能够在空气中实现1.83 μm的轴向分辨率和3.38 μm的横向分辨率,在评估钙化斑块风险性方面具有很高的应用价值。该技术目前还处于动物实验及临床测试中,未来有望应用于人体研究。2019年,Pedersen[50]将UHR-OCT与高性能相机结合,在临床上评估了由感染等因素引起的喉部发声障碍,并取得了2 mm的成像深度。2020年,Lee等[51]在采集图像时将参考臂长度与视网膜轮廓动态匹配,扩展了超高分辨率OCT系统的成像范围,该方法有助于提高视网膜相关疾病检测的准确性。Pahlevaninezhad等[52]设计了一种新型内窥镜,将能够改变入射光相位的超透镜集成到OCT导管中。这种新型内窥镜的外径为2.8 mm,相较于传统用于肺部气道和冠状动脉成像的内窥镜尺寸较大,但集成的超透镜能够控制光的相位从而克服球差和像散带来的影响,实现高分辨率成像,如
![使用集成超透镜的内窥镜对离体人肺组织进行成像[52],肺泡的特征结构清晰可见](/richHtml/zgjg/2023/50/21/2107103/img_06.jpg)
图 6. 使用集成超透镜的内窥镜对离体人肺组织进行成像[52],肺泡的特征结构清晰可见
Fig. 6. Imaging of isolated human lung tissue using an endoscope with integrated superlens[52], the characteristic structures of the alveoli are clearly visible
尽管UHR-OCT在分辨率上具有非常明显的优势,但其发展依然面临着挑战性,制约其发展的最主要因素就是成本。使不同波长的光沿着深度方向均匀聚焦的超消色差微透镜的单价约为10000美元[53],若成本问题得到很好的解决,则UHR-OCT可能在临床实践中得到更多应用。
3.4 多模态OCT
近年来,多模态OCT成像成为研究的热门方向之一[54]。将OCT系统与荧光成像、超声成像等成像方式结合,能够弥补OCT缺乏分子敏感性以及成像深度有限的缺点。2004年,Tumlinson等[55]设计了一台OCT与激光诱导荧光(LIF)相结合的双模态内窥镜,其结构如
![OCT与荧光结合的双模态成像。(a)OCT-LIF双模态内窥镜结构图[55];(b)OCT-NIRAF对冠状动脉硬化的评估[56];(c)OCT-AFI对输卵管在体成像[57]](/richHtml/zgjg/2023/50/21/2107103/img_07.jpg)
图 7. OCT与荧光结合的双模态成像。(a)OCT-LIF双模态内窥镜结构图[55];(b)OCT-NIRAF对冠状动脉硬化的评估[56];(c)OCT-AFI对输卵管在体成像[57]
Fig. 7. Dual-modality imaging with OCT combined with fluorescence. (a) OCT- LIF dual-modality endoscopic structure[55]; (b) OCT-NIRAF for coronary arteriosclerosis assessment[56]; (c) OCT-AFI for in vivo imaging of the fallopian tube[57]
2010年,Li等[58]提出了一种新型的超声(US)- OCT成像系统,在该系统中,超声波和OCT光束同轴发射。Li等采用该系统对正常兔主动脉进行了体外成像,如
![正常兔主动脉的OCT成像与US-OCT双模态成像[58]。(a)OCT图像;(b)US-OCT图像](/richHtml/zgjg/2023/50/21/2107103/img_08.jpg)
图 8. 正常兔主动脉的OCT成像与US-OCT双模态成像[58]。(a)OCT图像;(b)US-OCT图像
Fig. 8. OCT and US-OCT dual-modality imagingof normal rabbit aorta[58]. (a) OCT image; (b) US-OCT image
3.5 商业化方面的进展
早期的内窥OCT成像主要采用时域OCT系统。2004年,美国LightLab Imaging公司发布了第一款名为M2的商用血管内窥成像系统,并于2007年开发了第二代血管内窥成像系统M3。然而,由于采用时域OCT技术,该系统的成像速率只能达到20 frame/s左右,严重影响了成像效率和成像质量。2009年,该公司发布了第一台商用FD-OCT系统,将帧率提升到了100 frame/s,并通过加快回拉速度大大缩短了成像时间。在此之后,该公司又研发了一系列内窥OCT产品,使商用OCT逐渐进入临床应用。
近些年,国内的商用内窥产品逐渐获得认证并上市,其中深圳市中科微光医疗器械技术有限公司、南京沃福曼医疗科技有限公司的产品最为典型。2019年,南京沃福曼医疗科技有限公司推向市场的型号为F2的血管内断层成像系统的分辨率能达到约10 μm,并且54/76 mm的回拉长度使得扫描范围更加广阔。2020—2022年,深圳市中科微光医疗器械技术有限公司连续推出了Cornaris®P60、Cornaris®P80、Cornaris® Mobile三款商用OCT设备,其中Cornaris®P80的多模态成像使得斑块、血流、钙化评估更加精确,而Cornaris®Mobile作为移动式的OCT影像系统为临床诊断提供了便利,如
表 2. 不同型号商用内窥OCT产品的参数及重要信息
Table 2. Parameters and important information of different commercial endoscopic OCT products
|
4 内窥OCT技术的临床应用
4.1 心血管
相较于血管内超声成像,血管内OCT能够精确测量冠状动脉内膜和纤维帽厚度,因此能够更加精准地评估动脉粥样硬化斑块的易损性[60]。基于该技术,研究人员开展了大量研究,如:2014年,Li等[61]实现了兔腹主动脉的活体成像,成像结果清晰地呈现了脂质和钙化斑块(如
![兔腹主动脉活体成像[61]。(a)兔动脉粥样硬化微结构的OCT横断面图像;(b)存在钙化斑块的OCT图像;(c)存在脂质斑块的OCT图像](/richHtml/zgjg/2023/50/21/2107103/img_09.jpg)
图 9. 兔腹主动脉活体成像[61]。(a)兔动脉粥样硬化微结构的OCT横断面图像;(b)存在钙化斑块的OCT图像;(c)存在脂质斑块的OCT图像
Fig. 9. Imaging of rabbit abdominal aorta[61]. (a) OCT cross-sectional images of atherosclerotic microstructures in rabbits; (b) OCT images of calcified plaques; (c) OCT image of lipid plaques
除此之外,内窥OCT技术在心血管领域常用于支架植入手术的术前评估和术后评价[64]、血管造影以及血管弹性分析等。Perkins等[65]将生物可吸收的支架植入到猪冠状动脉中,并在28 d后采用OCT内窥技术进行成像,成像结果如
![猪冠状动脉代表性图像[65]。(a)植入支架后的血管造影图;(b)OCT成像(由于聚合物的性质,支架不反射光,显示为透明(黑色)菱形)](/richHtml/zgjg/2023/50/21/2107103/img_10.jpg)
图 10. 猪冠状动脉代表性图像[65]。(a)植入支架后的血管造影图;(b)OCT成像(由于聚合物的性质,支架不反射光,显示为透明(黑色)菱形)
Fig. 10. Representative images of porcine coronary arterie[65]. (a) Angiogram after stent implantation; (b) OCT image (because of the polymeric nature, the stent does not reflect light and therefore appears as a transparent (black) diamond shape)
血管内窥成像还可以与弹性成像相结合,分析血管壁的弹性属性。Wang等[66]使用直径为1.1 mm的导管和频率为1.6 MHz的傅里叶域锁模OCT系统,通过改变血管壁压力,研究了两个连续帧之间的相位变化,获得了压力变化引起的径向应变图像。压力变化过程中的相移如
![压力变化引起的径向应变图像[66]。(a)~(d)两帧之间的相移;(e)~(h)相移的梯度](/richHtml/zgjg/2023/50/21/2107103/img_11.jpg)
图 11. 压力变化引起的径向应变图像[66]。(a)~(d)两帧之间的相移;(e)~(h)相移的梯度
Fig. 11. Images of radial strain due to pressure changes[66]. (a)‒(d) Phase shift between two frames; (e)‒(h) the gradient of phase shifts
4.2 呼吸道
近年来,OCT内窥技术在肺癌的早期诊断[67]以及慢性支气管炎症[68]及支气管哮喘[69]诊断方面的研究逐渐增多。2018年,Goorsenberg等[70]证实了内窥OCT技术可以评价支气管热成形术对重度哮喘的治疗效果,为术后评估提供了新途径。2021年,Nandy等[71]通过支气管腔内光学相干层析扫描(EB-OCT)技术提高了早期间质性肺疾病(ILD)诊断的准确性,弥补了目前诊断方法的缺陷。2022年,Zhu等[72]对支气管良恶性病变进行了成像(如
![支气管良恶性病变的OCT截面图[72]。(a)支气管良性病变;(b)支气管恶性病变](/richHtml/zgjg/2023/50/21/2107103/img_12.jpg)
图 12. 支气管良恶性病变的OCT截面图[72]。(a)支气管良性病变;(b)支气管恶性病变
Fig. 12. OCT cross-sectional views of benign and malignant bronchial lesions[72]. (a) Benign bronchial lesion; (b) malignant bronchial lesion
4.3 胃肠道
OCT内窥技术在食道上的临床应用目前还处于探索阶段,该技术对食管腺癌风险的巴雷特食管病变[74]有着良好的早期诊断效果。2007年,Chen等[75]首次使用超高分辨率OCT对巴雷特食管病变进行成像,获得了轴向分辨率约为5 μm、横向分辨率约为15 μm的图像。2013年,Gora等[76]设计了一种集成光学元器件的胶囊内窥镜。患者吞咽胶囊探头后,探头在通过消化道时捕获图像。该技术简单且患者无痛感,为食道以及消化道疾病的筛查提供了新方案。2019年,Ahsen等[77]使用OCT技术在体评估了巴雷特食管病变和异型增生,如
](/richHtml/zgjg/2023/50/21/2107103/img_13.jpg)
图 13. OCT内窥成像图[77](白线区域黏膜形态不规则,其下方为非增生性巴雷特食管,其右侧为正常鳞状上皮。星点为运动伪影,星号为导管未接触黏膜区域,箭头为不典型增生病变)
Fig. 13. OCT endoscopic image[77] (the mucosal morphology is irregular in the white line region with a nonproliferative Barrett’s esophagus below it and normal squamous epithelium to its right. Star dots indicate motion artifacts, asterisks indicate areas where the duct does not touch the mucosa, and arrows indicate atypical proliferative lesions)
OCT内窥技术在胃和小肠上的研究进展较为缓慢,制约其发展的主要因素是胃的尺寸较大[78]以及小肠的长度较长[79],内窥镜需要足够大的扫描范围以及足够长的工作距离。尽管具有一定的挑战性,Kim等[80]依然通过对胃部组织成像,初步验证了OCT具有分辨正常胃组织和癌变胃组织的能力,为内窥OCT在胃部成像的应用开辟了道路。OCT内窥技术在小肠上的研究主要集中在相关手术的术中成像以及术后评估上。2021年,Kiseleva等[81]对急性肠系膜缺血患者的病变部位进行了成像,从
![缺血回肠OCT成像图,白色箭头指向肌间液积聚处[81]](/richHtml/zgjg/2023/50/21/2107103/img_14.jpg)
图 14. 缺血回肠OCT成像图,白色箭头指向肌间液积聚处[81]
Fig. 14. OCT images of ischemic ileum with white arrows pointing to the interstitial fluid accumulation[81]
2021年,Jelly等[82]将该技术应用到小肠同种异体移植的排异反应检测中,对经过小肠异体移植的受试者进行了OCT成像。
![小肠异体移植当天与1 d后产生排异反应的OCT成像对比图[82]](/richHtml/zgjg/2023/50/21/2107103/img_15.jpg)
图 15. 小肠异体移植当天与1 d后产生排异反应的OCT成像对比图[82]
Fig. 15. OCT imaging of the small intestine allograft on the day of transplantation versus one day later when it produced a rejection reaction[82]
OCT内窥成像与血管造影相结合产生了内窥血管造影(OCTA)技术。2017年,Lee等[83]对97例接受巴雷特食管治疗的患者进行了OCTA成像,验证了内窥血管造影技术能够分析食管壁的血管特征,拓展了OCTA在临床诊断中的应用。同年,Liang等[84]提出了一种前视成像探头,并采用该探头对肠增生息肉进行了成像,成像结果如
![肠增生息肉的OCT和OCTA图像[84]。(a)150 μm深度处的OCT图像;(b)150 μm深度处的OCTA图像;(c)200 μm深度处的OCT图像;(d)200 μm深度处的OCTA图像](/richHtml/zgjg/2023/50/21/2107103/img_16.jpg)
图 16. 肠增生息肉的OCT和OCTA图像[84]。(a)150 μm深度处的OCT图像;(b)150 μm深度处的OCTA图像;(c)200 μm深度处的OCT图像;(d)200 μm深度处的OCTA图像
Fig. 16. OCT and OCTA images of intestinal hyperplastic polyps[84]. (a) OCT image at 150 μm depth; (b) OCTA image at 150 μm depth; (c) OCT image at 200 μm depth; (d) OCTA image at 150 μm depth
4.4 癌症筛查
内窥OCT技术能够评估胆胰管、子宫颈、输尿管等多种组织的早期癌变,如
![不同部位肿瘤组织的OCT图像。(a)胆胰管肿瘤组织放大图[86];(b)输尿管癌的OCT图像[87];(c)子宫颈组织正常、癌变早期、癌变状态下的图像[88]](/richHtml/zgjg/2023/50/21/2107103/img_17.jpg)
图 17. 不同部位肿瘤组织的OCT图像。(a)胆胰管肿瘤组织放大图[86];(b)输尿管癌的OCT图像[87];(c)子宫颈组织正常、癌变早期、癌变状态下的图像[88]
Fig. 17. OCT images of different tumor tissues. (a) Magnified view of biliopancreatic duct tumor tissue[86]; (b) OCT image of ureteral carcinoma[87]; (c) images of normal, early cancerous, and cancerous cervical tissues[88]
在妇科疾病的早期诊断方面,内窥OCT技术也提供了新的思路。2019年,Li等[89]提出了一种新型的内窥镜OCT系统,并采用该系统对人体阴道进行了体内成像,成像结果如
![1.3 μm中心波长和1.7 μm中心波长的OCT系统对人体阴道成像[89]](/richHtml/zgjg/2023/50/21/2107103/img_18.jpg)
图 18. 1.3 μm中心波长和1.7 μm中心波长的OCT系统对人体阴道成像[89]
Fig. 18. OCT images of the human vagina with 1.3 μm and 1.7 μm OCT system[89]
5 结束语
近三十年来,内窥OCT技术经历了从时域OCT到频域OCT的进步,在心血管、呼吸道、消化道、胆胰管、输尿管等组织上均有着丰富的研究成果,并逐渐成为传统内窥探测方法以外的一种新型诊断手段。预计未来内窥OCT技术的发展主要集中在以下几个方面:
第一,改良探头的结构,拓展其成像深度。Yang等[91]基于快速检测宽场反射矩阵,将OCT成像深度拓展了约2倍。Cao等[92]通过控制散射光子在介质中的传播,增强了光能在散射介质中的输送,成功地将光束聚焦在样品深部,从而发展出增大OCT成像深度的新方法。该技术有望应用于内窥OCT成像领域,拓展内窥OCT的成像深度。
第二,优化探头的工作距离,拓展焦深。Yin等[93]引入了一种可产生同轴聚焦多模光束的光纤系统,该系统能够在超过400 μm的深度范围内实现对生物组织的清晰成像,该技术在人体内脏成像方面有着巨大潜力。Bo等[94]采用多孔径合成的新技术,将不同孔径的B-scan图像合成到新的B-scan中实现了对图像的校正,在0~1 mm的深度范围内都具有良好的成像性能。
第三,提高成像分辨率,完善多模态成像技术。超高分辨率OCT技术通过多光谱的拼接、色散补偿等方法能够将分辨率提升一个数量级。将内窥OCT技术与超声、光声、共聚焦显微成像等技术结合,实现多模态成像,有望为疾病的精准诊断提供更加全面的影像信息。
第四,建立临床应用标准。将内窥OCT技术进一步应用到心血管、呼吸道、胃肠道等领域,拓展其应用范围。通过采集大量的图像,并进行图像标注,建立诊断各种疾病的临床标准。
第五,促进商业化发展,扩大内窥OCT的市场规模。现阶段的商业化设备陆续出现,扫描速率、扫描范围、回拉速度、灵敏度等性能指标不断提升。未来的内窥OCT设备有望实现更高的回拉速度以及更高的成像帧率,真正实现高速实时成像,更多地应用到组织检查及手术介入等临床领域。相信通过在这些方向的发展,内窥OCT技术将成为临床诊断不可或缺的手段之一。
[1] Huang D, Swanson E A, Lin C P, et al. Optical coherence tomography[J]. Science, 1991, 254(5035): 1178-1181.
[2] Kereiakes D J, Ellis S G, Metzger C, et al. 3-year clinical outcomes with everolimus-eluting bioresorbable coronary scaffolds[J]. Journal of the American College of Cardiology, 2017, 70(23): 2852-2862.
[3] Ong J, Zarnegar A, Corradetti G, et al. Advances in optical coherence tomography imaging technology and techniques for choroidal and retinal disorders[J]. Journal of Clinical Medicine, 2022, 11(17): 5139.
[4] Hanumunthadu D, Keane P A, Balaskas K, et al. Agreement between spectral-domain and swept-source optical coherence tomography retinal thickness measurements in macular and retinal disease[J]. Ophthalmology and Therapy, 2021, 10(4): 913-922.
[5] Yabushita H, Bouma B E, Houser S L, et al. Characterization of human atherosclerosis by optical coherence tomography[J]. Circulation, 2002, 106(13): 1640-1645.
[6] Lauterbur P C. Image formation by induced local interactions: examples employing nuclear magnetic resonance[J]. Nature, 1973, 242(5394): 190-191.
[7] Richmond C. Sir Godfrey Hounsfield: engineer who invented computed tomography and won the Nobel Prize for medicine[J]. BMJ: British Medical Journal, 2004, 329(7467): 687-687.
[8] Claire R, Mafalda C, Victor F, et al. 4D functional ultrasound imaging of whole-brain activity in rodents[J]. Nature Methods, 2019, 16(10): 994-997.
[9] Kruger R A, Liu P. Photoacoustic ultrasound: pulse production and detection of 0.5% Liposyn[J]. Medical Physics, 1994, 21(7): 1179-1184.
[10] Ntziachristos V, Bremer C, Weissleder R. Fluorescence imaging with near-infrared light: new technological advances that enable in vivo molecular imaging[J]. European Radiology, 2003, 13(1): 195-208.
[11] Tran P H, Mukai D S, Brenner M, et al. In vivo endoscopic optical coherence tomography by use of a rotational microelectromechanical system probe[J]. Optics Letters, 2004, 29(11): 1236-1238.
[12] Fujimoto J G, Brezinski M E, Tearney G J, et al. Optical biopsy and imaging using optical coherence tomography[J]. Nature Medicine, 1995, 1(9): 970-972.
[13] Tearney G J, Brezinski M E, Fujimoto J G, et al. Scanning single-mode fiber optic catheter-endoscope for optical coherence tomography: erratum[J]. Optics Letters, 1996, 21(12): 912.
[14] Fercher A F, Hitzenberger C K, Kamp G, et al. Measurement of intraocular distances by backscattering spectral interferometry[J]. Optics Communications, 1995, 117(1/2): 43-48.
[15] Wojtkowski M, Leitgeb R, Kowalczyk A, et al. In vivo human retinal imaging by Fourier domain optical coherence tomography[J]. Journal of Biomedical Optics, 2002, 7(3): 457-463.
[16] Chinn S R, Swanson E A, Fujimoto J G. Optical coherence tomography using a frequency-tunable optical source[J]. Optics Letters, 1997, 22(5): 340-342.
[17] Yun S H, Boudoux C, Pierce M C, et al. Extended-cavity semiconductor wavelength-swept laser for biomedical imaging[J]. IEEE Photonics Technology Letters, 2004, 16(1): 293-295.
[18] Pan Y T, Xie H K, Fedder G K. Endoscopic optical coherence tomography based on a microelectromechanical mirror[J]. Optics Letters, 2001, 26(24): 1966-1968.
[19] Tearney G J, Brezinski M E, Bouma B E, et al. In vivo endoscopic optical biopsy with optical coherence tomography[J]. Science, 1997, 276(5321): 2037-2039.
[20] Sergeev A, Gelikonov V, Gelikonov G, et al. In vivo endoscopic OCT imaging of precancer and cancer states of human mucosa[J]. Optics Express, 1997, 1(13): 432-440.
[21] 李艳, 奚杰峰. 内窥式光学相干断层成像系统及其应用[J]. 中国医疗器械信息, 2017, 23(5): 13-18.
Li Y, Xi J F. Endoscopic optical coherence tomography and its applications[J]. China Medical Device Information, 2017, 23(5): 13-18.
[22] 李乔, 高长磊, 陈晓冬, 等. 基于旋转扫描探头的OCT内窥成像系统设计[J]. 光子学报, 2009, 38(10): 2650-2653.
[23] Malone J, Lee A M D, Hohert G, et al. Small airway dilation measured by endoscopic optical coherence tomography correlates with chronic lung allograft dysfunction[J]. Journal of Biomedical Optics, 2021, 26(7): 076005.
[24] Hemetsberger R, Gori T, Toelg R, et al. Optical coherence tomography assessment in patients treated with rotational atherectomy versus modified balloons: PREPARE-CALC OCT[J]. Circulation: Cardiovascular Interventions, 2021, 14(3): e009819.
[25] 姚文涛, 高万荣. 内窥光学层析成像的发展和应用[J]. 激光与光电子学进展, 2018, 55(7): 070002.
[26] XieT, GuoS, ChenZ, et al. GRIN lens rod based probe for endoscopic spectral domain optical coherence tomography with fast dynamic focus tracking[L]. Optics Express, 2006, 14(8): 3238-3246.
[27] Zhang L, Capilla A, Song W Y, et al. Oblique scanning laser microscopy for simultaneously volumetric structural and molecular imaging using only one raster scan[J]. Scientific Reports, 2017, 7: 8591.
[28] 蒋勇, 贺少勃, 袁晓东, 等. CO2激光光栅式扫描修复熔石英表面缺陷的实验研究与数值模拟[J]. 物理学报, 2014, 63(6): 068105.
Jiang Y, He S B, Yuan X D, et al. Experimental investigation and numerical simulation of defect elimination by CO2 laser raster scanning on fused silica[J]. Acta Physica Sinica, 2014, 63(6): 068105.
[29] Xi J F, Huo L, Wu Y C, et al. High-resolution OCT balloon imaging catheter with astigmatism correction[J]. Optics Letters, 2009, 34(13): 1943-1945.
[30] Tsai T H, Potsaid B, Tao Y K, et al. Ultrahigh speed endoscopic optical coherence tomography using micromotor imaging catheter and VCSEL technology[J]. Biomedical Optics Express, 2013, 4(7): 1119-1132.
[31] Wang T S, Wieser W, Springeling G, et al. Intravascular optical coherence tomography imaging at 3200 frames per second[J]. Optics Letters, 2013, 38(10): 1715-1717.
[32] Li J N, Feroldi F, de Lange J, et al. Polarization sensitive optical frequency domain imaging system for endobronchial imaging[J]. Optics Express, 2015, 23(3): 3390-3402.
[33] Liu X M, Cobb M J, Chen Y C, et al. Rapid-scanning forward-imaging miniature endoscope for real-time optical coherence tomography[J]. Optics Letters, 2004, 29(15): 1763-1765.
[34] Zhang N, Tsai T H, Ahsen O O, et al. Compact piezoelectric transducer fiber scanning probe for optical coherence tomography[J]. Optics Letters, 2014, 39(2): 186-188.
[35] Fu X Y, Patel D, Zhu H, et al. Miniature forward-viewing common-path OCT probe for imaging the renal pelvis[J]. Biomedical Optics Express, 2015, 6(4): 1164-1171.
[36] Sun C R, Lee K K C, Vuong B, et al. Intraoperative handheld optical coherence tomography forward-viewing probe: physical performance and preliminary animal imaging[J]. Biomedical Optics Express, 2012, 3(6): 1404-1412.
[37] Moon S, Piao Z L, Kim C S, et al. Lens-free endoscopy probe for optical coherence tomography[J]. Optics Letters, 2013, 38(12): 2014-2016.
[38] Chen T Y, Zhang N, Huo T C, et al. Tiny endoscopic optical coherence tomography probe driven by a miniaturized hollow ultrasonic motor[J]. Journal of Biomedical Optics, 2013, 18(8): 086011.
[39] Wang D L, Duan C, Zhang X Y, et al. Common-path optical coherence tomography using a microelectromechanical-system-based endoscopic probe[J]. Applied Optics, 2016, 55(25): 6930-6935.
[40] Blattmann M, Kretschmer S, Thiele S, et al. Bimodal endoscopic probe combining white-light microscopy and optical coherence tomography[J]. Applied Optics, 2016, 55(15): 4261-4269.
[41] Liao W C, Chen T Y, Wang C M, et al. Endoscopic optical coherence tomography with a focus-adjustable probe[J]. Optics Letters, 2017, 42(20): 4040-4043.
[42] Ding Z H, Qiu J R, Shen Y, et al. Lens-free all-fiber probe with an optimized output beam for optical coherence tomography[J]. Optics Letters, 2017, 42(14): 2814-2817.
[43] 王健平, 陈明惠, 谈维杰, 等. 用于OCT成像与pH测量的双模态内窥探头[J]. 中国激光, 2020, 47(9): 0907001.
[44] Qiu J R, Han T, Liu Z Y, et al. Uniform focusing with an extended depth range and increased working distance for optical coherence tomography by an ultrathin monolith fiber probe[J]. Optics Letters, 2020, 45(4): 976-979.
[45] Møller Israelsen N, Mogensen M, Jensen M, et al. Delineating papillary dermis around basal cell carcinomas by high and ultrahigh resolution optical coherence tomography—a pilot study[J]. Journal of Biophotonics, 2021, 14(11): 202100083.
[46] . Advances in corneal imaging: current applications and beyond[J]. Asia-Pacific Journal of Ophthalmology, 2019, 8(2): 105-114.
[47] Nishimiya K, Yin B, Piao Z, et al. Super high-resolution OCT for endothelial cell visualization in the coronary arteries[J]. European Heart Journal, 2018, 39(suppl_1): 2271.
[48] Kim J, Xing J C, Nam H S, et al. Endoscopic micro-optical coherence tomography with extended depth of focus using a binary phase spatial filter[J]. Optics Letters, 2017, 42(3): 379-382.
[49] Kim J, Kim S, Song J W, et al. Flexible endoscopic micro-optical coherence tomography for three-dimensional imaging of the arterial microstructure[J]. Scientific Reports, 2020, 10: 9248.
[50] Pedersen M. Ultra-high-resolution (UHR) optical coherence tomography (OCT) in the upper airways: aspect of combined high-speed films and UHR OCT in the larynx[J]. International Journal of Clinical & Experimental Otolaryngology, 2019, 5(1): 101-105.
[51] Lee B, Chen S Y, Moult E M, et al. High-speed, ultrahigh-resolution spectral-domain OCT with extended imaging range using reference arm length matching[J]. Translational Vision Science & Technology, 2020, 9(7): 12.
[52] Pahlevaninezhad H, Khorasaninejad M, Huang Y W, et al. Nano-optic endoscope for high-resolution optical coherence tomography in vivo[J]. Nature Photonics, 2018, 12(9): 540-547.
[53] Gora M J, Suter M J, Tearney G J, et al. Endoscopic optical coherence tomography: technologies and clinical applications[J]. Biomedical Optics Express, 2017, 8(5): 2405-2444.
[54] 胡杰, 郭勇尉, 朱浩淼. 光学相干层析成像多模态造影剂的研究进展[J]. 激光与光电子学进展, 2022, 59(6): 0617008.
[55] Tumlinson A R, Hariri L P, Utzinger U, et al. Miniature endoscope for simultaneous optical coherence tomography and laser-induced fluorescence measurement[J]. Applied Optics, 2004, 43(1): 113-121.
[56] Ughi G J, Wang H, Gerbaud E, et al. Clinical characterization of coronary atherosclerosis with dual-modality OCT and near-infrared autofluorescence imaging[J]. JACC: Cardiovascular Imaging, 2016, 9(11): 1304-1314.
[57] Malone J, Hohert G, Hoang L, et al. Endoscopic optical coherence tomography (OCT) and autofluorescence imaging (AFI) of ex vivo fallopian tubes[J]. Proceedings of SPIE, 2020, 11232: 1123202.
[58] Li X, Yin J C, Hu C H, et al. High-resolution coregistered intravascular imaging with integrated ultrasound and optical coherence tomography probe[J]. Applied Physics Letters, 2010, 97(13): 133702.
[59] 万余洋, 雷鹏, 熊科迪, 等. 血管内光声-超声-光学相干层析-光声弹性多模态成像方法及系统[J]. 中国激光, 2023, 50(3): 0307107.
[60] Bartuś S, Rzeszutko Ł, Januszek R. Optical coherence tomography enhanced by novel software to better visualize the mechanism of atherosclerosis and improve the effects of percutaneous coronary intervention[J]. Kardiologia Polska, 2022, 80(1): 99-100.
[61] Li J W, Li X, Mohar D, et al. Integrated IVUS-OCT for real-time imaging of coronary atherosclerosis[J]. JACC: Cardiovascular Imaging, 2014, 7(1): 101-103.
[62] Costopoulos C, Brown A J, Teng Z Z, et al. Intravascular ultrasound and optical coherence tomography imaging of coronary atherosclerosis[J]. The International Journal of Cardiovascular Imaging, 2016, 32(1): 189-200.
[63] Pinheiro L F M, Garzon S, Mariani J,, et al. Inflammatory phenotype by OCT coronary imaging: specific features among de novo lesions, in-stent neointima, and in-stent neo-atherosclerosis[J]. Arquivos Brasileiros De Cardiologia, 2022, 119(6): 931-937.
[64] Tsiknakis N, Spanakis C, Tsoumpou P, et al. OCT sequence registration before and after percutaneous coronary intervention (stent implantation)[J]. Biomedical Signal Processing and Control, 2023, 79: 104251.
[65] Perkins L E L, Rippy M K. Balloons and stents and scaffolds: preclinical evaluation of interventional devices for occlusive arterial disease[J]. Toxicologic Pathology, 2019, 47(3): 297-310.
[66] Wang T S, Pfeiffer T, Akyildiz A, et al. Intravascular optical coherence elastography[J]. Biomedical Optics Express, 2022, 13(10): 5418-5433.
[67] Tsuboi M, Hayashi A, Ikeda N, et al. Optical coherence tomography in the diagnosis of bronchial lesions[J]. Lung Cancer, 2005, 49(3): 387-394.
[68] Kirby M, van Beek E J R, Seo J B, et al. Management of COPD: is there a role for quantitative imaging?[J]. European Journal of Radiology, 2017, 86: 335-342.
[69] Ding M, Chen Y, Guan W J, et al. Measuring airway remodeling in patients with different COPD staging using endobronchial optical coherence tomography[J]. Chest, 2016, 150(6): 1281-1290.
[70] Goorsenberg A W M, D'Hooghe J N S, de Bruin D M, et al. Acute airway effects of bronchial thermoplasty assessed by optical coherence tomography (OCT)[J]. European Respiratory Journal, 2018, 52: OA4934.
[71] Nandy S, Raphaely R A, Muniappan A, et al. Diagnostic accuracy of endobronchial optical coherence tomography for the microscopic diagnosis of usual interstitial pneumonia[J]. American Journal of Respiratory and Critical Care Medicine, 2021, 204(10): 1164-1179.
[72] Zhu Q, Yu H, Liang Z X, et al. Novel image features of optical coherence tomography for pathological classification of lung cancer: results from a prospective clinical trial[J]. Frontiers in Oncology, 2022, 12: 870556.
[73] Bu R F, Price H, Mitran S, et al. Swept-source anatomic optical coherence elastography of porcine trachea[J]. Proceedings of SPIE, 2016, 9689: 968923.
[74] 孙树申, 杜绍山. 巴雷特食管研究现状[J]. 吉林医学, 2020, 41(4): 953-955.
Sun S S, Du S S. Research status of Barrett esophagus[J]. Jilin Medical Journal, 2020, 41(4): 953-955.
[75] Chen Y, Aguirre A D, Hsiung P L, et al. Ultrahigh resolution optical coherence tomography of Barrett’s esophagus: preliminary descriptive clinical study correlating images with histology[J]. Endoscopy, 2007, 39(7): 599-605.
[76] Gora M J, Sauk J S, Carruth R W, et al. Tethered capsule endomicroscopy enables less invasive imaging of gastrointestinal tract microstructure[J]. Nature Medicine, 2013, 19(2): 238-240.
[77] Ahsen O O, Liang K C, Hsiang-Chieh L, et al. Assessment of Barrett’s esophagus and dysplasia with ultrahigh-speed volumetric en face and cross-sectional optical coherence tomography[J]. Endoscopy, 2019, 51(4): 355-359.
[78] Ennen C S, McGlynn A F, Ju H, et al. Fetal gastric size: linear and volume measurements and temporal changes[J]. American Journal of Obstetrics and Gynecology, 2018, 218(1): S256-S257.
[79] Fanucci A, Cerro P, Fraracci L, et al. Small bowel length measured by radiography[J]. Gastrointestinal Radiology, 1984, 9(1): 349-351.
[80] Kim S, Park S M, Bak S, et al. Investigation of craquelure patterns in oil paintings using precise 3D morphological analysis for art authentication[J]. PLoS One, 2022, 17(7): e0272078.
[81] Kiseleva E, Ryabkov M, Baleev M, et al. Prospects of intraoperative multimodal OCT application in patients with acute mesenteric ischemia[J]. Diagnostics, 2021, 11(4): 705.
[82] Jelly E T, Kwun J, Schmitz R, et al. Optical coherence tomography of small intestine allograft biopsies using a handheld surgical probe[J]. Journal of Biomedical Optics, 2021, 26(9): 096008.
[83] Lee H C, Ahsen O O, Liang K C, et al. Endoscopic optical coherence tomography angiography microvascular features associated with dysplasia in Barrett’s esophagus (with video)[J]. Gastrointestinal Endoscopy, 2017, 86(3): 476-484.e3.
[84] Liang K C, Ahsen O O, Wang Z, et al. Endoscopic forward-viewing optical coherence tomography and angiography with MHz swept source[J]. Optics Letters, 2017, 42(16): 3193-3196.
[85] Yao L, Li H K, Liu K Y, et al. Endoscopic optical coherence tomography angiography using inverse SNR-amplitude decorrelation features and electrothermal micro-electro-mechanical system raster scan[J]. Quantitative Imaging in Medicine and Surgery, 2022, 12(6): 3078-3091.
[86] Testoni P A, Mangiavillano B. Optical coherence tomography in detection of dysplasia and cancer of the gastrointestinal tract and bilio-pancreatic ductal system[J]. World Journal of Gastroenterology, 2008, 14(42): 6444-6452.
[87] Bus M T J, de Bruin D M, Faber D J, et al. Optical coherence tomography as a tool for in vivo staging and grading of upper urinary tract urothelial carcinoma: a study of diagnostic accuracy[J]. The Journal of Urology, 2016, 196(6): 1749-1755.
[88] Belinson S E, Ledford K, Rasool N, et al. Cervical epithelial brightness by optical coherence tomography can determine histological grades of cervical neoplasia[J]. Journal of Lower Genital Tract Disease, 2013, 17(2): 160-166.
[89] Li Y, Sudol N T, Miao Y S, et al. 1.7 micron optical coherence tomography for vaginal tissue characterization in vivo[J]. Lasers in Surgery and Medicine, 2019, 51(2): 120-126.
[90] Ding B, Tao J Y, Tao K Y, et al. A pilot and ex-vivo study of examination of endometrium tissue by catheter based optical coherence tomography[J]. BMC Medical Imaging, 2022, 22(1): 162.
[91] Yang Q A, Cao J, Miao Y S, et al. Extended imaging depth of en-face optical coherence tomography based on fast measurement of a reflection matrix by wide-field heterodyne detection[J]. Optics Letters, 2020, 45(4): 828-831.
[92] Cao J, Yang Q, Miao Y S, et al. Enhance the delivery of light energy ultra-deep into turbid medium by controlling multiple scattering photons to travel in open channels[J]. Light: Science & Applications, 2022, 11: 108.
[93] Yin B W, Hyun C, Gardecki J A, et al. Extended depth of focus for coherence-based cellular imaging[J]. Optica, 2017, 4(8): 959-965.
[94] Bo E, Ge X, Wang L L, et al. Multiple aperture synthetic optical coherence tomography for biological tissue imaging[J]. Optics Express, 2018, 26(2): 772-780.
Article Outline
张璇晔, 朱疆. 内窥光学相干层析成像的研究进展与应用[J]. 中国激光, 2023, 50(21): 2107103. Xuanye Zhang, Jiang Zhu. Research Progress and Applications of Endoscopic Optical Coherence Tomography[J]. Chinese Journal of Lasers, 2023, 50(21): 2107103.






