基于近红外自体荧光技术的甲状旁腺快速识别系统  下载: 589次
下载: 589次
1 引言
近年来在全球范围内甲状腺疾病的发病率在逐年升高。其中甲状腺癌是内分泌系统最常见的恶性肿瘤之一,近年来发病率迅速升高,约占全世界所有癌症2.1%[1]。目前对甲状腺肿瘤的治疗主要以手术切除为主。甲状旁腺损伤是甲状腺手术的并发症之一,发生率约为30%~60%[2]。由于甲状旁腺的大小只有几毫米,肉眼观察下不易与脂肪、淋巴结、异位甲状腺区分,如被意外切除,会造成术后暂时性或永久性甲状旁腺功能减退[3-4],严重影响病人生活质量。
当前术中辅助识别甲状旁腺技术中:纳米碳负显影技术通过将纳米碳注射到甲状旁腺组织内,使甲状腺及引流区域的淋巴结染成黑色,而甲状旁腺不会被染色[5],因而甲状旁腺能够与甲状腺及淋巴结区分,但不能与周围脂肪组织区分;亚甲蓝正显影技术通过将亚甲蓝注入人体,甲状腺与淋巴结会被染成淡蓝色,而甲状旁腺会被染成深蓝色,根据色差进行鉴别,但越来越多的研究表明,病理性甲状旁腺组织易被染成蓝色,而正常甲状旁腺组织的染色率很低[6]。因此,目前临床医生主要凭借肉眼和经验进行判断,存在较大的误判风险。
自2006年发现甲状旁腺在近红外光照射下可产生自体荧光现象后[7],一系列研究表明,甲状旁腺中含有某种特殊的荧光物质,其在785 nm激光的照射下会产生820 nm波长的近红外荧光,且甲状旁腺的荧光强度明显高于甲状腺等周围组织[8-10]。基于该原理,通过手持光纤探针传导激发光,并收集荧光信息,通过光谱仪将光学信号转换成电信号,对数据进行处理后可判断待测组织是否为甲状旁腺组织[11]。但目前的探针式荧光检测系统于术中需要进行多点检测,且无法主动寻找识别,需要医生预先目视判别,识别速度较慢。
针对当前甲状旁腺检测方法的不足,本文设计了一种基于近红外自体荧光技术的甲状旁腺快速成像识别系统。本系统能够显示组织成像画面,便于医生快速、准确地识别甲状旁腺,且无需进行术前额外准备,无需注射荧光造影剂,能有效避免荧光造影剂对人体产生的副作用,节约手术时间,提高术中识别率。
2 检测原理及系统设计
2.1 检测原理
甲状旁腺组织经波长为690~780 nm的近红外光照射后会发射自体荧光,波长主要集中于820 nm附近[12],且甲状旁腺组织的荧光强度明显高于甲状腺及周围组织[13]。通过激发光照射甲状旁腺疑似组织,再测量组织在820 nm波长附近的荧光强度值,可判断待测组织是否为甲状旁腺组织。
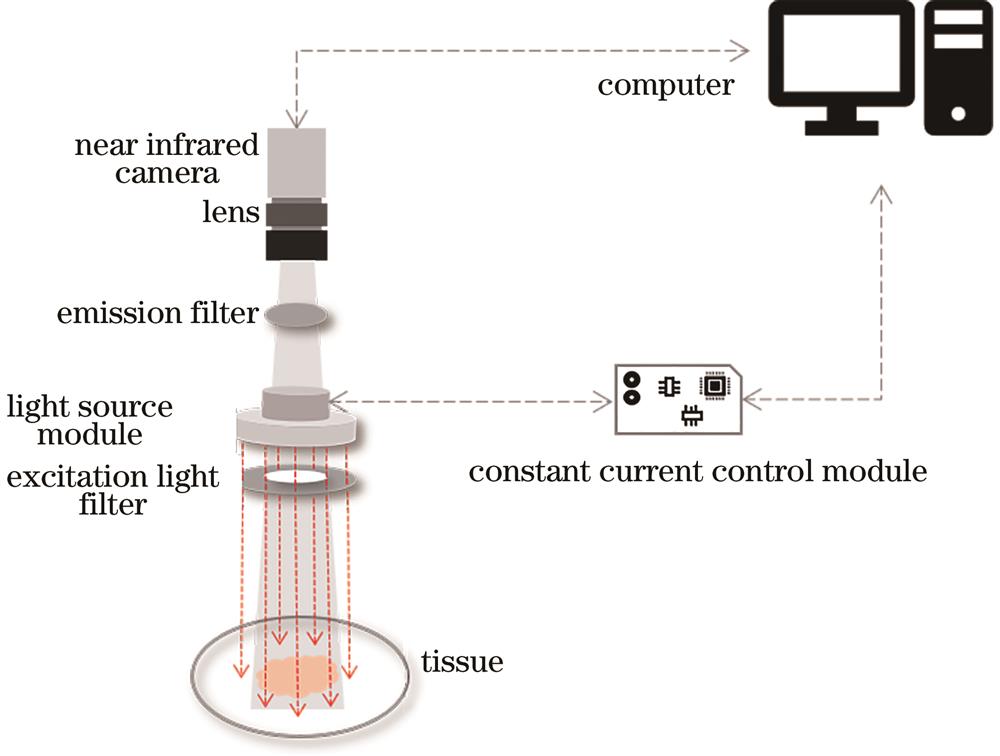
根据上述检测原理,设计了一种甲状旁腺识别系统,如
检测时,计算机控制开启甲状旁腺检测仪的激发光源和相机模块;等待系统初始化完成,将甲状旁腺检测仪对准待测组织区域,调整装置位置,使得术中画面清晰显示;对荧光图像进行采集处理,采用绿色标记指示甲状旁腺组织。
2.2 系统设计
选用一款合适的系统光源对光学成像系统至关重要。对于荧光成像,激发光源的光谱集中在荧光物质的吸收峰处是最理想的[14]。作为近红外荧光成像系统的激发光源应满足积分通量率高、可长时间工作、功率能精准控制等要求[15]。
LED光源具有高光效、窄带宽、抗震性、高稳定性、快速响应速度、低电压控制及环保的优点[14],逐渐在日常照明及荧光成像系统普及。LED光源由于存在波长范围较宽的问题,需要在光源前端加装相应的激发光滤光片,以滤除不必要的干扰信号。因此,本系统选择LED作为激发光源,LED中心波长为765 nm,半峰全宽为24 nm。为使光源模块集成在CMOS摄像头端,激发光装置采用环状设计,20个LED集成在环形电路板并均匀排列,能够有效地避免光路干扰。根据荧光的最大吸收光谱和发射光谱特性,分别定制了特定波段的窄带激发光滤光片和发射光滤光片。激发光滤光片波段是740~780 nm,形状与系统光源电路板相匹配,置于光源前端,主要用于限制激发光光谱范围。发射光滤光片为800 nm波段截止滤光片,与CMOS相机镜头内径相匹配,置于CMOS相机前端,用于滤除外界及LED激发光。
光源驱动电路一般分恒流驱动和恒压驱动,考虑到LED的伏安特性是非线性的,即LED两端的电压发生很小的变化就能导致LED的电流发生很大的变化,因此在本设计中,选用核心驱动芯片(LM3464,德州仪器)设计LED的恒流源驱动。LM3464型芯片具有很宽的输出范围,能够驱动单颗大功率LED,输入电压范围为6~30 V。通过设置精密采样电阻,可以调节输出电流,最大为700 mA,满足光源额定700 mA的设计。同时可通过DIM端与主控制板通信,实现LED的开关、模拟调光和脉宽调制(PWM)调光等功能。芯片内部设置有LED开路自然保护,具有很高的驱动效率。光源驱动电路如
2.3 系统性能评价参数
信噪比是评估图像质量的一种常用指标,信噪比的数值越大,图像的画面越清晰,从图像信号上来看,信噪比的大小代表着图像信号的连续性,是区分图像有用信号和噪声的重要参数,当信噪比数值大于20时,符合术中辨别的要求[16]。
本系统信噪比是信号均值与背景标准偏差的比值[17-18],计算公式为
式中:
信背比的概念来源于光谱学,对目标信号的显著程度进行量化,能直观地反映出目标信号与当前背景的平均灰度之比。信背比用来评价图像中目标的显著程度,在信噪比相近的条件下,信背比数值越高,目标信号的显示效果越显著。当信背比大于3时[19],才能辅助医生将术中目标组织与正常组织区分开[20]。信背比的公式为
式中:
2.4 图像增强
由于在图像采集过程中设备、光照、传输过程及荧光物质本身的强度会对图像最终成像效果产生不同程度的影响,因而需要对采集的图像进行图像增强处理,使得最终呈现的图像便于分析识别。首先通过线性变换,提高目标信号的荧光强度;再通过伪彩处理,增强目标信号的显著程度,使得最终呈现的图像显示效果更佳,更利于辨认识别。灰度级越大意味着图像对比度越高,图像清晰度越高,反之对比度越低视觉上清晰度就越低;增加原图各部分的反差,即将感兴趣的区域对比度增大,将其他区域的对比度压缩,相对抑制不感兴趣的灰度区域。通过线性变换,将灰度范围扩大到[0,255]。例如原图像的灰度范围为[a,b],变换后图像的灰度扩展到[c,d]:
由于人对灰度图像的识别敏感度比较低,而对彩色图像的微小差别极为敏感,辨别能力非常强,通过伪彩处理,可以有效地提取图形的信息,使得原图像的细节更加容易辨认,目标也能够更容易识别。对于伪彩图像,通过将原始灰度图像的各个不同灰度级按照线性或者非线性的映射函数变换成不同色彩通道,从而获得彩色图像,通过改变阈值,目标组织与其他组织区分度更高,显示效果更佳。
3 实验结果分析
3.1 系统测试
吲哚菁绿(ICG)是一种无菌水溶性的荧光染料,能够与血浆蛋白结合[21],在近红外光照射下,发射波长为810~830 nm[22],其与甲状旁腺的激发荧光波长接近,通过配置ICG梯度浓度液体仿体可以模拟各组织的不同荧光强度,进而验证系统对不同荧光强度的灵敏性与准确性。
本研究中的ICG液体仿体主要由ICG与血白蛋白按照不同比例配制而成。根据ICG等物质的特性,配置ICG梯度浓度溶液的步骤为:称取一定量的ICG粉末,溶于去离子水中,作为原液;分别吸取不同体积的原液于试管中稀释;最后分别吸取等量ICG稀释液、血白蛋白及生理盐水进行混合,涡旋振荡混匀。操作流程如
表 1. ICG溶液梯度质量浓度
Table 1. ICG solution gradient mass concentration
|
按照质量浓度由低到高,将ICG溶液顺时针依次滴入试剂槽中。试剂槽采用3d打印制作,尺寸为6 cm×6 cm×0.6 cm,试剂槽孔位为圆柱形。打开甲状旁腺识别系统,设置系统参数,并将系统调整到合适的位置,使得成像清晰且位于视野中央位置,此时采集图像,并进行图像处理、分析。采集的图像如

图 4. ICG溶液成像与荧光值变化。(a)ICG溶液成像图;(b)荧光强度与ICG质量浓度的关系
Fig. 4. ICG solution imaging and fluorescence value change. (a) ICG solution imaging diagram; (b) relationship between fluorescence intensity and ICG mass concentration
分别获取各质量浓度溶液灰度值及周围背景灰度值,并对数据进行分析处理,ICG溶液荧光值随ICG质量浓度变化而变化的情况如
对不同质量浓度溶液的信噪比(SNR)进行分析,结果如

图 5. 系统性能评价。(a)信噪比与ICG质量浓度的关系;(b)信背比与ICG质量浓度的关系
Fig. 5. System performance evaluation. (a) Relationship between SNR and ICG mass concentration; (b) relationship between SBR and ICG mass concentration
3.2 系统准确性验证
3.2.1 仿体实验
本实验所使用的组织仿体主要由荧光剂(配制的ICG溶液)、散射剂(二氧化钛)、吸收剂(牛血红蛋白)、琼脂和水按照不同比例制作而成[23-24]。组织仿体制作步骤如
将仿体置于系统下方,同时打开系统,设置系统参数,并将系统装置调整到合适的位置,使得成像图像清晰且位于视野中央位置,此时采集仿体荧光图像并进行处理。荧光仿体成像效果如
3.2.2 组织实验验证
为了进一步验证系统在甲状旁腺识别方面的可行性,分别对离体甲状旁腺、甲状腺及脂肪组织进行荧光检测,标本来自取材后废弃的病理标本(本研究已通过安徽医科大学第一附属医院伦理委员会审核批准,No.PJ2021-12-10)。将甲状旁腺、甲状腺、脂肪组织置于甲状旁腺识别系统下,打开系统光源,并调整焦距使得画面清晰,进行图像采集处理,结果如

图 8. 图像处理后组织成像结果。(a)组织荧光图像;(b)组织荧光均值
Fig. 8. Tissue imaging result after image processing. (a) Tissue fluorescence image; (b) mean tissue fluorescence
4 结论
基于近红外荧光成像,设计了一种甲状旁腺快速识别系统。系统采用近红外光源激发组织荧光,同时利用CMOS相机对组织荧光进行采集,并通过计算机对采集的组织荧光图像进行图像处理,实现对甲状旁腺疑似组织的识别。通过ICG液体仿体模拟组织荧光,展开信噪比和信背比实验,初步验证了系统针对820 nm波长附近荧光的高质量成像性能;通过仿体实验,对本研究所使用的图像算法进行实验验证;展开病理标本甲状旁腺及其他组织的对比实验,验证了本系统应用于甲状旁腺识别检测的可行性。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. International Journal of Cancer, 2015, 136(5): E359-E386.
[2] Sitges-Serra A, Ruiz S, Girvent M, et al. Outcome of protracted hypoparathyroidism after total thyroidectomy[J]. British Journal of Surgery, 2010, 97(11): 1687-1695.
[3] Marcinkowska M, Sniecikowska B, Zygmunt A, et al. Postoperative hypoparathyroidism in patients after total thyroidectomy-retrospective analysis[J]. Neuro Endocrinology Letters, 2017, 38(7): 488-494.
[4] Dedivitis R A, Aires F T, Cernea C R. Hypoparathyroidism after thyroidectomy: prevention, assessment and management[J]. Current Opinion in Otolaryngology & Head and Neck Surgery, 2017, 25(2): 142-146.
[5] Wang L, Yang D, Lü J Y, et al. Application of carbon nanoparticles in lymph node dissection and parathyroid protection during thyroid cancer surgeries: a systematic review and meta-analysis[J]. OncoTargets and Therapy, 2017, 10: 1247-1260.
[6] Patel H P, Chadwick D R, Harrison B J, et al. Systematic review of intravenous methylene blue in parathyroid surgery[J]. British Journal of Surgery, 2012, 99(10): 1345-1351.
[7] Das K, Stone N, Kendall C, et al. Raman spectroscopy of parathyroid tissue pathology[J]. Lasers in Medical Science, 2006, 21(4): 192-197.
[8] Paras C, Keller M, Mahadevan-Jansen A, et al. Near-infrared autofluorescence for the detection of parathyroid glands[J]. Journal of Biomedical Optics, 2011, 16(6): 067012.
[9] McWade M A, Paras C, White L M, et al. A novel optical approach to intraoperative detection of parathyroid glands[J]. Surgery, 2013, 154(6): 1371-1377.
[10] McWade M A, Paras C, White L M, et al. Label-free intraoperative parathyroid localization with near-infrared autofluorescence imaging[J]. The Journal of Clinical Endocrinology & Metabolism, 2014, 99(12): 4574-4580.
[11] Thomas G, McWade M A, Nguyen J Q, et al. Innovative surgical guidance for label-free real-time parathyroid identification[J]. Surgery, 2019, 165(1): 114-123.
[12] Ladurner R, Sommerey S, Arabi N A, et al. Intraoperative near-infrared autofluorescence imaging of parathyroid glands[J]. Surgical Endoscopy, 2017, 31(8): 3140-3145.
[13] McWade M A, Sanders M E, Broome J T, et al. Establishing the clinical utility of autofluorescence spectroscopy for parathyroid detection[J]. Surgery, 2016, 159(1): 193-203.
[14] Gioux S, Choi H S, Frangioni J V. Image-guided surgery using invisible near-infrared light: fundamentals of clinical translation[J]. Molecular Imaging, 2010, 9(5): 237-255.
[15] Gioux S, Kianzad V, Ciocan R, et al. High-power, computer-controlled, light-emitting diode-based light sources for fluorescence imaging and image-guided surgery[J]. Molecular Imaging, 2009, 8(3): 156-165.
[16] 杨军, 王成, 王云峰. 一种基于HVS模型的图像质量信噪比评价方法[J]. 河北科技大学学报, 2002, 23(4): 80-85.
Yang J, Wang C, Wang Y F. A SNR method of evaluating image quality based on the HVS model[J]. Journal of Hebei University of Science and Technology, 2002, 23(4): 80-85.
[17] 傅鹏, 孙权森, 纪则轩, 等. 一种遥感图像信噪比评估和度量准则[J]. 测绘学报, 2013, 42(4): 559-567.
Fu P, Sun Q S, Ji Z X, et al. A method of SNR estimation and comparison for remote sensing images[J]. Acta Geodaetica et Cartographica Sinica, 2013, 42(4): 559-567.
[18] 谢晨霞, 高万荣, 张越. 基于OCT成像信号振幅差分概率密度分布的图像散斑噪声抑制方法[J]. 中国激光, 2020, 47(12): 1207004.
[19] Jiang J X, Keating J J, Jesus E M, et al. Optimization of the enhanced permeability and retention effect for near-infrared imaging of solid tumors with indocyanine green[J]. American Journal of Nuclear Medicine and Molecular Imaging, 2015, 5(4): 390-400.
[20] Tummers W S, Warram J M, van den Berg N S, et al. Recommendations for reporting on emerging optical imaging agents to promote clinical approval[J]. Theranostics, 2018, 8(19): 5336-5347.
[21] 张雁琦, 张丽敏, 赵志超, 等. 基于自适应扩展卡尔曼滤波的吲哚菁绿药代动力学实验研究[J]. 中国激光, 2020, 47(9): 0907002.
[22] Landsman M L, Kwant G, Mook G A, et al. Light-absorbing properties, stability, and spectral stabilization of indocyanine green[J]. Journal of Applied Physiology, 1976, 40(4): 575-583.
[23] 张洋, 倪敬书, 张元志, 等. 组织固有荧光光谱复原算法及其在糖尿病筛查中的应用研究[J]. 中国激光, 2018, 45(7): 0707001.
[24] 张洋, 何腾超, 钟卫帅, 等. 血流介导组织荧光光谱测量系统及仿体验证[J]. 中国激光, 2021, 48(24): 2407001.
[25] Zheng S, Li H H, Lai K J, et al. Noninvasive photoacoustic and fluorescent tracking of optical dye labeled T cellular activities of diseased sites at new depth[J]. Journal of Biophotonics, 2018, 11(9): e201800073.
Article Outline
姚春晖, 张洋, 刘斌, 张持健, 郑家运, 王霞, 康旭, 王全福, 李忠胜, 刘勇, 董美丽, 王贻坤. 基于近红外自体荧光技术的甲状旁腺快速识别系统[J]. 激光与光电子学进展, 2023, 60(6): 0617003. Chunhui Yao, Yang Zhang, Bin Liu, Chijian Zhang, Jiayun Zheng, Xia Wang, Xu Kang, Quanfu Wang, Zhongsheng Li, Yong Liu, Meili Dong, Yikun Wang. Rapid Parathyroid Recognition System Based on Near-Infrared Autofluorescence[J]. Laser & Optoelectronics Progress, 2023, 60(6): 0617003.