光/磁热Fe2SiO4/Fe3O4双相生物陶瓷及其复合电纺丝膜制备及抗菌性能研究
组织缺损时由细菌引起的感染严重阻碍了组织修复的进程[1⇓-3], 给病人造成了极大痛苦。解决该问题的关键在于如何有效地抑制细菌增殖并促进组织再生[4]。因此, 开发一种既具有优异的抗菌性能, 又具有组织修复活性的生物材料对感染型组织缺损的修复具有重要意义。
在众多抗菌策略中, 热疗作为一种直接、快速和有效的方法受到了广泛关注[5⇓-7]。由于光热材料可在近红外光的照射下产生局部表面等离子体共振效应将光能转换为热能, 磁热材料可在交变磁场(AMF)中通过Néel-Brownian弛豫效应将电磁能转换为热能。目前, 人们已开发了大量光热和磁热材料用于抗菌研究。例如, Wu等[8]合成了具有优异光热性能的MoS2纳米颗粒, 可在808 nm近红外光照射下产生较高的温度, 破坏细菌壁的完整性、能量供应系统等, 从而起到高效杀菌作用。Chen等[9]报道Fe3O4纳米颗粒是性能优异的磁热材料, 并且Li等[10]证明了其在交变磁场中对大肠杆菌和金黄色葡萄球菌有显著的抗菌效果。但具有光热和磁热效应的材料在应用中均各自存在优势和缺陷。在光热方面, 光热材料通常具有较高的光热效率, 但近红外光在穿透皮肤或脂肪组织时大部分会被反射或吸收, 在体内的穿透深度极为有限。磁场虽然具有优异的组织通透性, 但磁热材料的热转化效率相对较低, 且临床对磁场强度及磁热试剂的注射剂量都有限制[11⇓-13]。因此, 开发兼具优异光热性能(加热效率高)和良好磁热性能(组织穿透性强)的材料, 有可能起到更好的杀菌作用。
另外, 组织修复活性是组织缺损修复材料的一个重要性能。然而, 目前大多数光热或磁热材料都不具有这一活性。已有大量研究证明硅酸盐生物活性玻璃/陶瓷释放的活性离子(如硅酸根离子)不仅能促进相关细胞的增殖、分化[14], 还能促进骨组织或软组织的修复[15-16]。例如, Mao等[17]证明硅酸盐生物陶瓷释放的锶和硅酸根离子可有效促进成骨和成血管, 可显著促进骨组织再生。Gao等[18]证明含硅酸盐生物玻璃的复合水凝胶可作为创面敷料, 有效促进血管形成和组织再生。为结合抗菌和组织修复性能, 本研究将探索合成兼具光热/磁热性能的硅酸盐生物陶瓷。
铁元素作为功能元素, 在不同状态下展现了不同的功能。大多数含铁材料都具有光热性能[13], 其中Fe3O4等还具有磁性[10]。此外, 铁元素作为人体内含量最多的微量元素, 不仅是血红蛋白的重要组成成分, 还可促进胶原的合成[19]。铁橄榄石(Fe2SiO4)已被证明具有良好的生物活性, 能显著促进慢性创面愈合[20]。这些研究显示, 铁元素有可能赋予硅酸盐材料良好的磁性、光热性和生物相容性。
基于上述进展, 本研究通过控制煅烧气氛合成了不同相组成的Fe/Si生物陶瓷, 研究了Fe/Si双相陶瓷粉体(Fe2SiO4/Fe3O4)的磁热、光热性能以及离子释放性能。在此基础上, 进一步制备了Fe/Si双相陶瓷粉体与聚己内酯/明胶复合的电纺丝膜。并通过体外细胞实验和抗菌实验, 进一步研究了该复合膜材料的细胞相容性及光磁热抗菌效果。
1 实验方法
1.1 实验试剂
研究所采用的试剂正硅酸四乙酯((C2H5O)4Si, TEOS)、硝酸(HNO3)、乙二醇((CH2OH)2)、聚己内酯(PCL)、明胶(Gelatin)均购自国药集团上海化学试剂有限公司; 醋酸铁(II)(Fe(C2H3O2)2)购自阿拉丁公司; CCK-8检测试剂盒购自碧云天生物技术(中国)公司。所有市售试剂和溶剂均直接使用, 未经进一步纯化。
1.2 材料合成
1.2.1 陶瓷粉体制备
首先, 将TEOS加入2 mol/L的HNO3去离子水溶液中搅拌30 min, 使TEOS被催化水解。其中TEOS、水和HNO3的摩尔比为1 : 8 : 0.16。将醋酸铁(II)和乙二醇以摩尔比1 : 20的比例混合, 搅拌30 min以充分溶解。随后, 将醋酸铁(II)乙二醇溶液加入TEOS混合液中进一步反应(其中TEOS与Fe(C2H3O2)2摩尔比为1 : 2)。在Ar气氛保护下, 将混合反应物在室温下搅拌5 h, 得到溶胶。然后, 在Ar气保护下密封溶胶, 并在60 ℃下保温24 h, 形成湿凝胶, 再在真空烘箱中120 ℃干燥24 h, 得到干凝胶。将该干凝胶研磨, 在不同气氛下置于管式炉中800 ℃煅烧3 h。将煅烧后的粉末进行研磨、筛分。通过充入氩气排除空气, 降低炉内的氧气含量以达到控制煅烧气氛的目的。没有氩气充入的条件记为条件1; 充入氩气至炉内,使气压达到10、25、>25 kPa的条件下,分别记为条件2、3、4。(图2)。在气氛条件1、2、3、4下煅烧得到的粉体(FF)产物分别记为FF-1、FF-2、FF-3、FF-4。
1.2.2 复合电纺丝膜制备
对粉体性能进行测试和分析后, 选用光热、磁热和离子释放性能都良好的FF-2粉体制备复合静电纺丝膜。首先, 分别将0、0.1、0.2、0.3和0.4 g的FF-2粉体与0.5 g PCL和0.5 g明胶混合加入10 mL的1,1,1,3,3,3-六氟-2-丙醇中, 通过超声以及磁力搅拌12 h, 使粉体在混合液体中均匀分散。将混合液装入10 mL注射器中作静电纺丝(流速0.02 mL·min-1,电压8~10 KV, 固定接受距离为15 cm), 在静电纺丝的过程中使喷头匀速左右来回移动, 使纤维丝在接收器表面均匀沉积。得到粉体复合量为0、10%、20%、30%和40%的电纺丝膜, 分别标记为FG-0、FG-10、FG-20、FG-30、FG-40。使用直径为10 mm的打孔器将静电纺丝复合膜制备成直径为10 mm的圆形薄膜以备后续实验使用。
1.3 材料的性能表征
使用热重分析仪(TG-DTA, Netzsch STA 449C)对凝胶粉体在不同气氛下的热稳定性及相转变温度进行表征。采用XRD(Rigaku D/Max-2550V)分析所有FF粉体的物相组成; 用振动探针式磁强计(MPMS XL5)测试各种FF粉体的磁性; 利用红外热像仪对所有FF粉体的光热和磁热升温性能进行表征; 将粉体浸入ECM培养基中(0.2 g·mL-1), 置于37 ℃恒温摇床(120 r·min-1), 24 h后取上清液, 采用电感耦合等离子体发射光谱仪(ICP-OES, Varian 715-ES, Agilent)检测所有粉体释放铁和硅酸根离子的性能。根据磁热、光热以及离子释放性能结果分析, 选取光热、磁热和离子释放性能都良好的FF-2粉体作进一步实验。用激光粒度仪(Bettersize2600)对FF-2粉体的粒径进行测试; 采用透射电镜(TEM, Tecnai G2 F20, FEI Electron Optics)对FF-2粉体作高分辨观察和分析; 利用红外热像仪对静电纺丝复合膜的光热和磁热升温性能进行表征; 使用场发射电子扫描电子显微镜(SEM, S-4800, Hitachi)观察FF-2粉体和静电纺丝复合膜的表面微观形貌。将直径为10 mm的静电纺丝复合膜圆片放入ECM培养液中, 放入恒温摇床, 24 h后取上清液, 检测复合膜释放铁和硅酸根离子的性能。
1.4 光热和磁热性能测试
在干燥环境下, 将FF粉体置于直径为10 mm的专用容器中研究其光热/磁热效应。首先, 取0.05 g粉体在波长为808 nm的近红外激光(VLSM-808-B, 上海瀚宇光纤通信技术有限公司)照射下, 通过热像仪(A325sc, FLIR)实时监测和记录粉体的温度变化, 以评估其光热特性。同样, 在交变磁场中(高频感应加热设备SPG800K2-10(A)B, 深圳市双平电源技术有限公司)记录粉体的温度变化, 以评估其磁热特性。为研究复合电纺丝膜的光热与磁热性能, 将直径为10 mm的圆形复合薄膜放入48孔细胞培养板中, 并加入0.3 mL去离子水, 然后用808 nm近红外激光或者交变磁场评估其光磁热性能。本实验所用的激光功率密度均为0.36 W·cm-2, 交变磁场频率为506 kHz、强度为837 A·m-1。激光和交变磁场的处理时间均为10 min。统一用红外热成像系统实时记录温度, 并用FLIR软件导出时间-温度曲线数据。
1.5 细胞粘附
实验选用人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cell, HUVEC)研究FG-30静电纺丝复合膜对细胞的黏附及形态的影响。
a)采用直径为10 mm的打孔器将FG-0和FG-30静电纺丝复合膜制备成直径为10 mm的圆形膜片, 放入48孔细胞培养板中, 用钛环固定。最后放入紫外交联仪中紫外灭菌4 h。
b)在灭菌后的静电纺丝复合膜上种植HUVEC, 每孔接种5×104个细胞。在37 ℃、5% CO2浓度的恒温细胞培养箱中培养24 h后, 选用4%的多聚甲醛溶液固定细胞, PBS洗涤3次后, 采用梯度浓度酒精(30%、40%、50%、60%、70%、80%、85%、90%、95%、100%)和六甲基二硅氮烷(HDMS)脱水, 然后放入通风橱中过夜干燥。最后利用SEM观察静电纺丝复合膜上粘附的细胞形貌。
1.6 细胞增殖
实验共设置3组, 分别为空白对照组(Blank)、加FG-0膜组(FG-0)和FG-30膜组(FG-30)。将细胞以2.0×103个/孔的密度接种于48孔细胞培养板中, 待细胞贴壁后, 将灭菌后的FG-0膜和FG-30膜小心放置于细胞的上方, 每组4个平行样, 隔天换液。到达预设的时间点(1、3和5 d)时, 加入10%的CCK-8试剂, 再置于培养箱内孵育1.5 h后, 用酶标仪(Epoch, BIO-TEK)检测450 nm处吸光度。
1.7 抗菌实验
实验采用菌落计数法研究了光热、磁热及光-磁热联合治疗对金黄色葡萄球菌(Staphylococcus aureus, S. aureus.)的抑制效果。
设置空白对照组 (Blank)、FG-0膜对照组, 设置FG-30膜、FG-30膜加光热(FG-30(PTT))、FG-30膜加磁热(FG-30(MTT))、FG-30膜加光热和磁热(FG-30(PTT+MTT))为实验组。激光和交变磁场的处理时间均为15 min。每孔加入0.1 mL OD (Optical Density, 600 nm)值为0.01的S. aureus.细菌悬浮液共培养12 h; 将共培养后菌液用PBS缓冲液稀释104倍后取25 µL均匀涂于琼脂培养板, 每组做3个平行样。培养16 h后对细菌培养板进行拍照, 统计菌落个数, 并根据以下公式计算抑菌率(I)。
其中, N0是Blank组的菌落数量, N是实验组的菌落数量。
2 结果与讨论
2.1 FF生物陶瓷粉体的制备及性能表征
用热分析法TG-DTA探索气氛对凝胶粉体的热稳定性及相转变温度的影响, 发现在空气氛围下320 ℃左右DTA曲线有1个明显的放热峰, DTG曲线上对应的位置也有一个正的峰值(图1(a)), 说明此温度下发生了重量增加的放热反应。由此推断在此温度下发生氧化反应, 结合XRD的结果(图2)可以推断在有氧气存在的情况下320 ℃左右, Fe2+被氧化成Fe3+并生成Fe3O4。从图1(b)的DTA曲线可以看出在氩气气氛下600 ℃左右有个宽的放热峰, 而从DTG曲线来看没有质量的变化, 说明此处发生了相变。结合XRD结果(图2), 可以推断出在氩气气氛下600 ℃左右开始生成Fe2SiO4相。
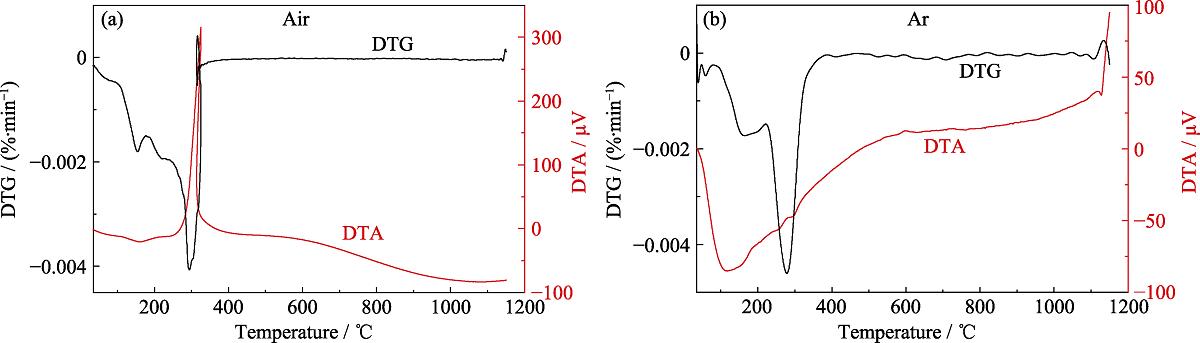
图 1. (a)空气气氛和(b)氩气气氛中凝胶粉体的TG-DTA曲线
Fig. 1. TG-DTA curves of gel powders tested in (a) air and (b) argon atmosphere

图 2. 800 ℃不同气氛条件下FF煅烧产物的XRD图谱
Fig. 2. XRD patterns of FF products calcined at 800 ℃ in different atmospheres
本实验通过控制氩气的充入量改变煅烧气氛, 从而得到不同物相组成的样品。从煅烧产物的XRD分析结果(图2)可以看出, 产物中出现了Fe2SiO4和Fe3O4两种晶相组成。并且通入氩气的量越多, 产物中Fe2SiO4含量越多, Fe3O4含量越少。根据XRD图谱中的峰面积对结晶相中Fe3O4含量进行半定量计算分析, 发现FF-1、FF-2、FF-3、FF-4粉体中Fe3O4含量分别为100%、45%、10%、0。
不同条件下制备的FF粉体的离子释放量见表1。所有粉体产物都释放铁和硅酸根离子, 24 h内从FF-1粉体释放铁离子43.96 μg·mL-1、硅酸根离子70.12 μg·mL-1; 从FF-4粉体释放Fe离子5.76 μg·mL-1、硅酸根离子12.68 μg·mL-1。此结果显示随着产物中Fe2SiO4含量的增加, 离子释放速率显著减小, 说明控制产物相组成可控制离子释放的规律。考虑到XRD结果显示FF-1粉体中只有Fe3O4相并没有出现含硅的结晶相(图2), 但离子释放实验显示样品有硅的释放, 说明FF-1粉体中硅以非晶态形式存在。磁性分析结果进一步显示(图3(a)), 随着充入氩气量的增加, 产物的磁性越来越弱, 可能是因为产物中的Fe3O4为主要磁性成分, 而Fe2SiO4没有磁性。产物的磁热性能如图3(b)所示, 其磁热性能结果趋势与磁性结果类似, 都是随着产物中Fe3O4含量的降低而减弱。而产物的光热性能如图3(c)所示, 所有粉体产物都有较好的光热性能, 说明产物的相组成对其光热性能并没有显著的影响。综合考虑, 本实验选择了光热和磁热性能以及离子释放性能都较好的FF-2粉体(充入氩气至炉内气压10 kPa的条件下800 ℃煅烧3 h)作后续研究。
表 1.
不同条件下粉体产物在ECM中24 h的离子释放量
Table 1. Ion release of powders prepared under different conditions after 24 h being submersed in cell culture medium ECM
|

图 3. 不同煅烧条件制备的粉体产物的磁热和光热性能
Fig. 3. Magnetothermal and photothermal properties of powder products after being calcined under different conditions (a) Magnetic analysis results; (b) Results of thermal performance of different powders under alternating magnetic field intensity of 506 kHz at 837 A·m-1; (c) Photothermal performance of different powders under 808 nm near-infrared light irradiation at a density of 0.36 W·cm-2. FF-1: the product obtained by calcining without argon gas; FF-2-FF-4: the product obtained by calcining with argon gas at 10, 25 and >25 kPa in the furnace, respectively. 1 emu=103 A·m-1, 1 Oe=1000/4π A/m
如图4所示, 对FF-2粉体的粒度进行表征分析, 结果显示粉体的粒径主要分布在1~45 μm之间。为了进一步分析FF-2粉体以及表面形貌与成分组成, 利用SEM和TEM对其进行观察(图5(a, b))。粉体表面粗糙有细小孔隙。粉体的TEM高分辨照片 (图5(c))中出现了三种取向的晶格条纹, 通过计算晶格间距并与标准卡片进行对比, 确定这三种晶格条纹分别为Fe3O4的(011)和(020)晶面, 以及Fe2SiO4的(111)晶面。另外, 电子衍射图像(图5(c)插图)中出现了非晶衍射晕, 推测FF-2中有部分硅以非晶形式存在。
2.2 复合膜的形貌及离子释放性能
图6(a)为不同FF-2粉体含量(0、10%、20%、30%、40%)的复合静电纺丝纤维膜光学照片。随着粉体含量增大, 静电纺丝膜的颜色逐渐加深。SEM的结果(图6(b))也可以看出越来越多的粉体颗粒掺入纺丝纤维中。

图 6. 不同FF-2粉体含量的复合电纺丝膜的形貌
Fig. 6. Morphologies of composite electrospun membranes with different FF-2 powder compositing amounts
不同FF-2粉体含量的复合静电纺丝纤维膜的离子释放结果如表2所示。结果显示, 含有粉体的复合膜也能释放出铁和硅酸根离子。且随着粉体含量增大, 复合膜的离子释放量也逐渐增加。从结果来看, 不含粉体的电纺丝膜不释放铁和硅酸根离子, 而粉体含量40%的复合膜24 h内释放铁离子达0.61 μg·mL-1和硅酸根离子达5.98 μg·mL-1。该结果证实控制粉体复合量可以有效控制复合膜的离子释放。粉体复合量30%的复合膜释放的铁和硅酸根离子浓度分别为0.32和2.76 μg·mL-1, 与文献报道的铁和硅酸根离子活性浓度相近[21-22]。
表 2.
不同粉体含量的复合电纺丝膜的离子释放性能
Table 2. Ion release properties of composite electrospun films with different powder contents in cell culture medium ECM
|
2.3 复合膜的光热、磁热性能
复合膜的光热及磁热性能表征结果(图7)显示, 在固定功率密度为0.36 W·cm-2的激光照射下, 粉体复合量为0的电纺丝膜的表面温度维持在26 ℃左右, 而粉体复合量为40%的复合膜表面温度可升高到55 ℃左右。从(图7(a))结果可以看出在相同功率密度激光照射下, 随着粉体含量增加, 复合膜表面最高温度逐渐升高, 证明复合膜的光热性能随着粉体含量的增加而增强。磁热实验也有相似的结果(图7(b)), 在固定的交变磁场中(506 kHz, 837 A·m-1), 随着粉体含量增加, 处于交变磁场中的复合膜表面最高温度也逐渐升高, 不含FF-2粉体的纤维膜的表面温度维持在23 ℃左右, FF-2粉体复合量为40%的复合膜表面最高温度能升高到46 ℃。证实复合膜的磁热性能随着粉体含量增加而增强。另外,从图7(a, b)的结果可以看出, 30%粉体含量的复合膜在本实验所使用的激光(0.36 W·cm-2)和交变磁场(506 kHz, 837 A·m-1)条件下可分别升温至42和48 ℃左右。而在激光和交变磁场叠加的情况下, 30%粉体含量的复合膜可以升温至60 ℃左右(图7(c))。该结果证明, 温和强度下的激光和磁场叠加可以协同使材料发挥更强的热效应。因此本研究对粉体含量为30%的复合膜(记为FG-30)进行细胞相容性和抗菌性能的研究。

图 7. 不同粉体含量的复合膜的光热和磁热性能
Fig. 7. Photothermal and magnetothermal properties of composite membranes with different powder contents
2.4 FG-30复合膜的细胞相容性
为了研究静电纺丝复合膜的生物性能, 采用HUVEC研究了FG-30复合膜对细胞粘附和增殖的影响(图8)。与FG-0组相比, FG-30复合纺丝膜上的HUVEC粘附更多, 并铺展良好, 细胞伪足伸展更为明显。这说明与未复合粉体的FG-0膜相比, 有粉体复合的FG-30复合膜具有更优异的促细胞粘附作用(图8(d~f))。从增殖实验的结果(图8(g))可以看出, 与对照组相比, FG-30复合膜能明显促进内皮细胞增殖。Xing等[23]证实硅酸根离子对细胞周期有刺激作用, 促进细胞S和G2/M期, 使其具有更高的增殖活性。Zhang等[24]也证实铁离子可以促进内皮细胞增殖。考虑到本研究已经证实复合膜具有离子释放性能, 可以有效释放铁和硅酸根离子, 因此, 可以推知FG-30静电纺丝复合膜具有良好的细胞相容性是因其通过释放活性铁和硅酸根离子促进了细胞的粘附和增殖[21-22]。为进一步证明静电纺丝复合膜在组织损伤修复方面的应用, 后续还需进行深入的生物学评价, 包括细胞成血管基因表达及体内动物创伤模型实验验证。

图 8. FG-30复合电纺丝膜的细胞相容性
Fig. 8. Cytocompatibility of FG-30 composite electrospun membranes
2.5 FG-30复合膜光-磁热抗菌性能表征
为了研究复合膜的光/磁热抗菌性能, 选用S. aureus作为实验菌种, 并根据上述实验结果选用FF-2粉体复合的FG-30复合膜为研究对象。设置了空白对照、FG-0膜、FG-30膜、FG-30膜加磁热、FG-30膜加光热、FG-30膜加光/磁热六组。从实验结果可以看出(图9), 在温和强度的交变磁场中(506 kHz, 837 A·m-1), 复合膜没有明显的抑菌作用。温和的激光(0.36 W·cm-2)照射下复合膜的抑菌能力也很微弱。而在温和的交变磁场与激光联合作用下, 复合膜表现出显著的抗菌作用, 其抑菌效果远大于温和的激光与交变磁场单独作用的效果。这可能是因为在温和的交变磁场和激光单独作用时, 只能使复合膜升温至42和48 ℃左右, 该温度下细菌在短时间(15 min)内并不会产生有效的杀菌效果; 而在交变磁场与激光联合作用下, 能使温度升高至60 ℃左右, 这个温度足以抑制细菌增殖[25]。研究发现, 温度升高不仅导致细菌细胞膜渗透性增加、蛋白质合成降低, 还会增加自溶和菌壁损伤, 从而起到抗菌作用[26]。可见, 光热与磁热联合作用可使复合膜在温和的激光和较低的交变磁场强度下展现出显著的抗菌效果。

图 9. FG-30复合膜对金黄色葡萄球菌的光/磁热联合抑制作用
Fig. 9. Combined photo/magneto-thermal inhibition of S.aureus by FG-30 composite membrane
3 结论
本研究通过控制煅烧气氛成功制备了既有光热又有磁热性能且离子释放性能可控的Fe2SiO4/Fe3O4双相复合陶瓷粉体。在此基础上, 采用PCL和明胶与双相复合陶瓷粉体复合, 成功制备了陶瓷粉体复合的电纺丝膜, 并证实该复合膜兼具光热和磁热特性, 而且通过调节粉体的复合量可有效调节复合膜的光热、磁热性能以及离子释放性能。粉体复合量为30%的FG-30复合膜具有良好的细胞相容性, 且在温和的激光与交变磁场联合作用下具有显著的抑菌效果。因此, Fe2SiO4/Fe3O4双相生物陶瓷及其复合材料在光/磁热抗菌、促进生物组织修复方面具有潜在应用前景。
[2] FALANGA V. Wound healing and its impairment in the diabetic foot[J]. Lancet, 2005: 1736-1743.
[18] GAO L, ZhOU Y L, PENG J L, et al. A novel dual-adhesive and bioactive hydrogel activated by bioglass for wound healing[J]. NPG Asia Materials, 2019.
Article Outline
盛丽丽, 常江. 光/磁热Fe2SiO4/Fe3O4双相生物陶瓷及其复合电纺丝膜制备及抗菌性能研究[J]. 无机材料学报, 2022, 37(9): 983. Lili SHENG, Jiang CHANG.





