α-Ni(OH)2表面羟基协同Ni3+位点催化氧化甲醛机理研究
由于家装制品、涂料、涂层中挥发性有机物的持续释放, 室内空气污染愈加严重, 已成为影响人类生命健康的首要因素之一[1-2]。甲醛作为重要的化工原料[3], 广泛存在于各种家装材料中, 其释放周期超过20年, 是室内空气的主要污染物之一。长期接触甲醛会对人体健康造成严重的危害[4], 特别是在潜艇、空间站等密闭环境中, 甲醛持续积累会毒害人体中枢系统和呼吸系统。因此, 净化甲醛对提高人们的生活质量和保障社会的可持续发展必不可少。传统甲醛是通过活性炭吸附来去除[5], 然而活性炭吸附饱和后又会重新释放甲醛, 进而造成二次污染。以氧气为氧化剂的催化氧化技术可在室温常压下深度净化甲醛[6⇓⇓⇓-10]。在催化材料表面, 甲醛经历吸附-分解-解吸的过程, 最终形成水和二氧化碳, 无需外加能量。因此, 催化氧化技术成为解决室内甲醛污染的理想技术之一。目前催化氧化甲醛材料主要包括贵金属催化材料和过渡金属催化材料[11⇓-13]。其中, 贵金属净化效果好但价格昂贵, 而过渡金属价格低但净化效果差。因此, 开发高效的过渡金属催化材料, 是实现催化氧化甲醛技术实际应用的途径之一。
甲醛的氧化过程主要围绕C-H键的逐步断裂。一般认为, 氧气在催化材料表面得到电子, 其O=O键断裂形成活性氧原子, 攻击C-H键, 从而氧化甲醛形成二氧亚甲基(Dioxymethyl, DOM)、甲酸盐等中间体, 最终转变为二氧化碳和水[14-15]。近年来, 研究发现表面羟基降低了DOM和甲酸盐氧化能垒[16-17], 对甲醛深度氧化起着重要作用。因此, 金属氢氧化物表面丰富的羟基在氧化甲醛方面具有优势。其中, 氢氧化镍(Ni(OH)2)具有比表面积大、制备简单、成本低廉等特点, 受到了广泛关注。Ni(OH)2的结构主要有α相和β相, 其中, α-Ni(OH)2的层间距较大, 水分子和一些小半径的离子可以嵌入层间, 因而α-Ni(OH)2具有比β-Ni(OH)2更优异的层间化学性质和理论活性[18-19]。除此之外, α-Ni(OH)2表面H原子有利于形成强氧化性羟基自由基, 从而提高催化氧化效率[20-21]。因此, α-Ni(OH)2有望提升催化氧化甲醛性能, 助推催化氧化甲醛技术的实际应用。
本研究采用水热法制备了α-Ni(OH)2, 并通过模拟的室内低浓度甲醛氧化测试装置评价α-Ni(OH)2催化氧化活性, 并结合原位红外光谱和理论计算分析, 提出了α-Ni(OH)2催化氧化甲醛机理。
1 实验方法
1.1 α-Ni(OH)2的制备
首先, 将7.492 mmol的尿素和1.870 mmol的六水合硝酸镍混合, 并溶解到30 mL的溶液中。搅拌1 h后, 将得到的均匀溶液转移到50 mL的聚四氟乙烯内衬高压釜中, 并在120 ℃下加热4 h。然后将冷却的样品洗涤数次(水和乙醇交替洗), 离心并在 50 ℃真空下干燥得到α-Ni(OH)2。实验通过改变镍源和溶剂来优化α-Ni(OH)2的性能。其中, 以水、乙醇、乙二醇、丙二醇和丁二醇为溶剂合成的α-Ni(OH)2样品分别标记为: α-Ni(OH)2-water, α-Ni(OH)2-E, α-Ni(OH)2-EG, α-Ni(OH)2-PG和α-Ni(OH)2-BG。材料表征详见补充材料。
1.2 催化材料活性评价
通过实验室自主搭建的催化氧化甲醛装置评估样品催化氧化性能: 首先调节流量计大小, 控制气体(空气和甲醛)总流速维持在1.5 L/min, 并通过气流带动水汽, 保持反应器内湿度为60%, 再利用电加热套将反应器温度维持在25 ℃左右; 然后将0.1 g样品均匀分散在ϕ3 cm×3 cm的三聚氰胺海绵中, 放入ϕ3 cm的不锈钢反应器中。通入甲醛气体(浓度为2 μL/L), 并用甲醛检测仪(BN-T1000, 山东)检测反应器出口处的甲醛浓度; 最后通过公式(1)计算样品的甲醛催化氧化能力。
其中, C和C0分别代表着反应器出口处和初始的甲醛浓度。
2 结果与讨论
2.1 催化材料活性测试
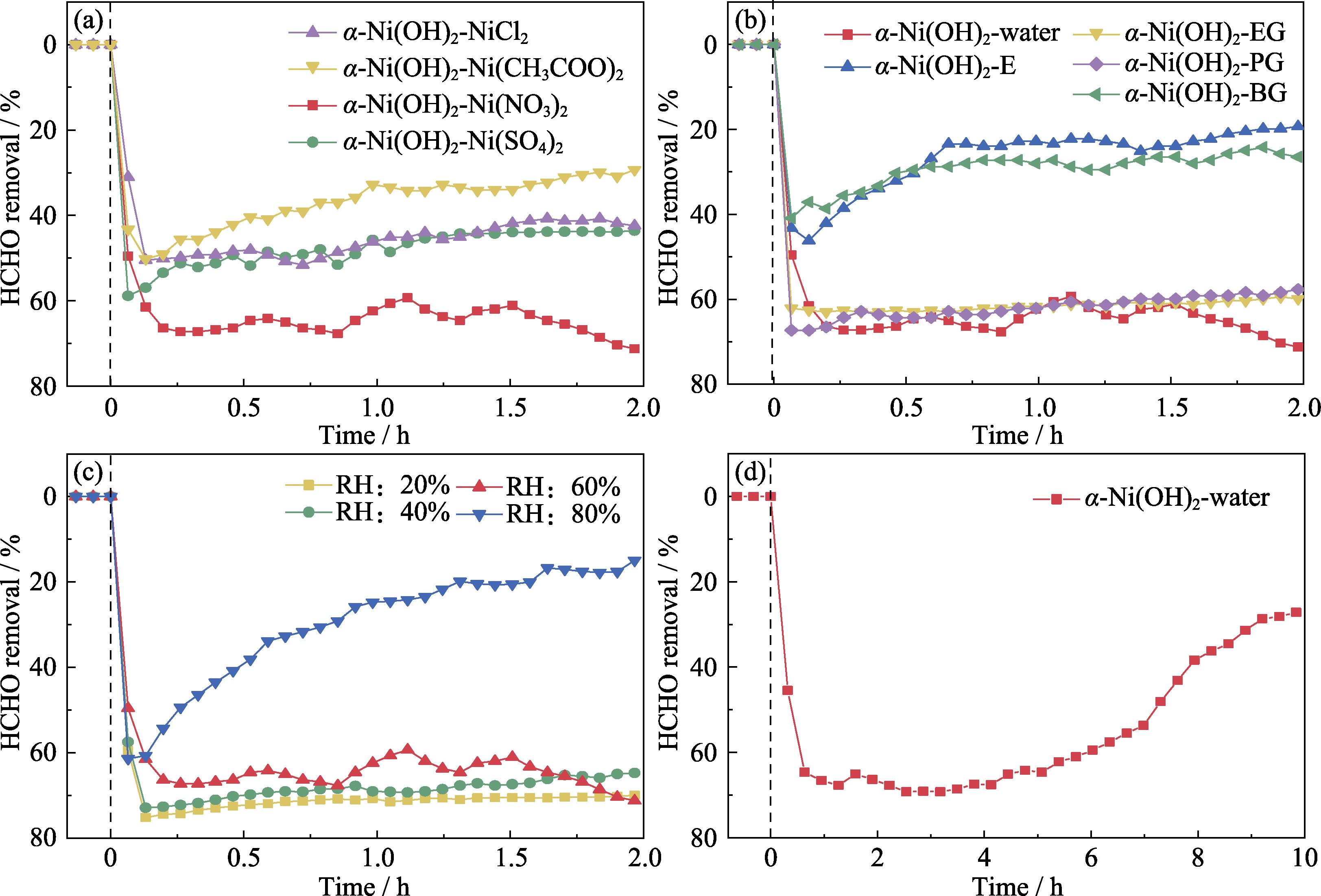
通过自制的催化氧化甲醛活性评价系统对不同样品进行了测试。如图1所示, 采用不同镍盐制备的α-Ni(OH)2具有不同的活性, 其中以氯化镍、乙酸镍和硫酸镍为镍源制备的α-Ni(OH)2在2 h内对甲醛的去除率分别为42.4%、29.3%和43.6%, 均低于以硝酸镍为镍源制备的α-Ni(OH)2(71.2%)。而以乙醇、乙二醇、丙二醇、丁二醇为溶剂制备的α-Ni(OH)2对甲醛的去除率分别为19.3%、59.9%、57.7%和26.5%, 均低于以水为溶剂制备的α-Ni(OH)2(71.2%)。值得一提的是, 空白对照实验中仅存在载体三聚氰胺对甲醛的吸附, 且在吸附饱和后甲醛浓度迅速上升至100%, 证实甲醛在催化材料表面发生了催化氧化反应(图S1)。除此之外, 在相同条件下, α-Ni(OH)2的活性高于β-Ni(OH)2(25.8%)和常用的MnO2催化材料(18.8%)(图S2)。上述结果表明, 以硝酸镍为镍源、水为溶剂得到的α-Ni(OH)2催化氧化甲醛的性能最优。图1(c)为α-Ni(OH)2-water在不同湿度下的催化氧化甲醛活性。当相对湿度为20%~60%时, 催化活性没有明显变化, 均在70%左右; 而当湿度提高到80%时, 催化活性显著下降至14%, 这可能是由于水分子与反应物竞争吸附导致催化材料活性位点失活。图1(d)为α-Ni(OH)2-water长时间催化氧化甲醛活性。在催化4 h以内, 催化氧化甲醛活性并没有太大的变化, 但是催化5 h以后, 催化氧化活性显著下降。这可能是由水分子或者中间产物在活性位点上积累导致。以上分析表明α-Ni(OH)2-water具有优异的催化氧化甲醛性能。
2.2 催化材料结构和形貌表征
图2为不同溶剂制备的α-Ni(OH)2的XRD图谱。如图所示, 以水为溶剂制备的样品在2θ=12.0°、24.3°、32.9°和58.5°处的四个特征衍射峰分别归属于α-Ni(OH)2 (JCPDS 38-0715)的(003)、(006)、(101)和(110)晶面, 证明实验成功制备了α-Ni(OH)2[22-23]。当溶剂为乙醇、乙二醇、丙二醇和丁二醇时, α-Ni(OH)2的结晶度发生了明显的变化, 且(003)和(006)晶面的衍射峰发生偏移, 表明不同溶剂修饰改变了α-Ni(OH)2的微观结构, 特别是不同的插层离子使催化材料的层间距发生了明显变化[23], 进而影响催化活性。

图 2. 不同溶剂制备α -Ni(OH)2的XRD图谱
Fig. 2. XRD patterns of α -Ni(OH)2 prepared by different solvents
采用扫描电镜(SEM)和透射电镜(TEM)观察α-Ni(OH)2-water的微观形貌和结构。图3(a)α-Ni(OH)2-water的SEM照片中,状形貌由松针状短α-Ni(OH)2-water呈现不规则的球形形貌, 直径介于1~6 μm之间。样品的TEM照片(图3(b))显示, 其球片堆叠形成。这种形貌会影响样品的比表面积, 进而影响其气体吸附和活性位点的暴露。

图 3. α -Ni(OH)2-water的SEM(a)和TEM(b)照片
Fig. 3. SEM (a) and TEM (b) images of α -Ni(OH)2-water
通过X射线光电子能谱(XPS)研究了α-Ni(OH)2- water的表面化学组成和元素价态。如图4所示, α-Ni(OH)2-water的C1s存在三个吸收峰, 在284.8、287.5和289.2 eV处的峰分别归属于C-C、C-O和O-C=O键[24-25]。上述官能团主要来源于尿素前驱体的水解。此外, α-Ni(OH)2-water的O1s位于530.9和532.2 eV处的峰分别归属于Ni-OH和水分子[26-27], Ni2p在855.4 eV处的峰分别代表α-Ni(OH)2及其卫星峰, 而位于856.9 eV的峰对应Ni3+[28-29], 它通常被认为是催化氧化的活性位点[30-31]。实验还测试了不同条件处理后α-Ni(OH)2-water的XPS图谱。从图4(d)中可以看出, 甲醛气氛(甲醛浓度为2 μL/L, 平衡气体为氮气)下, 样品的Ni3+比例从0.41(反应前样品的Ni3+比例)降低到0.31; 在氧气气氛(氧气浓度为20%, 平衡气体为氮气)下, 样品的Ni3+比例增加至0.61; 而在甲醛和氧气气氛(甲醛浓度为2 μL/L, 氧气浓度为20%, 平衡气体为氮气)下, 样品的Ni3+比例介于前两者之间(0.59)。结合吡啶红外中丰富的Lewis酸位点(Ni2+或者Ni3+位点, 图S3), 推测在甲醛氧化过程中, 强氧化性的Ni3+作为催化氧化活性中心参与反应。对比不同溶剂制备的样品XPS图谱可以发现(图S4~S6), 不同溶剂影响了表面碳物种的类型以及官能团和元素价态的结合能, 特别是Ni3+/Ni2+的比值变为0.50(α-Ni(OH)2-E)、0.62(α- Ni(OH)2-EG)、0.52(α-Ni(OH)2-PG)和0.52(α-Ni(OH)2- BG)。尽管Ni3+是催化氧化的活性中心, 但是其比例与活性不一致, 这可能是由于催化活性同时受多个因素影响所致。图S7为不同样品的傅里叶变换红外光谱(FT-IR), 分析发现在3500 cm-1以及1200~1700 cm-1的峰主要来自于水分子和α-Ni(OH)2的O-H键[32], 而在2180 cm-1的峰归属于前驱体尿素水解产生的C=O键[33]。而不同溶剂制备样品的峰强和峰位置都发生了改变, 且1200~1700 cm-1属于O-H键的峰减弱。图S8为不同样品的热重分析, 从图中可以看出, 在100 ℃以下和100~250 ℃范围的质量损失来自于表面吸附水和结晶水脱附, 且α-Ni(OH)2-water, α-Ni(OH)2-EG和α-Ni(OH)2-PG的失重幅度最大; 250 ℃以上显著的质量损失归因于α-Ni(OH)2分解形成氧化镍。结合红外光谱和热重分析, 表面羟基与催化活性存在一定的关联。基于以上分析可以推测, 表面羟基与样品中的Ni3+有助于甲醛的氧化。
2.3 催化氧化甲醛机理分析
催化氧化甲醛过程包括吸附和氧化两个主要过程[34], 其中, 甲醛吸附受到催化材料比表面积的影响[35]。图S9为以水和丙二醇为溶剂制备的α-Ni(OH)2的N2吸脱附等温线, 两种样品均表现出典型的IV型等温线, α-Ni(OH)2-water呈现H3滞回线, 而α-Ni(OH)2-PG呈现H2回滞线[36]。α-Ni(OH)2-water的比表面积(125.4 m2/g)小于α-Ni(OH)2-PG(257.7 m2/g), 这与活性结果不一致, 表明比表面积不是造成催化活性差异的关键因素。
图5为α-Ni(OH)2-water催化氧化甲醛的原位红外光谱图。从图5(a)中可以看出, 在1725和1663 cm-1的峰来自于吸附的甲醛和H2O[37-38], 1200~1400 cm-1的峰来自于COO-[39], 而在2357 cm-1左右的两个峰来自于生成的CO2[40], 这表明在吸附过程中已有甲醛被完全氧化为CO2。图S10为α-Ni(OH)2-water的EPR图谱, 从图中可以看出, α-Ni(OH)2-water表面没有生成超氧自由基和羟基自由基物种。结合上述分析, 进一步证明样品中的Ni3+作为活性位点氧化了甲醛。同时, 3650 cm-1处归属于-OH的峰出现倒峰[41], 表明α-Ni(OH)2表面的羟基被消耗, 进一步证实表面羟基参与了甲醛氧化过程。而通入氧气后, 所有的峰仍然存在并且没有形成新峰(图5(b)), 说明引入氧气没有改变氧化甲醛路径, 仅提高了氧化甲醛反应的速度。

图 5. α -Ni(OH)2-water催化氧化甲醛的原位红外光谱图
Fig. 5. In situ DRIFTS of catalytic HCHO oxidation over α -Ni(OH)2-water under different conditions
为了进一步研究甲醛在α-Ni(OH)2表面的氧化过程, 计算了甲醛在α-Ni(OH)2表面的吸附模型。如图6所示, 甲醛吸附在α-Ni(OH)2表面的吸附能为-2.23 eV, 其C=O键转变成C-O单键, 并夺走α-Ni(OH)2表面的氢原子, 形成了C-OH键, 而未满配对的C原子与α-Ni(OH)2表面的-OH结合, 最终形成了类甲二醇的结构。上述结果表明甲醛与α-Ni(OH)2表面存在强烈的相互作用, 使甲醛分子结构发生了一定变形, 促进了甲醛活化。α-Ni(OH)2表面氢原子丢失以及甲醛与-OH的成键过程, 印证了原位红外中的-OH倒峰。一般情况下, 甲醛与活性氧结合形成二氧亚甲基, 之后在活性氧的作用下不断脱去H原子, 最终形成CO2[42-43]。因此, 活性氧在甲醛氧化过程中发挥着非常重要的作用。但是在α-Ni(OH)2体系中, 没有氧气的情况下甲醛依然被氧化为CO2, 且未形成活性氧物种, 表明甲醛被催化材料表面活性位点(Ni3+)氧化, 并与表面羟基提供的O原子形成CO2, 无需形成活性氧物种, 这与传统反应路径明显不同。结合上述表征分析和理论计算, 可以推测甲醛与α-Ni(OH)2表面的羟基之间存在强烈的相互作用, 协同Ni3+活性位点促进了甲醛的氧化, 而氧气主要用于填补α-Ni(OH)2表面因形成CO2所丢失的O原子以及完成Ni3+的回复。
基于上述表征分析, 可以认为α-Ni(OH)2催化氧化甲醛的过程如图7所示: 首先, 当甲醛吸附在α-Ni(OH)2表面之后, 与表面羟基产生了强烈的相互作用, 表明吸附的甲醛分子被活化; 接着, 甲醛分子被α-Ni(OH)2中的高价态Ni3+逐步氧化为甲酸盐, 并进一步氧化为CO2, 而α-Ni(OH)2表面羟基提供氧原子参与了CO2的形成, 留下氧空位; 最后, 氧气和水填补了氧空位以及表面氢, 并保证了催化材料活性位点Ni3+和表面羟基的回复。而α-Ni(OH)2-water催化氧化甲醛活性最高可能归因于其表面丰富的羟基官能团以及与Ni3+活性位点的协同作用。

图 7. α -Ni(OH)2催化氧化甲醛示意图
Fig. 7. Schematic diagram of catalytic HCHO oxidation over α -Ni(OH)2
3 结论
本研究采用水热法成功制备了α-Ni(OH)2, 并通过自制的催化氧化甲醛反应装置评价了α-Ni(OH)2在室温下催化氧化甲醛的活性。结果表明, 以水为溶剂、硝酸镍为镍源制备得到的α-Ni(OH)2在室温下催化氧化甲醛效率最高, 达到71.2%。通过原位红外测试和理论计算分析发现, α-Ni(OH)2表面羟基破坏了吸附甲醛中的C=O双键, 提供H和O原子, 使甲醛分子发生了变形, 增强了甲醛活化能力, 并协同Ni3+活性位点, 促进了甲醛完全氧化为CO2。该过程与α-Ni(OH)2表面丰富的羟基结构和Ni3+活性位点有关, 这与传统认为的氧气解离过程控制的甲醛反应路径有所不同。本研究提出的一种新的催化氧化甲醛路径, 可以为催化氧化甲醛技术的实用化提供一定理论参考。
7 补充材料
与本文相关的补充材料请登录
8 补充材料
张瑞阳1,2, 王壹1,2, 欧博文2, 周莹1,2
(西南石油大学1.油气藏地质及开发工程全国重点实验室; 2.新能源与材料学院, 成都 610500)
8.4 S1 表征方法
采用荷兰帕纳科χ’pert型粉末衍射仪(X-ray diffraction, XRD)来研究不同样品的晶体结构, 以Cu靶为靶材, 以Kα射线为辐射源, 工作电压和电流分别为40 kV和40 mA, 扫描范围和步长分别为5°~70°和0.05(°)/s。采用蔡司EVO MA15型扫描电子显微镜(Scanning electron microscope, SEM)和FEI Tecnai G22型透射电子显微镜(Transmission electron microscope, TEM)来研究不同样品的表面形貌和微观结构。利用Thermo Scientific K-Alpha+型X射线光电子能谱仪(X-ray photoelectron spectroscopy, XPS)研究了样品的元素组成和表面官能团以及不同气氛处理后样品的元素价态(在催化活性测试装置中分别在甲醛气氛(甲醛浓度为2×10-6, 平衡气体为氮气)、氧气气氛(氧气浓度为20%, 平衡气体为氮气)以及甲醛和氧气气氛(甲醛浓度为2×10-6, 氧气浓度为20%, 平衡气体为氮气)条件下处理2 h), X射线源为Al Kα, 能量1486.6 eV, 电压12 kV, 束流 6 mA, 并将C1s在284.8 eV处进行了标定。采用Micromeritics ASAP 2020 Plus型自动气体吸附仪研究了样品的N2吸脱附等温线。采用NETZSCH TG 209F1 Libra真空密闭高精度热重分析仪进行样品的热重分析(TG), 保护气体为氮气, 流速250 mL/min, 升温速率10 ℃/min。采用JESJES- FA200 FA200型电子自旋共振波谱仪(EPR)研究自由基产生情况, 以5, 5-二甲基-1-吡哆啉-N-氧化物(DMPO)为捕获剂, 并以水溶液和甲醇作为羟基自由基(·OH)和超氧自由基(·O2-)的捕获环境。
8.5 S2 原位红外测试
采用自主搭建的原位反应系统进行原位漫反射傅里叶变换红外光谱(Diffuse reflectance infrared Fourier transform spectroscope, DRIFTS)测试。原位红外光谱设备由红外光谱仪(Bruker Tensor Ⅱ FTIR spectrometer)和原位漫反射反应池(Harrick)构成。首先, 采用氩气吹扫α-Ni(OH)2表面1 h以去除吸附物后记录背景。之后, 通入甲醛气体(50 mL/min), 并记录样品表面吸附甲醛后的信号变化。接着再通入氩中氧(含氧气5%, 氩气95%), 在甲醛和氧气的气氛下记录样品表面物种的变化。每隔两分钟记录一次数据, 扫描范围为4000~600 cm-1, 扫描速度100次/s。
8.6 S3 理论计算
采用MEDE-A中的VASP(Vienna AB-Initio Simulation Package)软件对各模型结构进行模拟优化。计算使用广义梯度逼近(Generalized Gradient Approximation, GGA)和Perdewy-Burke-Ernzerhof泛函(PBE)。采用以下参数进行模型优化: 截断能为400 eV, k点设置为2×2×1, 真空层厚度设置为15 Å, 收敛精度为0.02 V/Å, 能量收敛为2.0×10-5 eV/原子。

图 11. 不同溶剂制备α -Ni(OH)2的C1s XPS谱图
Fig. 11. C1s XPS spectra of α -Ni(OH)2 prepared by different solvents

图 12. 不同溶剂制备α -Ni(OH)2的O1s XPS谱图
Fig. 12. O1s XPS spectra of α -Ni(OH)2 prepared by different solvents

图 13. 不同溶剂制备α -Ni(OH)2的Ni2p XPS谱图
Fig. 13. Ni2p XPS spectra of α -Ni(OH)2 prepared by different solvents

图 14. 不同溶剂制备α -Ni(OH)2的FT-IR图谱
Fig. 14. FT-IR spectra of α -Ni(OH)2 prepared by different solvents

图 15. 不同溶剂制备α -Ni(OH)2的热重分析
Fig. 15. TG curves of α -Ni(OH)2 prepared by different solvents

图 16. α -Ni(OH)2-water和α -Ni(OH)2-PG的N2吸脱附等温线
Fig. 16. N2 adsorption and desorption isotherms of α -Ni(OH)2-water and α -Ni(OH)2-PG
[1] BOURDIN D, MOCHO P, DESAUZIERS V, et al. Formaldehyde emission behavior of building materials: on-site measurements and modeling approach to predict indoor air pollution[J]. Journal of Hazardous Materials, 2014: 280: 164.
[3] 刘洪霞, 吕功煊. 甲醛催化制氢的研究进展[J]. 分子催化, 2020: 210.
[5] KIM W, YOUNIS S A, KIM K. The control on adsorption kinetics and selectivity of formaldehyde in relation to different surface- modification approaches for microporous carbon bed systems[J]. Separation and Purification Technology, 2022: 283: 120178.
[7] VIKRANT K, KIM K, DONG F, et al. Deep oxidation of gaseous formaldehyde at room-temperature by a durable catalyst formed through the controlled addition of potassium to platinum supported on waste eggshell[J]. Chemical Engineering Journal, 2022: 428: 131177.
[10] 张珍珍, 李鑫恒. 基于催化氧化技术去除甲醛的研究进展[J]. 分子催化, 2019: 382.
[12] JI J, LU X, CHEN C, et al. Potassium-modulated
[15] ZHU S, ZHENG J, XIN S, et al. Preparation of flexible Pt/TiO2/
[18] YANG M, ZHANG J, ZHANG W, et al. Pt nanoparticles/Fe-doped
[21] ZHANG A, ZHANG R, FEI L, et al. Tunable microstructure of
[22] ZHANG R, RAN T, CAO Y, et al. Oxygen activation of noble- metal-free g-C3N4/
[23] JIA D, GAO H, DONG W, et al. Hierarchical
[24] LI H, RAMESHAN C, BUKHTIYAROV A V, et al. CO2 activation on ultrathin ZrO2 film by H2O co-adsorption:
[25] ZHU J, YANG J, ZHOU J, et al. A stable organic-inorganic hybrid layer protected lithium metal anode for long-cycle lithium-oxygen batteries[J]. Journal of Power Sources, 2017: 366: 265.
[31] YANG X, ZHANG H, XU W, et al. A doping element improving the properties of catalysis:
[32] 韩高伟, 徐飞燕, 程蓓, 等. 反蛋白石结构ZnO@PDA用于增强光催化产H2O2性能[J]. 物理化学学报, 2022: 2112037.
[33] LAN G, LI J, ZHANG G, et al. Thermal decomposition mechanism study of 3-nitro-1, 2, 4-triazol-5-one (NTO): combined TG-FTIR- MS techniques and ReaxFF reactive molecular dynamics simulations[J]. Fuel, 2021: 295: 120655.
[34] XUE H, WANG C, MAHMOOD A, et al. Two-dimensional g-C3N4 compositing with Ag-TiO2 as deactivation resistant photocatalyst for degradation of gaseous acetaldehyde[J]. Journal of Inorganic Materials, 2022: 865.
[36] 雷卓楠, 马心怡, 胡晓云, 等. Ni2P-NiS双助剂促进g-C3N4光催化产氢动力学[J]. 物理化学学报, 2022: 2110049.
[38] WANG H, GUO W, JIANG Z, et al. New insight into the enhanced activity of ordered mesoporous nickel oxide in formaldehyde catalytic oxidation reactions[J]. Journal of Catalysis, 2018: 361: 370.
[39] WANG C, ZOU X, LIU H, et al. A highly efficient catalyst of palygorskite-supported manganese oxide for formaldehyde oxidation at ambient and low temperature: performance, mechanism and reaction kinetics[J]. Applied Surface Science, 2019: 486: 420.
[40] WANG C, LI Y, ZHANG C, et al. A simple strategy to improve Pd dispersion and enhance Pd/TiO2 catalytic activity for formaldehyde oxidation: the roles of surface defects[J]. Applied Catalysis B: Environmental, 2021: 282: 119540.
[41] SONG I, LEE H, JEON S W, et al. Understanding the dynamic behavior of acid sites on TiO2-supported vanadia catalysts
[42] BU Y, CHEN Y, JIANG G, et al. Understanding of Au-CeO2 interface and its role in catalytic oxidation of formaldehyde[J]. Applied Catalysis B: Environmental, 2020: 260: 118138.
[43] CHEN J, TANG H, HUANG M, et al. Surface lattice oxygen activation by nitrogen-doped manganese dioxide as an effective and longevous catalyst for indoor HCHO decomposition[J]. ACS Applied Materials & Interfaces, 2021: 26960.
Article Outline
张瑞阳, 王壹, 欧博文, 周莹. α-Ni(OH)2表面羟基协同Ni3+位点催化氧化甲醛机理研究[J]. 无机材料学报, 2023, 38(10): 1216. Ruiyang ZHANG, Yi WANG, Bowen OU, Ying ZHOU.