基于高分辨光声显微成像的肝癌微血管特征分析  下载: 526次
下载: 526次
Hepatocellular carcinoma (HCC) is the most common primary liver malignancy and the second leading cause of cancer death worldwide. The development of HCC leads to abnormalities in the structure and function of blood vessels, which further lead to high pressure and hypoxia in the tumor microenvironment (TME). The most common clinical methods for identifying HCC nowadays are magnetic resonance imaging (MRI), computed tomography (CT), and ultrasound. MRI can measure multifunctional parameters of the liver; however, it has significant limitations in imaging resolution and is costly. CT can image the blood vessels in the liver; however, it uses X-ray, thus increases the risk of cancer. Ultrasound imaging is widely used to evaluate HCC; however, its sensitivity and specificity are low. Therefore, a more complete and reliable technique to analyze the micro-vascular morphology of HCC and TME is urgently needed. Photoacoustic imaging is a rapidly developing imaging technology in recent years. It offers a wide range of potential applications in the field of medical imaging and can visualize the structure and function information of biological tissues without labeling of contrast agents or invasion. Photoacoustic imaging has high specificity and sensitivity in the diagnosis of HCC and can visualize functional imaging of tumors and morphological examination of blood vessels.
A mouse model of in situ liver cancer was established, and the bioluminescence signal was activated by an in vivo fluorescence imaging system to locate the tumor. The microvascular structure characteristics and oxygen saturation of normal liver lobules, tumor centers, and adjacent tumors were accurately observed using photoacoustic microscopy. The concentrations of oxygenated and deoxygenated hemoglobins were quantified using the spectroscopic separation method to calculate blood oxygen saturation. The photoacoustic images were converted into binary images, and the vascular signals were extracted for density and diameter analysis.
The results obtained using photoacoustic microscopy via two wavelengths (532 nm/559 nm) show that the blood vessels in the normal liver are evenly spaced and well differentiated, whereas large irregular vessels appear at the edges of the tumors, and the vascular joints are curved and dilated. The blood vessels inside the tumors are unevenly distributed and the branch diameter increases. The oxygen concentration in the blood around the tumors decreases, resulting in a hypoxic and high-pressure TME.
In microvascular monitoring of hepatocellular carcinoma, the photoacoustic imaging can provide high-resolution images, which can more accurately detect the morphology of tiny and abnormal blood vessels, improving the accuracy of early cancer detection. Through image analysis, indicators such as the density and diameter of microvessels and other information such as oxygenation level and metabolic activity of tumor tissues can be evaluated to assess the growth state of tumors and predict the degree of malignancy. Photoacoustic imaging demonstrates a high application potential for studying the development of HCC. It can provide further insights into the antiangiogenic therapy of tumors and the diagnosis of numerous liver-related diseases.
1 引言
肝细胞癌(HCC)是一种恶性肿瘤,也是最常见的肝癌[1]。在中国,HCC的发病率排名第三,死亡率在近十年内增加了50%。HCC通常发生在长期受到损伤的肝脏中,肝细胞不受控制地分裂,导致肝脏内部形成肿瘤,正常肝脏的结构和功能遭到破坏[2]。HCC在发展过程中会侵犯周围的血管和组织,并转移到其他器官和淋巴结中,严重影响患者的身体健康[3-4]。肿瘤的早期生长往往伴随着血管异常和新生血管的形成,癌细胞能够释放多种生长因子和血管生成因子,促进周围血管的生长和扩张,形成供肿瘤生长所需的血管网络。肿瘤的微血管结构表现出高度的异常,包括血管动脉化和正弦毛细血管化[5-7]。肿瘤新生血管中内皮细胞的基底膜受损或缺失使其具有过度的通透性,会进一步阻碍血液流动,导致以间质性高血压、缺氧和酸中毒为特征的异常肿瘤微环境[8-9]。肿瘤血管生成受血管内皮生长因子和血小板源性生长因子等分子的调控,但这些分子影响血管生成的机制并不明确[10],进一步观察HCC新生微血管结构和周围微环境特征不仅对于我们理解该疾病的肿瘤生物学特征至关重要,而且可能为使用合适的抗血管生成药物治疗HCC提供指导[11-12]。因此研究肝癌血管的结构和功能对于HCC的治疗和预后具有重要意义[13]。传统的影像学方法,如核磁共振成像(MRI)、计算机断层扫描(CT)和超声成像等,被广泛应用于HCC检测。MRI可以识别肿瘤位置,评估多种肝功能参数,但是其分辨率过小,因此MRI不能对微小血管进行成像,且使用外源造影剂存在安全隐患[14]。CT可以对肿瘤微小病灶成像,扫描中使用的电离辐射可能增加潜在的癌症风险。超声成像是检测HCC的一种非入侵的成像技术,但其准确性取决于操作者的经验[15]。这些技术都不能精确地对HCC的微血管结构和微环境功能进行成像。
光声成像(PAI)是一种结合了光学成像高分辨率和声学成像高穿透性的非侵入性成像技术[16]。与传统的成像方式相比,PAI提供了高对比度和高分辨的图像,可以同时采集生物体的结构和功能信息[17]。PAI在生物医学研究和临床实践中有许多潜在的应用,包括癌症检测和血管成像[18-19]。PAI利用血红蛋白对不同波长的特异性吸收,可以对血管的结构和功能进行高对比度可视化处理,检测肝癌细胞的血氧供应情况和血管密度,为肝癌的早期诊断和治疗提供指导[20-21]。在成像过程中,基于血液对激光(500~800 nm)的特异性吸收,选择532 nm和559 nm激光激发肝脏血液的声波信号,利用超声换能器检测声波信号的强度和时间延迟,重建血管的光吸收分布图[22-23]。多项研究表明,PAI在肝癌的诊断中取得了显著的成果。Yin等[24]利用光声染料实现了HCC细胞特异性光声成像。Zhou等[25]利用表皮生长因子受体(EGFR)的靶向作用,成功提高了光声技术对HCC的特异性检测效率。Qi等[26]利用光声成像进行实时测量,准确实现了腹腔内HCC的诊断和治疗。PAI在HCC的诊断和治疗中具有广泛的应用,有望成为一种诊断HCC的新型成像手段,为肝癌治疗提供更加准确的指导。
本文使用双波长光声显微镜对HCC微血管进行了高分辨结构成像,观察了正常肝脏与肿瘤组织的血管形态特征,提取了肝小叶、癌旁和肿瘤中心血管的特征并进行了分析。利用光谱分离算法对肿瘤微血管的血氧饱和度(sO2)分布情况进行了可视化处理,评估了肝癌组织周围和中心区域的氧代谢水平,推动了肿瘤缺氧微环境的生物学特征和分子机制的研究。深入研究了HCC的血管结构和微环境特征,为HCC的诊断、治疗和研究提供了参考。
2 材料与方法
2.1 实验仪器
本文使用的高分辨率光声显微镜(PAM)成像系统如
为了验证光声显微系统的性能,分别用刀片和直径为10 μm的碳纤维丝对系统的分辨率进行测试。对锋利的刀片边缘[
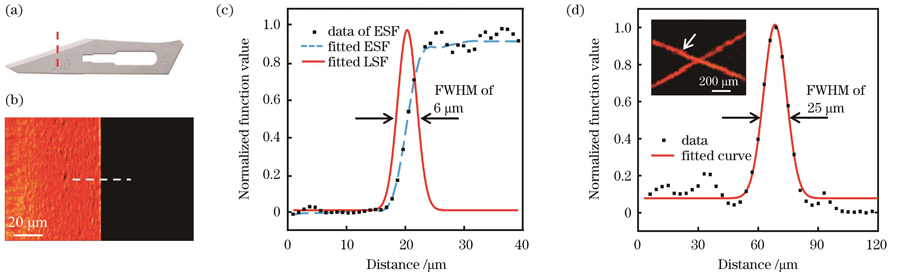
图 2. 光声显微系统的分辨率测试结果。(a)手术刀片实物图;(b)手术刀片光声图;(c)系统横向分辨率函数拟合图;(d)系统轴向分辨率拟合图,插图为碳纤维丝光声图
Fig. 2. Resolution test results of photoacoustic microscopy system. (a) Physical image of surgical blade; (b) photoacoustic image of surgical blade; (c) system lateral resolution function fitting diagram; (d) system axial resolution function fitting diagram with photoacoustic image of carbon fibers shown in inset
2.2 LM‐3细胞准备
在37 ℃温度下将肝癌细胞LM-3放在含有5%(体积分数)CO2的培养箱中培养。当细胞达到对数生长期时,利用质量分数为0.25%的胰蛋白酶[溶剂是磷酸缓冲盐溶液(PBS)]进行消化。在1000 r/min的转速下利用离心机收集细胞。用PBS制备细胞悬液,浓度为5×107 mL-1,并与基质胶混合备用。
2.3 小鼠肝细胞癌原位模型的构建
6周龄的BALB/c雄性裸鼠[体重为(20±25)g]被饲养在26 ℃无特定病原体的条件下。本实验所用动物均来自广东省实验动物中心。实验方案经广东省医院伦理委员会批准,符合所有相关伦理规范。对小鼠进行消毒处理,麻醉后用无菌手术器械进行手术。在小鼠腹部切开长度约为5 mm的伤口以暴露肝叶。用接种针吸20 μL的细胞与基质胶的混合物并将其注射到小鼠肝脏浅表,缝合小鼠腹部伤口,打抗生素观察3天。注射7天后,使用小动物活体荧光成像系统对小鼠肝脏进行成像,以确定肿瘤位置。
2.4 利用小动物活体光学成像系统定位肿瘤
在进行活体成像之前,将小鼠暴露在暗室中12 h,将体积质量为15 mg·mL-1的D-荧光素溶液通过腹腔注射到小鼠体内。荧光素底物在体内发生代谢反应5 min后,使用小动物活体荧光成像系统进行活体成像分析,观察荧光素在小动物体内的分布以确定肿瘤位置。将活体成像数据导入到图像分析软件中,对图像进行处理和分析。
2.5 肿瘤微血管结构和血氧饱和度的光声显微成像
利用高分辨率光声显微镜对小鼠的HCC组织和正常组织进行结构和功能成像。将采集到的原始数据导入到Matlab R2020a软件中,通过反投影滤波重建和光谱分离算法,提取血管密度等参数进行数据分析。利用532 nm波长激光对肝表面微血管进行结构成像。实验中控制照射在组织上的激光平均功率为200 μW,激光能量密度为14 mJ·cm-2,低于美国国家标准协会规定的激光能量安全阈值20 mJ·cm-2。sO2是指血液中含氧血红蛋白与全部血红蛋白的浓度比,反映了肿瘤新生血管的氧水平,是表征肿瘤微环境的重要指标[27]。氧气是生命活动正常进行的关键物质之一,缺氧环境会导致细胞代谢异常,免疫调节失衡甚至心肺功能下降[28-29]。研究表明,通过提高组织和细胞的氧气供应可以改善肿瘤缺氧状态,增强药物疗效,降低肿瘤复发和转移的风险[30]。血红蛋白分子与氧气结合形成的含氧血红蛋白(HbO2)与不含氧的脱氧血红蛋白(HbR)在不同波长下的摩尔消光系数不同。我们利用532 nm和559 nm波长激光激发肿瘤微血管中血液的光声信号,量化含氧血红蛋白浓度(
式中:
3 结果与分析
3.1 小动物活体成像的定量分析
利用小动物活体成像系统定位肿瘤的位置,调整对应的滤光片,选择生物发光模式进行成像,如
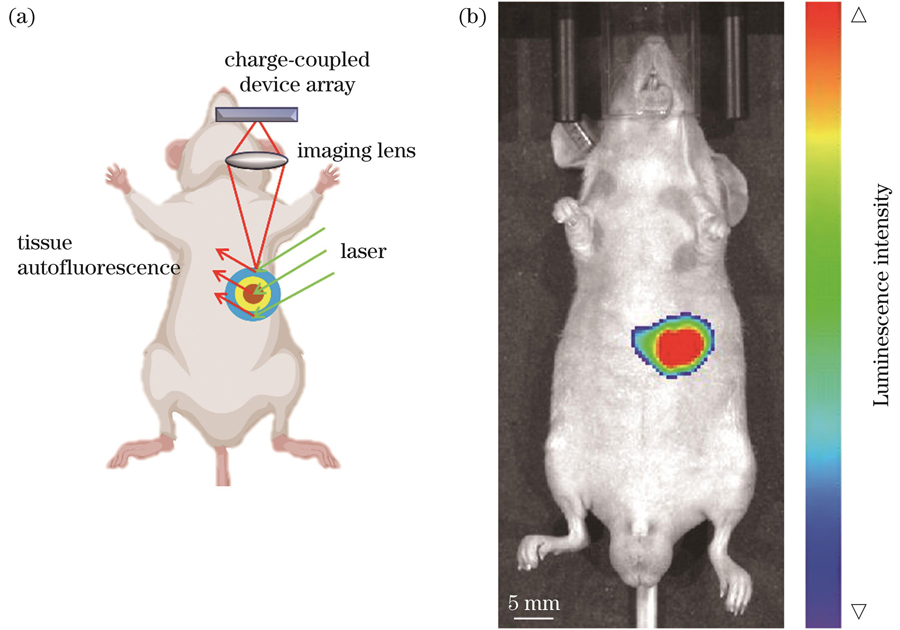
图 3. 利用生物发光成像方法对肿瘤进行定量分析。(a)生物发光成像原理示意图;(b)肿瘤定位
Fig. 3. Quantitative analysis of tumors by bioluminescence imaging method. (a) Schematic of bioluminescence imaging; (b) tumor localization
3.2 肝脏正常组织的微血管结构观察
肝脏正常组织表面的PAM图像显示了肝小叶及中央静脉微血管的结构图。肝脏正常组织的血管分布均匀,排列整齐,肝小叶清晰完整,如
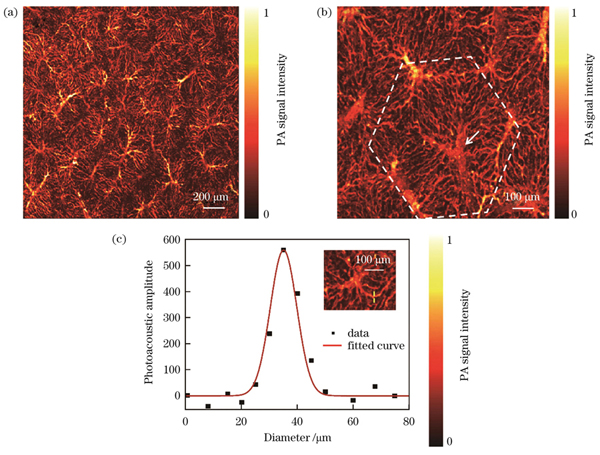
图 4. 正常肝脏微血管结构的光声显微成像与直径分析。(a)正常肝组织肝小叶的光声图像;(b)中央静脉和肝血窦;(c)肝血窦直径的定量分析
Fig. 4. Photoacoustic microscopic imaging and diameter analysis of normal liver micro-vascular structure. (a) Photoacoustic image of hepatic lobules of normal liver tissue; (b) central vein and hepatic sinuses; (c) quantitative analysis of diameter of hepatic blood sinuses
3.3 肝细胞癌的微血管结构观察
HCC模型鼠的肝表面PAM图像显示了肿瘤周围血管及肝小叶结构的变化,
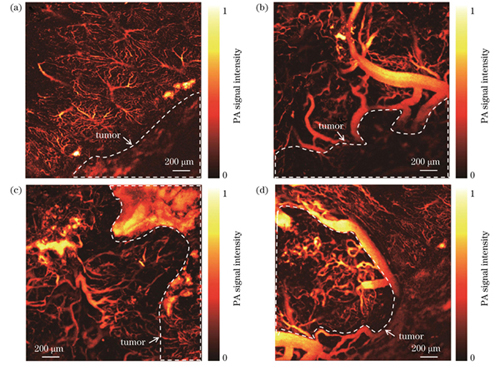
图 5. HCC小鼠肝脏肿瘤微血管结构的光声显微成像。(a)癌旁肝小叶结构;(b)(c)癌旁血管结构;(d)肿瘤中心血管
Fig. 5. Photoacoustic microscopic imaging of micro-vascular structure in HCC mice liver tumors. (a) Structure of hepatic lobules adjacent to carcinoma; (b) (c) structures of vessels adjacent to cancerous tissue; (d) central vessel of tumor
我们对
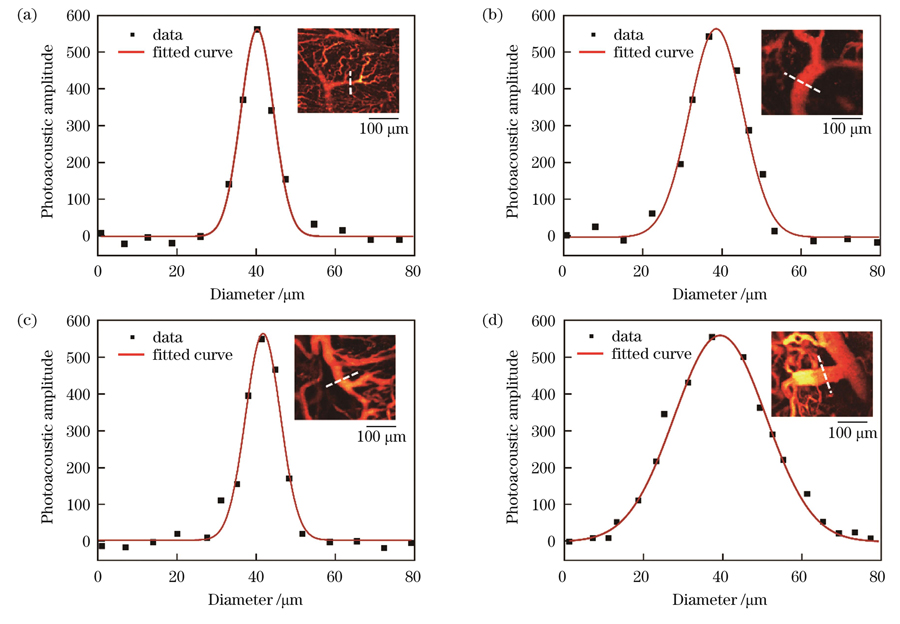
图 6. HCC微血管直径定量分析。(a)癌旁肝小叶静脉分支直径;(b)(c)癌旁血管直径;(d)肿瘤中心血管直径
Fig. 6. Quantitative analysis of HCC microvascular diameter. (a) Diameter of hepatic lobular vein branches adjacent to carcinoma; (b) (c) diameters of vessels adjacent to cancerous tissue; (d) diameter of central vessel of tumor
3.4 肿瘤微血管的特征分析
肿瘤血管特征是描述肿瘤血管形态、结构和功能的参数。我们对光声图像进行了二值化处理,提取肿瘤血管的信号观察其密度。与正常血管比较,癌变组织的血管密度整体减小,如
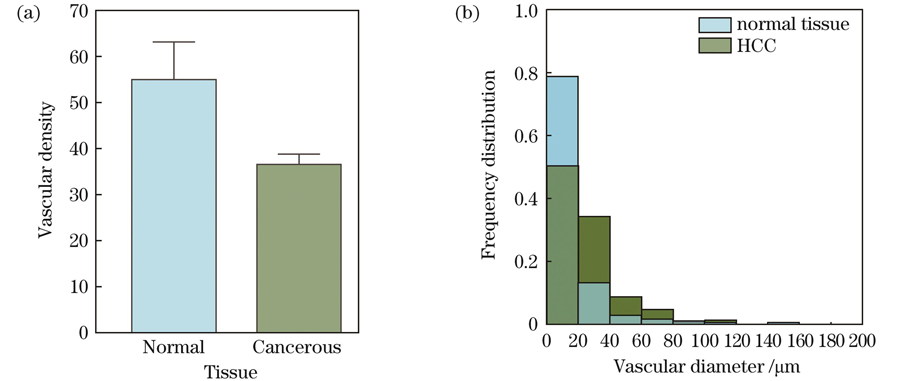
图 7. 正常组织与癌变组织的血管密度和直径分析。(a)血管密度;(b)血管直径频数分布
Fig. 7. Analysis of vascular density and diameter in normal and cancerous tissues. (a) Vascular density; (b) frequency distribution of vessel diameter
3.5 肝细胞癌微血管氧代谢功能
利用双波长图像的像素值计算肝脏血管的sO2。结果显示,正常肝脏的血管结构清晰,氧气供应充足,放大发现中央静脉的血氧值比肝动脉略低,如
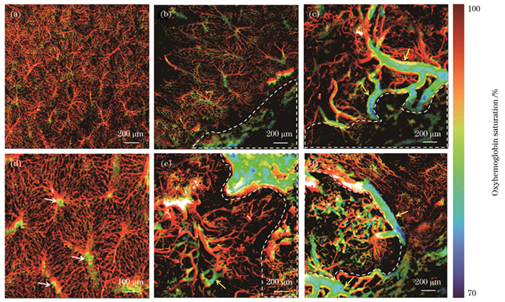
图 8. 正常肝脏血管和肿瘤微血管的氧饱和度分布。(a)正常肝脏血管氧气代谢;(b)癌旁肝小叶氧气代谢;(d)正常肝小叶氧气代谢;(c)(e)癌旁血管的氧气代谢;(f)肿瘤中心血管氧气代谢
Fig. 8. Oxygen saturation mapping in normal liver blood vessels and tumor micro-vessels. (a) Oxygen metabolism in normal liver vessels; (b) oxygen metabolism of hepatic lobules adjacent to carcinoma; (d) oxygen metabolism in normal hepatic lobular; (c)(e) oxygen metabolism in vessels adjacent to cancerous tissue; (f) oxygen metabolism in central vessels of tumor
4 结论
在HCC的发展过程中,由于肿瘤细胞异常增殖,肿瘤内部的氧气和营养物质供应不足,需要通过诱导血管生成和改变血管结构来获取更多的血液供应,癌细胞可以通过血液循环进入其他部位,实现转移和侵袭[32]。正常肝脏血管的生长和血管内皮细胞的增殖受到调控,可保证血液的稳定供应。但肿瘤细胞会释放异常的信号分子和生长因子,打破血管内皮细胞生长的严格调控,导致异常的微血管结构[33-34]。
微血管是周围正常肝组织的血管分支,或是肿瘤内部血管不断扩张和分化而来。HCC肿瘤微血管结构异常,与正常的肝组织相比,其内皮细胞和基底膜的形态和功能也发生了变化。我们观察到肿瘤边缘出现不规则的大血管,且血管之间相互连接,呈现弯曲和扩张状态。HCC微血管的血管通透性增加,导致肿瘤周围组织中的液体和细胞更容易通过血管壁进入肿瘤组织,从而促进肿瘤的生长和转移。癌细胞的异常增殖压迫肿瘤内的新生血管,导致周围血液氧气浓度降低,造成缺氧和间质性高压微环境[35],进一步促进了供应氧气和营养物质的新生血管的形成,导致癌变组织的微血管密度发生改变[36]。肿瘤缺氧微环境对于肿瘤生长和发展具有重要的影响。肿瘤细胞在缺氧微环境中会通过一系列适应性机制来维持其生存和增殖。这些机制包括激活氧化应激途径、改变代谢途径、增强血管生成、调节细胞周期等[37]。同时,缺氧环境还会影响免疫系统的功能,进而抑制肿瘤的免疫反应,增强肿瘤细胞的迁移和侵袭能力[38-40]。因此,研究HCC肿瘤微血管和缺氧微环境的生物学特征和分子机制对于HCC的治疗和干预具有重要意义。目前,一些抗血管生成药物已经应用于HCC的治疗,这些药物可以通过抑制肿瘤微血管的生长、破坏已有的血管、阻断血管通路等来减少肿瘤组织的营养供应和转移通路,从而达到抑制HCC生长和转移的目的[41-42]。
在肿瘤微血管监测中,PAI可以提供高分辨的图像,能够更准确地检测微小血管和异常血管的形态,提高早期癌症检测的准确率[43-44]。通过对图像进行分析,可以评估微血管的密度、直径等指标,获得肿瘤组织的氧合水平和代谢活性等信息,从而判断肿瘤的生长状态并预测肿瘤的恶性程度[45-46]。综上所述,光声肿瘤微血管成像具有非常广阔的应用前景,可为肿瘤治疗和研究提供重要的支持和指导。在之后的研究工作中,将通过观察HCC演化过程中肿瘤微血管的变化,建立完整的HCC分期评估体系,从而为肿瘤微血管研究提供更好的技术支持。
[1] Ozakyol A. Global epidemiology of hepatocellular carcinoma (HCC epidemiology)[J]. Journal of Gastrointestinal Cancer, 2017, 48(3): 238-240.
[2] Llovet J M, Kelley R K, Villanueva A, et al. Hepatocellular carcinoma[J]. Nature Reviews Disease Primers, 2021, 7(1): 6.
[3] Llovet J M, Castet F, Heikenwalder M, et al. Immunotherapies for hepatocellular carcinoma[J]. Nature reviews Clinical oncology, 2022, 19: 151-172.
[4] Pfister D, Núñez N G, Pinyol R, et al. NASH limits anti-tumour surveillance in immunotherapy-treated HCC[J]. Nature, 2021, 592(7854): 450-456.
[5] Mirshahi F, Aqbi H F, Isbell M, et al. Distinct hepatic immunological patterns are associated with the progression or inhibition of hepatocellular carcinoma[J]. Cell Reports, 2022, 38(9): 110454.
[6] Zhu A X, Dan G D D, Sahani D V, et al. HCC and angiogenesis: possible targets and future directions[J]. Nature Reviews Clinical Oncology, 2011, 8(5): 292-301.
[7] Jain R K. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy[J]. Science, 2005, 307(5706): 58-62.
[8] Zheng Z H, Guan R G, Wang J X, et al. Microvascular invasion in hepatocellular carcinoma: a review of its definition, clinical significance, and comprehensive management[J]. Journal of Oncology, 2022, 2022: 1-10.
[9] DenardoS J, KnaxS J, GamoI A. 73-tumor-targeted radioisotope therapy[M]∥Hoppe R T, Phillips T L, Roach M. Leibel and Phillips textbook of radiation oncology. 3rd ed. Amsterdam: Elsevier, 2010: 1544-1563.
[10] Martin B C, Gebhard David F, Andresen Catharine J. Antitumor effect of vascular endothelial growth factor inhibitor sunitinib in preclinical models of hepatocellular carcinoma[J]. European Journal of Gastroenterology & Hepatology, 2012, 24(5): 563-574.
[11] Özkan A, Stolley D L, Cressman E N K, et al. Vascularized hepatocellular carcinoma on a chip to control chemoresistance through cirrhosis, inflammation and metabolic activity[J]. Small Structures, 2023: 2200403.
[12] Hack S P, Zhu A X, Wang Y L. Augmenting anticancer immunity through combined targeting of angiogenic and PD-1/PD-L1 pathways: challenges and opportunities[J]. Frontiers in Immunology, 2020, 11: 598877.
[13] Yang Z F, Poon R T P. Vascular changes in hepatocellular carcinoma[J]. The Anatomical Record: Advances in Integrative Anatomy and Evolutionary Biology, 2008, 291(6): 721-734.
[14] Saito K, Ledsam J, Sourbron S, et al. Measuring hepatic functional reserve using low temporal resolution Gd-EOB-DTPA dynamic contrast-enhanced MRI: a preliminary study comparing galactosyl human serum albumin scintigraphy with indocyanine green retention[J]. European Radiology, 2014, 24(1): 112-119.
[15] Pavlov C S, Casazza G, Semenistaia M, et al. Ultrasonography for diagnosis of alcoholic cirrhosis in people with alcoholic liver disease[J]. The Cochrane Database of Systematic Reviews, 2016, 3(3): CD011602.
[16] Zhang W Y, Luo X Z, Yang F, et al. Photoacoustic (532 nm and 1064 nm) and ultrasonic coscanning microscopy for in vivo imaging on small animals: a productized strategy[J]. Journal of Biophotonics, 2023: 202300007.
[17] Shen Q, Wu X L, Zhang Z, et al. Gamma frequency light flicker regulates amyloid precursor protein trafficking for reducing β- amyloid load in Alzheimer’s disease model[J]. Aging Cell, 2022, 21(3): 13573.
[18] Tong X, Lin L, Hu P, et al. Non-invasive 3D photoacoustic tomography of angiographic anatomy and hemodynamics of fatty livers in rats[J]. Advanced Science, 2023, 10(2): 2205759.
[19] Wang Z Y, Yang F, Cheng Z W, et al. Photoacoustic-guided photothermal therapy by mapping of tumor microvasculature and nanoparticle[J]. Nanophotonics, 2021, 10(12): 3359-3368.
[20] Huang G J, Lü J, He Y, et al. In vivo quantitative photoacoustic evaluation of the liver and kidney pathology in tyrosinemia[J]. Photoacoustics, 2022, 28: 100410.
[21] Lü J, Xu Y, Xu L, et al. Quantitative functional evaluation of liver fibrosis in mice with dynamic contrast-enhanced photoacoustic imaging[J]. Radiology, 2021, 300(1): 89-97.
[22] Wang Q, Shi Y J, Yang F, et al. Quantitative photoacoustic elasticity and viscosity imaging for cirrhosis detection[J]. Applied Physics Letters, 2018, 112(21): 211902.
[23] 穆根, 张振辉, 石玉娇. 生物医学影像中的光声成像技术[J]. 中国激光, 2022, 49(20): 2007208.
[24] Yin F F, Cao N, Xiang X L, et al. DNA framework-based topological aptamer for differentiating subtypes of hepatocellular carcinoma cells[J]. Chemical Research in Chinese Universities, 2021, 37(4): 919-924.
[25] Zhou Q, Li Z, Zhou J, et al. In vivo photoacoustic tomography of EGFR overexpressed in hepatocellular carcinoma mouse xenograft[J]. Photoacoustics, 2016, 4(2): 43-54.
[26] Qi S, Zhang Y C, Liu G Y, et al. Plasmonic-doped melanin-mimic for CXCR4-targeted NIR-II photoacoustic computed tomography-guided photothermal ablation of orthotopic hepatocellular carcinoma[J]. Acta Biomaterialia, 2021, 129: 245-257.
[27] Zhang S P, Chen H, Wang L P, et al. A general approach to design dual ratiometric fluorescent and photoacoustic probes for quantitatively visualizing tumor hypoxia levels in vivo[J]. Angewandte Chemie International Edition, 2022, 61(7): 202107076.
[28] Park J H, Kim H J, Kim C W, et al. Tumor hypoxia represses γδ T cell-mediated antitumor immunity against brain tumors[J]. Nature Immunology, 2021, 22(3): 336-346.
[29] Jeong H, Kim S, Hong B J, et al. Tumor-associated macrophages enhance tumor hypoxia and aerobic glycolysis[J]. Cancer Research, 2019, 79(4): 795-806.
[30] Emami N A, Najafgholian S, Rostami A, et al. The role of hypoxia in the tumor microenvironment and development of cancer stem cell: a novel approach to developing treatment[J]. Cancer Cell International, 2021, 21(1): 1-26.
[31] Lin L, Wang L V. The emerging role of photoacoustic imaging in clinical oncology[J]. Nature Reviews Clinical Oncology, 2022, 19(6): 365-384.
[32] Romanque P, Piguet A C, Dufour J F. Targeting vessels to treat hepatocellular carcinoma[J]. Clinical Science, 2008, 114(7): 467-477.
[33] García-Pras E, Fernández-Iglesias A, Gracia-Sancho J, et al. Cell death in hepatocellular carcinoma: pathogenesis and therapeutic opportunities[J]. Cancers, 2021, 14(1): 48.
[34] Pang R, Poon R T P. Angiogenesis and antiangiogenic therapy in hepatocellular carcinoma[J]. Cancer Letters, 2006, 242(2): 151-167.
[35] RajaniC, BorisaP, KaranwadT, et al. Cancer-targeted chemotherapy: emerging role of the folate anchored dendrimer as drug delivery nanocarrier[M]∥Chauhan A, Kulhari H. Pharmaceutical applications of dendrimers. Amsterdam: Elsevier, 2020.
[36] Wu X Z, Xie G R, Chen D. Hypoxia and hepatocellular carcinoma: the therapeutic target for hepatocellular carcinoma[J]. Journal of Gastroenterology and Hepatology, 2007, 22(8): 1178-1182.
[37] Mossenta M, Busato D, Bo M D, et al. Glucose metabolism and oxidative stress in hepatocellular carcinoma: role and possible implications in novel therapeutic strategies[J]. Cancers, 2020, 12(6): 1668.
[38] Faivre S, Rimassa L, Finn R S. Molecular therapies for HCC: looking outside the box[J]. Journal of Hepatology, 2020, 72(2): 342-352.
[39] Rebouissou S, Nault J C. Advances in molecular classification and precision oncology in hepatocellular carcinoma[J]. Journal of Hepatology, 2020, 72(2): 215-229.
[40] Roderburg C, Wree A, Demir M, et al. The role of the innate immune system in the development and treatment of hepatocellular carcinoma[J]. Hepatic Oncology, 2020, 7(1): HEP17.
[41] Yang F, Yu Y. Tumor microenvironment: the critical element of tumor metastasis[J]. Chinese Journal of Lung Cancer, 2015, 18(1): 48-54.
[42] Heimbach J K, Kulik L M, Finn R S, et al. AASLD guidelines for the treatment of hepatocellular carcinoma[J]. Hepatology, 2018, 67(1): 358-380.
[43] 李娇, 李帅, 陈冀景, 等. 非接触光声成像研究进展及其在生物医学上的应用[J]. 中国激光, 2021, 48(19): 1918005.
[44] Zhang J D, Sun X, Li H H, et al. In vivo characterization and analysis of glioblastoma at different stages using multiscale photoacoustic molecular imaging[J]. Photoacoustics, 2023, 30: 100462.
[45] 陈宁波, 周慧超, 赵煌旋, 等. 肿瘤血管的高分辨光声定量成像[J]. 中国激光, 2019, 46(9): 0907001.
[46] Zhang Z H, Mu G, Wang E Q, et al. Photoacoustic imaging of tumor vascular involvement and surgical margin pathology for feedback-guided intraoperative tumor resection[J]. Applied Physics Letters, 2022, 121(19): 193702.
Article Outline
孙彤, 黄国家, 张振辉. 基于高分辨光声显微成像的肝癌微血管特征分析[J]. 中国激光, 2023, 50(15): 1507105. Tong Sun, Guojia Huang, Zhenhui Zhang. Characteristics Analysis of Micro‐vessels Liver Cancer Based on High Resolution Photoacoustic Microscopy[J]. Chinese Journal of Lasers, 2023, 50(15): 1507105.







