DLP打印β-磷酸三钙/纳米黏土复合支架的制备与表征
β-磷酸三钙(β-TCP)具有生物降解性和生物相容性, 可通过诱导成骨细胞分化促进骨形成, 在骨替代领域受到广泛关注。由于多孔β-TCP陶瓷的强度较低且生物活性有待提高, 使其应用受到一定的限制[1-2]。
纳米黏土(硅酸镁锂, NC)是一种人工合成的片状硅酸镁锂, 具有良好的生物相容性以及促进干细胞增殖和分化的生物学效应[3⇓-5], 广泛应用于日化、食品和卫生材料领域。Lee等[6]研发了具有强大骨再生功能的纳米黏土_有机水凝胶骨密封剂, 骨再生更安全、更快。Zhai等[7]制备了聚乙二醇(PEGDA)/无机纳米黏土(Laponite XLG)复合水凝胶材料, 加入纳米黏土使得凝胶材料具有优异的力学性能及骨诱导活性。纳米黏土中含有多种微量元素, 在降解过程中能够持续释放具有促进成骨分化作用的离子, 例如Si4+、Mg2+和Li2+等, 在骨修复领域具有良好的应用前景[8⇓-10]。
截止目前, 科研人员采用各种方法制备多孔生物陶瓷支架, 包括溶胶-凝胶、气体发泡、泡沫浸渍和冷冻干燥等, 上述方法在控制多孔生物陶瓷支架的孔结构方面存在很大的局限性[11⇓-13]。3D打印是一种新兴的材料成型技术, 也称为增材制造技术, 将3D打印技术应用于陶瓷材料的成型过程, 开发周期短、成本低, 不需要模具就能实现复杂形状的零件成型, 可以直接进行实体成型等优点[14-15]。光固化成型法成型速度快, 精度高, 无需铺粉、喷丝, 在陶瓷成型方面具有较大优势[16-17]。随着数字光处理技术(Digital light processing, DLP)的发展, 面曝光技术得到了广泛关注, DLP陶瓷打印已成为陶瓷光固化成型技术主要的研究方向[18-19]。
本工作采用DLP打印法制备了β-TCP/NC多孔复合支架, 并对其微观结构、相组成、力学性能和降解性能进行了分析。通过计算烧结收缩, 可以调控多孔陶瓷样件轮廓与内部孔隙结构尺寸。实验还将复合支架用于培养骨髓间充质干细胞(rBMSCs), 研究支架的体外生物相容性。
1 实验方法
1.1 实验试剂
研究采用的树脂单体聚乙二醇二丙烯酸酯(PEG200DA)购于北京伊诺凯科技有限公司; 光引发剂2, 4, 6-三甲基苯甲酰基二苯基氧化膦(TPO)购于上海泰坦科技股份有限公司; 分散剂DCA-1228购于广州市锐聚化工科技有限公司; β-磷酸三钙(β-TCP)粉末购于昆山华侨科技新材料有限公司; 交联剂3, 3-二甲基丙烯酸和纳米黏土(硅酸镁锂, NC)购于Siagma公司。
1.2 浆料制备
光固化陶瓷浆料包括光敏树脂预混液和陶瓷粉体。光敏树脂预混液的制备过程如下: 树脂单体聚乙二醇二丙烯酸酯(PEG200DA)、交联剂3, 3-二甲基丙烯酸、光引发剂2, 4, 6-三甲基苯甲酰基二苯基氧化膦(TPO)、分散剂DCA-1228按一定配比混合(具体比例如表1所示), 中速搅拌1 h, 使各组分混合均匀。光敏树脂预混液与陶瓷粉体按一定配比放入球磨机中, 再向混合浆料中加入纳米黏土, 纳米黏土占固体的质量分数分别为2%、5%和10%,并将这三组分别命名为TNC2、TNC5和TNC10。球磨5 h使得各组分分散均匀, 制备得到光固化陶瓷浆料。
表 1.
制备多孔生物陶瓷的主要原料与试剂
Table 1. Main raw materials and reagents for preparation of porous bioceramics
|
1.3 多孔陶瓷素坯成型
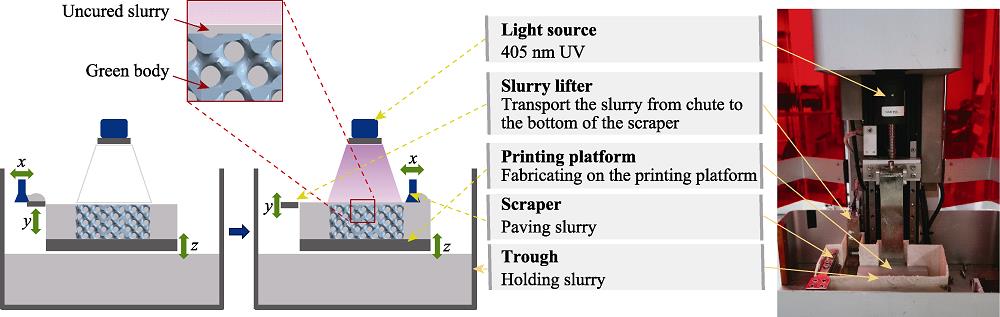
树脂在特定波长紫外线照射下, 从液体聚合为固体, 并将陶瓷粘结成型。本实验采用的光机波长为405 nm, 输出光功率为150~500 mW, 可调节, 投影精度为58 μm。将制备好的浆料倒入打印机料槽中, 再将设计好的CAD模型导入陶瓷打印机中, 设置好切片参数后开启电源, 开始打印。提料器沉浸至浆料底部后提升, 将浆料运送至刮刀下面, 刮刀沿着X轴水平运动, 在打印平台上均匀地铺平浆料, 铺料厚度为切片厚度50 μm。铺平后光机开启, 投影该层的图案到铺平的浆料上, 达到设置的单层固化时间后关闭光机, 刮刀回零。打印结束后, 将素坯样件清洗干净, 置于干燥箱中干燥过夜后放进马弗炉进行脱脂和烧结。分别制备φ10 mm×12 mm和φ10 mm× 2 mm的样品用于力学测试和体外生物相容性验证。
1.4 表征与性能检测
1.4.1 形貌表征
利用电子显微镜观察支架的宏观形貌。利用Zeiss Ultra Plus场发射扫描电子显微镜观察多孔结构孔隙特征、表面微观形貌以及内部孔道的联通情况, 并测量孔径的大小。
1.4.2 烧结收缩检测
测量支架烧结前后的结构特征尺寸, 包括轮廓尺寸、孔径和杆径, 烧结收缩率(ε)计算见公式(1):
其中, ${{L}_{0}}$为烧结前的尺寸, ${{L}_{1}}$为烧结后的尺寸。
1.4.3 成分检测
利用X射线衍射仪(XRD)表征材料的组成, 并根据衍射峰的强度或面积, 对照已知的同种标准物质的相应强度进行成分的定量分析。为进一步验证制备样品的物相和组成情况, 分别对实验组和对照组陶瓷样品进行X射线衍射分析, 扫描范围设定为20°~70°, 扫描速度设定为10 (°)/min。
1.4.4 比表面积与孔隙率检测
物理吸附(BET)广泛应用于测量比表面积, BET法测定固体的比表面积的吸附介质最常用的是氮气。研究采用比表面积与孔隙度分析仪(Autosorb- IQ3)测试支架样品的比表面积, 采用阿基米德排水法测量支架孔隙率。
1.4.5 力学性能
利用微机控制电子万能试验机对四组多孔生物陶瓷标准样件(φ10 mm×12 mm)进行静态压缩性能测试, 压缩加载速度为0.5 mm/min, 测试温度为室温。
2 结果与讨论
2.1 表面形貌分析
支架轮廓显微镜照片以及支架表面的扫描电镜照片如图2所示。从图2(a, d, g, j) 中可以看出, 打印出来的TNC支架具有均匀的三维曲面孔隙结构(TPMS多孔结构之一, G单元多孔结构)。从SEM照片可以看出, 加入NC后, 支架表面出现细小NC晶粒, 其中黄色箭头标记为NC颗粒(如图2(i, l))。测得烧结的G单元多孔结之间, 这种三维连通、大孔和微孔相结合的生物多孔陶瓷结构, 有利于发挥材料的骨传导性, 也有利于细胞粘附生长、细胞外机质沉积、营养和氧气进入以及代谢产物排出[20-21]。
2.3 支架成分分析
XRD结果(图4(a))显示, 加入NC不会改变TCP的物相成分, 支架的成分仍为TCP。EDS结果(图4(b))显示, 引入NC后, 支架表面可以检测到Si和Mg元素(TCP支架只含有Ca、P、O三种元素), 且元素在支架表面均匀分布, 根据EDS测试结果, Ca/P/O/Si/Mg五种元素的原子分数分别为19.16%/ 12.84%/66.13%/1.01%/0.70%。Si、Mg等微量元素的释放能够促进植入物成骨分化和血管化[25-26]。
2.4 力学性能测试
力学性能是骨科植入物的一个关键性能, 孔隙率是影响力学性能的一个重要因素[27]。孔隙率和比表面积的测试结果如图5(a)所示, 与纯TCP组相比,加入NC后, 支架的孔隙率随NC含量的增加而减小, 可能是由于NC颗粒经过高温(NC粒径<500 nm)融合在TCP颗粒的间隙中(TCP粒径范围为2~10 μm, 形成的孔隙孔径约500 nm), 如图5(c)所示。孔隙率是影响陶瓷支架力学强度的主要因素, 如图5(b)所示, 支架强度在5~6 MPa范围内。其中, TNC10组的压缩强度最高可达5.65 MPa, 在人体松质骨的压缩强度(4~12 MPa)范围内[28]。对比纯TCP支架, 压缩强度提高了12.1%(纯TCP支架压缩强度为5.05 MPa)。另外, 加入NC后, 支架结构的比表面积逐渐增大, 其中, TNC10组比纯TCP的比表面积增加2倍以上, 可能是相同体积的纳米NC比TCP具有更高的比表面积引起的。NC增强TCP支架原因有两个方面: 1)加入NC导致TCP支架孔隙率降低, 压缩强度提高; 2)高温烧结导致NC融于TCP基体发生液相烧结。
2.5 降解性能
可降解生物材料植入骨组织后, 材料通过体液溶解吸收或被代谢系统排出体外, 最终使缺损的部位完全被新生的骨组织所取代, 因此, 降解性能是骨修复材料一项重要指标[15,29]。
随着降解时间的延长, β-TCP和TNC支架的失重显著增加, 与β-TCP相比, TNC10失重比例更大, 在 10 d后失重比例达到5.9%(图6(a))。如图6(b)所示, 支架在SBF溶液中降解后保持碱性环境, TNC10组降解10 d后的pH为7.97。
图7为支架在SBF浸泡不同时间Ca2+、Mg2+、Li2+和Si4+的离子释放行为。支架的Ca2+离子释放行为相似, 在2 d内迅速增加, 3~10 d内缓慢增加。TNC组的支架还检测到Mg2+、Li2+和Si4+的持续释放, 且随着NC添加比例的增大, 离子释放浓度也相应增大。

图 7. 支架经SBF浸泡后释放的离子浓度变化
Fig. 7. Changes of ion concentration released from scaffolds soaked in SBF
图8为四组支架经SBF浸泡降解7 d后的SEM照片, 浸泡7 d后, TNC组晶粒表面出现均匀的矿化层, 其中, TNC10组表面的微结构最为明显(图8(h))。同时, TCP组在降解7 d后表面出现微裂纹(图8(b)), 而含有NC组则无裂纹产生。

图 8. 四组支架经SBF浸泡降解后表面形貌变化
Fig. 8. Surface morphologies of scaffold after degradation in SBF
3 结论
采用DLP技术制备了β-TCP/NC(TNC)复合支架, 研究其成型效果、微观结构、物相组成、降解性能、力学性能等, 得出以下结论:
1)采用数字光处理(DLP)技术制备的β-TCP/ NC(TNC)复合支架, 多孔结构孔径为200~300 μm。当加入10% NC(质量分数)时, 支架各结构特征的烧结收缩最小。加入NC不会改变TCP的物相成分, 且支架表面均匀分布着Si、Mg元素。
2) 加入NC能够提高TCP支架的压缩强度, NC(NC粒径<500 nm)融合在TCP颗粒的间隙中, 对比纯TCP支架, TNC10的压缩强度提高了10%。加入NC后, 支架结构的比表面积逐渐增大, TNC10组较纯TCP的比表面积增加2倍以上。
3) TNC降解速率更快, 并且TNC降解液保持弱碱性的环境。利用DLP打印技术制备且具有良好理化性能的多孔生物陶瓷支架在骨修复领域有巨大应用前景。
[2] LIU J, GAO C, FENG P, et al. Selective laser sintering of
[3] LIU J, SHEN X, TANG S, et al. Improvement of rBMSCs responses to poly(propylene carbonate) based biomaterial through incorporation of nanolaponite and surface treatment using sodium hydroxide[J]. ACS Biomaterials Science and Engineering, 2020: 329-339.
[4] ZHANG Y H, CHEN M J, DAI Z B, et al. Sustained protein therapeutics enabled by self-healing nanocomposite hydrogels for non-invasive bone regeneration[J]. J. Biomaterials Science, 2020, 8: 682-693.
[8] GAO W, SUN L, ZHANG Z, et al. Progress, preparation, characterization and evaluation of biomass-based siliconcontaining composite scaffolds for bone repair[J]. Chemical Industry and Engineering Progress, 2019: 4595-4605.
[9] DONG Q S, YANG L, JIANG H Q, et al. 3D-cubic interconnected porous Mg-based scaffolds for bone repair[J]. Journal of Magnesium and Alloys, 2021: 1336-1345.
[12] LIU F H. Synthesis of bioceramic scaffolds for bone tissue engineering by rapid prototyping technique[J]. Journal of Sol Gel Science & Technology, 2012: 704-710.
[23] CHEN Y, WANG X, BING M, et al. 3D-printed bioactive Ca3SiO5 bone cement scaffolds with nano surface structure for bone regeneration[J]. ACS Applied Materials & Interfaces, 2017: 5757.
Article Outline
张航, 韩坤原, 董兰兰, 李祥. DLP打印β-磷酸三钙/纳米黏土复合支架的制备与表征[J]. 无机材料学报, 2022, 37(10): 1116. Hang ZHANG, Kunyuan HAN, Lanlan DONG, Xiang LI.