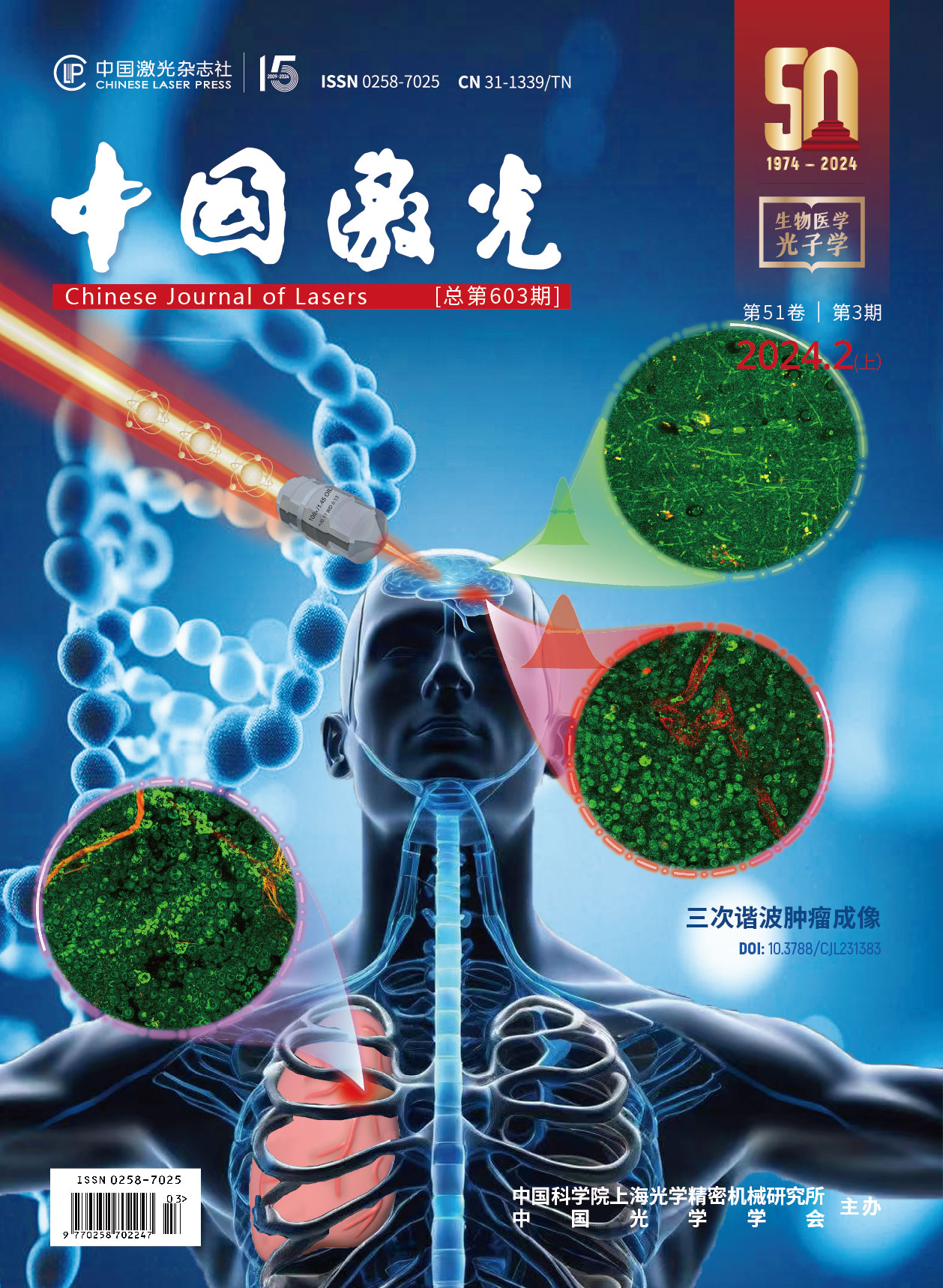
三次谐波显微成像在肿瘤诊断中的应用进展封面文章
Cancer remains a major life-threatening disease worldwide, as reported by the World Health Organization (WHO). Surgery is the primary therapy for most solid tumors, with the ideal outcome relying on a balance between complete tumor removal and maximal preservation of surrounding normal tissue. Current clinical imaging modalities such as magnetic resonance imaging (MRI), computed tomography (CT), and positron emission tomography (PET) lack the resolution to accurately delineate tumor boundaries. The gold standard in clinics for detecting tumor boundaries and infiltration is the histopathological analysis of surgical specimens via hematoxylin and eosin (H&E) staining. However, the H&E staining workflow requires time-consuming tissue processing, including formalin fixation, paraffin embedding, and manual staining, often taking more than a day before diagnostic results are available to surgeons. Consequently, there is an urgent demand for new real-time microscopic imaging techniques that can be used intraoperatively to provide instant feedback during tumor surgery.
Recent years have seen promising developments in label-free nonlinear imaging techniques for real-time tissue pathology in the operating room. These techniques include multiphoton fluorescence microscopy, optical coherence tomography (OCT), Raman microscopy, and harmonic microscopy, which can visualize tumor margins without exogenous labels. Among these, third harmonic generation (THG) combined with second harmonic generation (SHG) offers a unique, label-free subcellular-resolution assessment of fresh and unprocessed tissues. THG signals arise from nonlinear three-photon optical responses at cell-cell and cell-matrix interfaces (Fig. 1), effectively detecting proliferative cells and vasculatures, key hallmarks of tumor pathology. THG microscopy stands out by providing sub-cellular resolution, rich cellular and molecular information, and images of H&E quality. Additionally, using a single beam, complementary information from SHG, two-photon excited fluorescence (2PEF), and three-photon excited fluorescence (3PEF) can be simultaneously collected, visualizing extensive architectural and molecular details. These advantages position THG imaging as a highly promising technique for intraoperative determination of tumor margins.
In this review, we explore the fundamental principles of the THG nonlinear process and discuss its latest applications in intraoperative tumor imaging. We highlight recent engineering innovations enabling miniaturized, portable THG imaging systems suitable for operating room deployment. We also review pioneering efforts in developing THG-capable endoscope probes using flexible fiber-optics, potentially integrating with standard surgical equipment. Embedding THG microscopy seamlessly into clinical workflows can provide surgeons with real-time, in-situ histopathology, enhancing surgical outcomes without disrupting the surgical rhythm. This review aims to accelerate the translation and adoption of label-free nonlinear optical imaging, particularly THG microscopy, as a valuable intraoperative guidance tool.
Recent studies have demonstrated the potential of integrated THG, SHG, and multiphoton fluorescence microscopy for ex-vivo characterization of freshly resected human brain tumors (Fig. 2), ovarian tumors, breast cancer specimens, lung tumors (Fig. 3), and other tumor types. These studies reveal pathological hallmarks such as increased cellularity, nuclear pleomorphism, and vascular proliferation. The in-situ extraction of tumor pathological features underscores THG imaging's potential to improve surgical outcomes. Efforts are underway to transition THG microscopy from benchtop to clinically viable tools. Most THG microscopes are currently confined to research labs, with large volumes, complex opto-mechanical components, and limited consideration for patient safety or imaging stability. To facilitate widespread intraoperative use, miniaturized and portable THG imaging platforms are necessary. Researchers in the Netherlands and the USA have independently developed compact, multimodal THG microscopes, and these devices have been tested in clinical settings, such as operation rooms or pathological laboratories, for pilot clinical validation (Fig. 4). These devices enable on-site assessment of surgical specimens and provide rapid diagnostic feedback for tumor classification and margin determination, assisting surgeons in decision-making. However, existing miniaturized THG microscopes are limited to ex-vivo imaging. To enable real-time, in-situ guidance without tissue removal, endoscopic techniques are essential for THG imaging. The nonlinear imaging field is witnessing increasing efforts to design THG-capable endoscopes, drawing from innovations in 2PEF/3PEF, SHG, OCT, and Raman microscopy (Fig. 5). THG endoscopy is still in its early stages, presenting numerous opportunities for scientific research, technology translation, and clinical studies.
THG imaging shows promise for real-time intraoperative assessment of various cancer types. Significant progress has been made in developing compact, portable THG imaging systems for intraoperative use. Currently, only two groups have begun clinical testing with their portable THG microscopes. More systematic clinical testing is needed to further mature this technology for routine operation room use. Additionally, technical translations from other imaging modalities are required to advance THG endoscopy solutions. Despite the vast potential of THG microscopy for real-time, non-destructive assessment of fresh tissue, more efforts from both the scientific and industrial sectors are imperative to promote the translation of THG microscopes from laboratories to clinical settings.
1 引言
据世界卫生组织报道,癌症是危害人类健康的主要疾病之一,2020年全球近两千万人被新诊断为癌症患者,全年有上千万人死于癌症[1]。目前,手术仍然是大多数癌症的主要治疗手段,其关键是肿瘤的完整切除以及正常组织的最大程度保留。然而,目前多数肿瘤在术中主要还是依靠医生肉眼观察和手触诊来识别,这很容易造成肿瘤残留或正常组织过度切除[2]。因此,研发能应用于癌症术中区分肿瘤与正常组织区域的成像技术引起了国内外的广泛关注。
常规的医学影像检测,如核磁共振成像(MRI)、计算机断层扫描(CT)、正电子发射断层扫描(PET)等技术,可以提供肿瘤位置、尺寸等宏观信息的粗略诊断[3],但是这些医学影像技术所提供的分辨率不足以精准地重构肿瘤的边界[4-5],在肿瘤边界评估中具有较高的假阳性与假阴性率[6-7]。而且,医学影像往往是在术前拍摄的,在手术时难以与实际的肿瘤组织进行精准匹配,比如开颅会使脑部组织移动,从而导致实际的肿瘤位置与术前影像不符[8]。基于苏木精和伊红(H&E)染色的组织病理学诊断是临床上肿瘤组织诊断的金标准[9],但H&E病理分析需要福尔马林固定、脱水、石蜡包埋和染色等繁琐且费力的处理步骤,其结果往往需要数天才能获取,无法在术中为医生提供实时的组织病理反馈。冰冻切片是临床上用于术中肿瘤组织诊断及边界评估的主要技术,但该技术仍需要30 min以上才能获得组织的病理信息,而且存在取材偏倚的风险,容易出现假阴性检出[10]。因此,开发新的技术用于术中肿瘤的快速、精准诊断及边界评估是目前肿瘤外科领域的迫切需求。
近些年,无标记的光学显微成像技术在各类肿瘤术中诊断中展现出了巨大的应用前景。常见的无标记成像主要包括多光子荧光成像[11]、拉曼成像[12]、光学相干断层扫描成像(OCT)[13]、二次和三次谐波显微成像等[14-15]。这些技术往往能在无需组织染色标记的情况下直接或间接地揭示肿瘤组织的三维信息,而且具有较大的成像深度和较高的成像速度,在术中识别肿瘤边界方面具有重要的临床应用价值。其中,三次谐波(THG)成像是一种独具特色的无标记成像技术[16-17],其基于光照射组织所产生的三倍频光响应实现成像。相较于OCT成像,THG成像能提供更高的成像分辨率和更直观的肿瘤信息。THG成像在装置复杂度、成本和稳定性上比拉曼成像更具优势。而且,THG成像可以与二次谐波(SHG)成像、双/三光子自发荧光(2PEF/3PEF)成像相兼容,只用单束光激发就能同时得到THG/SHG/2PEF/3PEF等多模态信号,揭示丰富的肿瘤信息,而且所获取的图像质量能与H&E图像相媲美[8,18-23]。因此,THG成像在肿瘤术中诊断方面具有极高的临床应用价值。
接下来本文将着重介绍THG显微成像的原理及其在各类肿瘤术中诊断方面的最新研究进展以及THG成像设备在小型化方面的进展,最后对THG技术应用于内窥成像的前景进行了展望。
2 THG成像原理
介质在强脉冲激光照射下会产生非线性的光响应。其中,THG描绘的是三倍频的光学过程,其信号的产生依赖于介质的三阶非线性极化率χ(3)和一定的相位匹配条件[24],这不同于基于分子实态跃迁的荧光信号产生过程,如
式中:ITHG表示THG信号的强度;h(x,y,z)表示三光子激发的点扩展函数;χ(3)表示三阶非线性极化率。

图 1. THG显微技术的原理和实验方案。(a)THG与自发荧光能级示意图;(b)THG与多光子荧光信号工作波段示意图;(c)在两种介质不同部分是否能输出THG信号的示意图;(d)THG显微实验系统示意图(GS:振镜扫描;SL:扫描透镜;TL:管透镜;DM:二向色镜;OBJ:物镜;IF:干涉滤波器;L:透镜)
Fig. 1. Principle and experimental program for third harmonic generation (THG) microscopy. (a) Schematic diagram of THG and spontaneous fluorescence energy levels; (b) schematic diagram of the working bands of THG and multiphoton fluorescence signals; (c) a schematic showing whether THG signal can be emitted out in different parts of two media; (d) schematic diagram of THG microscopy experimental system (GS: galvo scanning; SL: scan lens; TL: tube lens; DM: dichroic mirror; OBJ: objective lens; IF: interference filter; L: lens)
在生物组织中,由于脂质分子是所有膜状结构的主要组成部分,因此脂质分子所构成的膜状光学界面成为了THG成像的最主要信号来源[21,33]。SHG信号往往互补于THG信号,其主要来源于组织中具有非中心对称结构的胶原分子、肌球蛋白与微管等[34]。除了SHG信号外,THG成像系统[如
THG显微成像系统相对来说并不复杂。所使用的飞秒(<200 fs)激光器波长一般在1000 nm以上,如1070、1300、1560 nm等波长的脉冲光用于THG成像均有报道。脉冲光可以通过格兰棱镜及脉冲选择器等来控制递送到样品上的功率,确保飞秒脉冲足以激发THG信号同时不会损伤生物样本。衰减后的脉冲光通过高数值孔径的显微物镜聚焦于组织样品表面,所产生的THG/SHG/2PEF/3PEF等信号光根据不同的中心波长由二向色镜区分开,最终由高灵敏度的光电倍增管采集,从而获取多个通道的显微图像。光束的二维扫描可以通过双轴振镜或者共振振镜实现,二维扫描结合高精度电动垂直位移台可以实现样品的三维显微成像。
3 THG的术中病理诊断应用
3.1 脑胶质瘤
脑胶质瘤占原发性脑肿瘤的80%,其肿瘤细胞侵入性极强,导致肿瘤组织与正常脑组织之间没有明晰的边界,而且细胞数量从肿瘤核心到正常组织呈现递减的趋势。细胞与血管等的数量与形态学信息是临床上区分肿瘤与正常组织的最主要信息。在离体组织中,OCT技术可以根据组织的光学衰减程度来区分正常脑组织与脑胶质瘤及其浸润区域的边界,但OCT成像技术不能直接可视化肿瘤细胞,这可能会限制其对肿瘤浸润区域(肿瘤细胞数量少)的检测精度[35]。拉曼技术[36],比如受激拉曼散射(SRS)、相干反斯托克斯拉曼散射(CARS)等,可以通过脂质分子与蛋白分子的振动信息实现对细胞和组织的可视化,但拉曼成像需要两束脉冲光在时空上重合,系统复杂度和设备成本相对较高[37-38]。
不同于OCT成像与拉曼成像,THG成像通过脂质膜状结构和DNA聚集所形成的光学界面实现对肿瘤细胞的可视化,可以揭示与金标准(H&E病理分析)相匹配的肿瘤病理特征信息,如细胞增生、细胞核多形性与血管增殖等(如

图 2. 对人类正常脑组织与脑胶质瘤进行THG成像(绿色)和SHG成像(红色),两者重叠处呈黄色。(a)正常脑灰质;(b)正常脑白质;(c)浸润性低级别脑胶质瘤;(d)浸润性高级别脑胶质瘤
Fig. 2. Normal human brain tissue and gliomas images using THG (green) and SHG (red) imaging, the overlap between them is yellow. (a) Normal gray matter of the brain; (b) normal white matter of the brain; (c) low-grade diffuse gliomas (WHO grade II); (d) high-grade diffuse gliomas (WHO grade IV)
3.2 乳腺癌
乳腺癌是女性常见癌症,是导致女性死亡的第二大癌症,70%~75%的乳腺癌与乳腺导管病变有关[41]。不典型导管增生(ADH)是浸润性导管癌(IDC)的间接前兆,而导管原位癌(DCIS)则是直接前兆,低级别DCIS的细胞增殖与ADH的不典型增生很相似。导管原位癌伴微浸润(DCIS-MI)是IDC的一种前期病变,可见于任何级别的DCIS,通常发生在高级别DCIS中,但治疗策略不同[42]。由于缺乏准确快速的筛查和诊断成像方法,这些病变往往会发展为恶性IDC,甚至出现向远处转移。穿刺活检样本或者术后样本经H&E染色后,病理学家可以很容易地区分ADH和DCIS,但却难以识别DCIS-MI。目前往往通过免疫染色标志物标记肿瘤周围的肌上皮细胞层来识别急性DCIS-MI和其他疑似病变[43],但问题是,对病变组织进行免疫染色标记后,重新切片的部分可能检测不到浸润性病变。
Chen等[44]使用2PEF/SHG成像,依据导管内细胞核形态特征、导管周围胶原分布和基底膜周长的差异,揭示了正常乳腺组织、ADH、低级别DCIS和高级别DCIS-MI的不同。正常乳腺组织由导管-小叶系统以及纤维组织、脂肪组织的基质系统组成,导管由内上皮细胞和肌上皮细胞组成,基质中的胶原纤维致密且弯曲。在ADH的导管内,上皮细胞出现增殖,细胞核小且均匀,基底膜明显增厚。低级别DCIS的上皮细胞增殖,并涉及大导管及邻近的导管,胶原纤维由于导管扩张而变直。DCIS-MI则是在此基础上,癌细胞突破导管基底膜进入间质组织。高级别DCIS的上皮增殖细胞体积更大、细胞核异常明显、核仁较多,并且导管周围胶原分布不均匀。
Groot课题组[45]使用无标记的THG/SHG/2PEF/3PEF成像对新鲜未处理的人类乳房组织进行了快速高质量分析,成像结果显示了小叶、导管、脂肪组织、结缔组织和血管等乳腺关键成分,并且与H&E组织病理学图像揭示的信息非常一致。同时,他们还对固定装片但未进行H&E染色的切片进行了成像,结果是类似的,只是THG/SHG信号不再有重叠。THG信号来源于小叶和导管的上皮细胞层及其内部组分、血管壁细胞及其内部扁平细胞的细胞核和核膜结构、脂肪细胞和结缔组织细胞的细胞膜。小叶由腺泡组成,腺泡和导管均由被基底膜包围的上皮细胞层组成。上皮细胞的形态和导管内的组分均可以由THG信号观察到,上皮细胞和导管内细胞的细胞核信号很弱且呈现“黑洞”状,但是,血管壁内部扁平细胞的细胞核和核膜结构均会产生THG信号,THG信号可能来源于染色质聚集。SHG信号来源于基质中的胶原纤维以及周围的肺泡、导管和血管。2PEF信号来源于脂肪细胞边缘及周围、血管和神经的边界和内部以及小叶的腺泡内部。3PEF信号主要来源于基质的脂肪细胞内部、血管壁和神经周围,可能还包括成纤维细胞或巨噬细胞的细胞核。Groot等还对小鼠乳腺组织进行了DNA染色,在THG/SHG/3PEF图像的共同定位下,他们证明了上皮细胞中的“黑洞”确实是细胞核。THG/SHG成像揭示的这些乳腺关键结构的成分信息有助于区分正常乳腺组织和乳腺肿瘤组织。
Boppart课题组[19-20,46]利用多模态THG/SHG/2PEF/3PEF无标记非线性显微成像,对新鲜切除的人类正常乳腺组织和乳腺肿瘤组织,实现了同时可视化肿瘤细胞、血管内皮细胞、血细胞、免疫细胞及其外基质,揭示了肿瘤微环境中细胞外囊泡(EV)的富集程度、免疫细胞的扩散以及血管生成等重要信息,这些信息有作为肿瘤标志物的潜力。其中,THG和3PEF成像可以对癌症相关的细胞结构进行成像。在浸润性导管癌组织中,导管外周上皮细胞会产生很强的THG和3PEF(NADH)信号,这与水/糖类分解及缺氧等肿瘤细胞旺盛的代谢过程有关。乳腺导管内细胞的细胞核也会产生很强的3PEF信号,而正常乳腺组织导管内细胞则主要产生2PEF(FAD)和THG信号。血管的生成也与肿瘤细胞息息相关,肿瘤组织中正在发育的血管的细长细胞核产生强3PEF信号,细胞质产生强THG信号,而发育成熟的血管基本上只产生THG信号。同时,癌症相关血管、毛细血管也会与乳腺导管交织在一起,从而可能导致肿瘤细胞进入血液并转移[47-48]。他们还结合针活检技术对犬类乳腺肿瘤进行了非破坏性的术中点位评估,揭示了术中癌症组织的微观结构和代谢信息。他们使用傅里叶域的SHG分析胶原纤维取向,用2PEF和3PEF的强度关系定义光学氧化还原比(ORR),分析后发现癌症组织的ORR代谢谱与正常组织相比分布得更广泛且平均值更低[49]。
3.3 肺癌
在男性和女性癌症患者中,肺癌患者的死亡率均为最高。早期肺癌可以通过手术切除或放疗等手段治愈,但由于其症状较轻容易被视为常见的呼吸系统问题,从而容易错过最佳治疗窗口期。对III期肺癌患者来说,手术切除仍然是治疗的重要一环。目前,肺组织取样通常会进行多次活检,导致手术时间延长,增加了患者罹患并发症的风险。因此,在术中快速评估切除组织边缘及病变类型,将有助于减少并发症和不良反应。
Jain等[50]使用SHG/2PEF成像揭示了肺癌组织的病理学特征,鉴定了肺泡、支气管、血管、胸膜以及吸烟者的巨噬细胞和淋巴细胞,结果显示胶原蛋白的数量与腺癌的分化程度成正相关。这一结果证明SHG/2PEF成像能够区分肿瘤和非肿瘤肺组织,并可识别不同的肿瘤亚型。
Groot课题组[51]使用THG/SHG/2PEF对未处理的离体肺癌组织进行成像,实现了对肿瘤及其周围组织中肺细胞、肺泡骨架、动脉、支气管壁等的可视化。这种方法可用于识别肺泡组织和肿瘤组织边界以及区分具有最小程度增大单形细胞核(染色质为椒盐状,散布着THG亮斑)的典型类癌以及脂质和微乳头状生长模式的腺癌。肺泡组织有两个重要的组织病理学特征,一是胶原蛋白和弹性蛋白构成的肺泡骨架,二是细胞的形状、大小和细胞核大小。在新鲜的健康肺组织中可以看到由胶原蛋白(SHG,红色)和弹性蛋白(2PEF,蓝色)组成的蜂窝状骨架以及巨噬细胞(THG,绿色)。正常肺泡壁最多有两层肺泡细胞,其细胞核为扁平状,这是正常肺泡上皮细胞的典型特征,如
![人类健康肺组织与肺癌组织的THG(绿色)、SHG(红色)、2PEF(蓝色)成像,图中其他颜色由这三色叠加得到[51]。(a)新鲜的健康肺组织,可见胶原蛋白、弹性蛋白和巨噬细胞;(b)新鲜的上皮样间皮瘤组织,取自支气管活检,可见异常肿瘤细胞和少量胶原蛋白](/richHtml/zgjg/2024/51/3/0307101/img_04.jpg)
图 3. 人类健康肺组织与肺癌组织的THG(绿色)、SHG(红色)、2PEF(蓝色)成像,图中其他颜色由这三色叠加得到[51]。(a)新鲜的健康肺组织,可见胶原蛋白、弹性蛋白和巨噬细胞;(b)新鲜的上皮样间皮瘤组织,取自支气管活检,可见异常肿瘤细胞和少量胶原蛋白
Fig. 3. Human healthy lung tissue and lung cancer tissue were imaged with THG (green), SHG (red), and 2PEF (blue) signal, and the other colors in the pictures are superimposed on these three colors[51]. (a) Fresh healthy lung tissue with collagen, elastin and macrophages; (b) fresh epithelioid mesothelioma tissue, taken from bronchial biopsy, showed abnormal tumor cells and a small amount of collagen
3.4 卵巢癌
卵巢癌的隐匿性较强,盆腔、腹部疼痛等症状并不是卵巢癌的特异性症状信息,所以一经发现腹部有积水或肿胀便意味着卵巢癌晚期。卵巢癌可以分为上皮性卵巢癌、生殖性卵巢癌和间质细胞癌三大类,它可细分为多种亚型,比如上皮性卵巢癌主要分为浆液性、子宫内膜样、黏液性和透明细胞性等4种亚型[52]。不同类型与亚型的卵巢癌具有不同的手术治疗方案,关乎着患者是否还能保留生育能力。若能在手术刚开始时对肿瘤组织进行分类与分型,将有助于医生制定后续的手术与治疗方案。
目前,人们对卵巢癌非线性成像的研究较少。2010年,Williams等[53]使用2PEF/SHG对病人未固定、未染色的卵巢癌组织进行成像,成像完成后用墨水标记定位,进行标准组织病理学处理。H&E染色图像显示正常卵巢表面上皮细胞呈单层鳞状,而浆液性上皮性卵巢癌(EOC)组织中有密集的多边形非典型性上皮细胞,与2PEF/SHG得到的组织学和细胞特征类似。2PEF源于NADH和类视黄醇化合物等肿瘤区域固有的荧光分子,肿瘤组织的荧光信号波长相比正常组织有轻微的红移(可能与囊泡的产生有关),其中与高分子蛋白结合的NADH减少,因而其荧光寿命与正常组织的荧光寿命也不同。SHG信号可以揭示H&E中不存在的胶原纤维信息:肿瘤侵袭边缘附近的胶原纤维大多垂直于其表面,EOC肿瘤基底膜的胶原纤维增厚。这表明胶原纤维的分布与趋向可用于肿瘤诊断以及辅助评估肿瘤浸润边界。
Adur等[54-55]使用THG/SHG/2PEF成像对人类上皮浆液性卵巢癌的H&E载玻片进行了分析。THG成像可用于评估不同类型肿瘤表面上皮细胞的细胞核形态、细胞异型性和细胞增殖。其中,正常卵巢上皮细胞的大小和分布比较均匀,而交界性肿瘤和浆液性腺瘤组织的上皮细胞大小不一,并具有拉长细胞核的纤毛立方细胞。可以通过计算细胞核的圆度因子和峰度测量,量化具有非球形、较小细胞核的黏液性癌的上皮细胞。2PEF和SHG信号可以用于分析与计算基质中胶原蛋白与弹性蛋白的含量比,该比值会随着肿瘤的发展逐渐增大。浆液性腺瘤中的胶原蛋白含量比交界性肿瘤中的多。以上结果说明THG/SHG/2PEF成像具有识别并分类正常组织、良性肿瘤、交界性肿瘤、恶性肿瘤组织的潜力。但是,THG在卵巢癌分类与分型中的应用还需要用新鲜、未染色的组织进一步确认。这是因为THG信号的产生依赖于水与脂质膜状结构之间形成的光学界面,而H&E染色过程中的脱水干燥步骤会破坏这些光学界面,进而影响THG信号的产生。
3.5 其他类型癌症
无标记的非线性成像技术还可以用于研究一些其他类型的癌症,如宫颈癌和膀胱癌,但是关于这些癌症的THG成像研究的报道较少。
Pouli等[56]利用NADH和FAD的2PEF信号对人类宫颈癌前组织进行非侵入性成像,结果显示:该方法能够灵敏地评估氧化还原率和线粒体断裂,进而检测该组织的代谢功能和异质性变化,以微米级分辨率表征细胞的核质比等细胞形态学信息,提高了识别高级别鳞状上皮细胞内病变的诊断准确性。
膀胱癌可以通过膀胱镜进行检查,但该方法的侵入性高且难以检测小型扁平病变,导致约50%的高复发率。膀胱癌还可以通过尿液细胞学进行无创检测,但只能诊断晚期膀胱癌[57]。Park课题组[58]使用THG/SHG/2PEF/3PEF成像从犬类尿液样本中分离出来自NADH和FAD的EV,然后以两者的荧光信号强度之比来表征组织的代谢特征。结果表明,患膀胱移行细胞癌犬类尿液样本中的NADH-EV浓度相比健康膀胱组织增加了2倍以上,而患前列腺癌犬类尿液样本中的NADH-EV浓度与健康前列腺组织相比没有显著差异。因此,EV可以作为膀胱癌的一种标志物。他们的研究还表明,如果能建立起其他癌症与EV等癌症标志物之间的联系,便可以找到使用THG成像及其他非线性成像进行癌症无创诊断的新方法。
4 THG诊断仪器的发展
4.1 术中诊断设备
目前,大多数基于THG的非线性成像研究都是在实验室条件下进行的,THG设备庞大且复杂,其体积、安全性和稳定性都需要改进。目前,荷兰的Groot教授团队和美国的Boppart教授团队都已经分别研制出了可移动、小型化、多模态的THG成像设备,并已将设备放置在手术室或病理科进行初步的临床测试。这些小型化设备可以在手术进行时快速地对医生刚切除的组织进行病理分析,为有疑问的组织提供实时的病理信息反馈,为肿瘤切缘手术或是术中肿瘤分类、分型(针对卵巢癌)提供指导,从而有望提高肿瘤手术的切缘精度。
荷兰阿姆斯特丹自由大学的Groot教授团队[51]研发了一种小型便捷的THG台式显微设备FD1070,如
![小型化术中实时诊断设备应用实例。术中切除部分组织,打开上盖放入样品,进行THG/SHG/2PEF成像,诊断组织是否为肿瘤。若为肿瘤,诊断其类型及恶性程度,进而指导医师继续手术(根据荷兰阿姆斯特丹自由大学Groot教授团队研制的便携式紧凑型THG显微成像系统FD1070[51]绘制而成)](/richHtml/zgjg/2024/51/3/0307101/img_06.jpg)
图 4. 小型化术中实时诊断设备应用实例。术中切除部分组织,打开上盖放入样品,进行THG/SHG/2PEF成像,诊断组织是否为肿瘤。若为肿瘤,诊断其类型及恶性程度,进而指导医师继续手术(根据荷兰阿姆斯特丹自由大学Groot教授团队研制的便携式紧凑型THG显微成像系统FD1070[51]绘制而成)
Fig. 4. Application example of compact portable intraoperative real-time diagnostic equipment. During the operation, a portion of tissue is resected, the upper cover is opened to place a sample into the instrument, and then THG/SHG/2PEF imaging is performed to diagnose whether the tissue is normal or tumor. If it were a tumor tissue, the type and the grade would be diagnosed. This can instruct the doctor to continue the operation (drawing from the portable compact higher harmonic microscopy system FD1070[51] developed by Professor Groot's team at VUA in the Netherlands)
美国UIUC大学的Boppart教授团队[60]研发了一种集成THG/SHG/2PEF/3PEF 4种非线性光学成像模式的同时无标记自发荧光多谐波(SLAM)显微系统NS3000(NanoSight Ltd.),该系统可以有效地可视化新鲜的人类肿瘤组织中的各种生物组织特征并可以揭示EV、免疫细胞、血管等肿瘤微环境信息。NS3000使用超连续谱为1040~1100 nm、脉宽为55 fs、频率为70 MHz、峰值功率为1.8 W的光纤飞秒激光器作为泵浦光,通过光子晶体光纤和4f脉冲整形器将平均功率降低到50 mW,最终照射到样品上的平均功率约为14 mW。该系统可对表面下20~200 µm深度处的组织成像,成像单视场为400 µm×400 µm(800 pixel×800 pixel),THG横向分辨率约为322 nm,纵向分辨率为1 mm。术中THG图像的平均信噪比为19 dB±4 dB。他们将该系统与基于深度学习的图像处理相结合,开发了一种用于分割提取细胞核的深度神经网络架构。利用该网络架构分割出细胞核,然后手动从图像中分割出细胞质,就可以计算得到核质比。他们还开发了基于深度学习的虚拟染色技术,该技术可将多通道的灰度SLAM图像转换为H&E风格的染色图像,便于医生在术中快速了解图像的组织病理学信息。
综上,目前国际上已经研制出了基于THG成像的小型化术中诊断设备,并且已经进入了临床测试阶段,但其成像速度还需进一步提升,以匹配临床术中诊断的实时性要求,而且其智能化程度也不足,需要进一步研究图像的智能分析算法。所查资料显示,目前国内还未出现THG小型化设备,发展国产小型化THG成像设备迫在眉睫。
4.2 内窥诊断设备
目前的小型化THG成像设备只能对切除以后的组织进行快速病理分析,若要对尚未切除的组织进行分析就需要使用内窥成像技术。只有使用内窥成像技术,才有可能直接接触或是穿刺组织,为医生提供实时病理反馈。在非线性成像领域,国内外学者已经为2PEF、SHG、OCT、拉曼等成像技术研发了相应的内窥镜,但是目前针对THG成像的内窥技术才刚起步,还有待进一步展开。
Kuzmin等[39]使用梯度折射率透镜(GRIN)物镜构建了直径为1 mm的微型THG显微探针,并采用该探针对健康和肿瘤侵袭的离体人脑组织进行了内窥成像,成功揭示了胶质母细胞瘤的病理特征。这一结果初步表明了THG内窥成像的可能性。但是该THG显微成像还存在几个问题:1)GRIN物镜不可移动;2)针头没有接触到组织;3)扫描使用了Galvo振镜扫描系统。解决这些问题需要结合体积更小、重量更轻、功耗更低、更易于集成的微机电系统(MEMS)以及手持式光纤内窥活检针,以实现由光纤将激光器的光信号传输到GRIN物镜,并灵活地对深层组织进行接触与穿刺。Boppart团队[49]将THG/SHG/2PEF/3PEF成像系统与针活检技术(使用Tru-cut针头)相结合,实现了对犬类肝、肺、乳腺肿瘤以及软组织肉瘤的术前和术中成像,验证了THG对肿瘤核心穿刺标本进行内窥成像诊断的可行性。
在SHG/2PEF内窥成像方面,Williams、König、Schnitzer等[61-66]以及其他先驱在过去十几年中对非线性内窥成像的临床应用起到了巨大的推动作用。Williams等[53]提出了一种类似针活检的内窥成像技术,即:将大鼠腹部剖开并将与2PEF/SHG显微物镜连接的微探针插入到切口中进行成像。这是非线性内窥成像的雏形。
美国霍普金斯大学的李兴德教授团队[67]将直径约为2 mm的双包层光纤探头和微型物镜相结合,在紧凑的光纤内窥镜平台上对小鼠肾脏模型进行了2PEF/SHG内窥成像,以揭示其代谢信息。这为体内原位实时的非侵入性和功能性组织成像提供了新思路。李兴德团队还研制出了一种与Merit Medical公司Tru-cut活检针兼容的高数值孔径微物镜刚性探头[68],如
](/richHtml/zgjg/2024/51/3/0307101/img_08.jpg)
图 5. 非线性光学显微技术实现手持光纤探头的内窥成像原理示意图[68](根据美国霍普金斯大学李兴德团队2018年设计的手持快速光纤内窥镜示意图重绘)
Fig. 5. Schematic diagram of the endoscopic imaging principle of handheld fiber optic probes using nonlinear optical microscopy technology[68] (redrawn schematic diagram of a handheld fast fiber optic endoscope designed by the Li Xingde's team at Hopkins University in the United States in 2018)
在过去的近30年间,OCT成像已发展出了完备的内窥成像技术。OCT内窥成像根据扫描模式可以分为圆周式、侧视式和前视式,其中前视式扫描主要利用光纤探头进行扫描,便于对深层组织实现与常规OCT图像质量相近的3D内窥扫描成像,但需要缩小扫描探头的体积并增加工作距离[69-70]。Boppart团队[71]研制出了使用单模光纤导管的OCT内窥镜,其由单模光纤、渐变折射率透镜和直角棱镜组成,其微型光纤探头可以通过微创手术插入体内获取OCT图像。这种微型扫描光纤探头为实现术中活体微创THG及其他非线性内窥成像奠定了基础。OCT内窥镜的扫描方式可以分为近端扫描和远端扫描。前者使用Galvo振镜扫描,适用于腔管器官,但往往会受到非均匀旋转扭曲(NURH)的影响[72-73];后者通常通过静电驱动、电磁驱动、电热驱动、压电驱动、微电机驱动等控制光纤探头扫描。Kim等[74]使用MEMS来最大限度地减小NURH,扫描速度比近端扫描更快,但高昂的成本和复杂的设计使得设备的小型化受限。结合OCT内窥成像的发展来看,微型光纤探头和MEMS有助于THG内窥成像更加适用于临床。
基于拉曼的内窥成像技术近几年也取得了长足进步。CARS、SRS需要两束空间和时间重叠的激发光束,其在光纤中传播时会产生非线性四波混频,群速度色散和各种非线性效应也会导致脉宽和峰值强度损失,必须在两个不同波长下进行补偿,从而增加了拉曼内窥技术的难度。Lombardini等[75]设计了一种基于谐振扫描的空心Kagomé晶格双包层柔性光纤扫描内窥镜,其光纤纤芯输出端面插入了二氧化硅微球透镜。同时,该内窥镜中配备了基于微型MEMS的谐振压电扫描仪和微型远端物镜。该内窥镜可以实现亚微米级分辨率、320 μm×320 μm视场的CARS/SHG/2PEF成像,成像速度为1.25 s/image。这种内窥镜将柔性光纤与二氧化硅微球透镜结合起来,可以使用远端扫描和近端扫描相结合的扫描方式,有助于缩小THG内窥探头的直径,实现更加快速的大视场、高分辨THG内窥成像。
以上基于SHG/2PEF、OCT与拉曼的内窥成像技术为THG内窥成像的探针设计、光纤选择以及扫描模块设计提供了借鉴。
5 总结与展望
本文主要探讨了THG显微成像技术在肿瘤术中对未经处理的肿瘤组织标本进行无标记、快速成像和癌症病理表征的研究进展。首先回顾了使用THG与SHG、多光子荧光相结合的成像技术表征离体新鲜人类肿瘤组织(包括脑肿瘤、卵巢肿瘤、乳腺肿瘤、肺肿瘤等)的最新进展,接着阐述了THG成像系统在小型化及术中肿瘤识别方面的研究进展,最后总结了THG/SHG、2PEF/3PEF、OCT、拉曼等成像技术在内窥成像方面的研究进展,为THG内窥成像设备的研发提供了参考。
THG显微成像技术在临床方面受到了越来越多的关注,但仍有不少问题有待进一步解决。第一,THG成像系统的性能仍有改进空间。THG成像系统的成像视场、成像深度、成像速度还不足以匹配目前临床条件下组织器官的大小与厚度。成像视场与成像速度问题或许可以通过与共振扫描、生成对抗网络结合来解决[76],而成像深度的提高则依赖于人们对组织散射、吸收的基础认知和突破[77-78]。THG内窥成像中的成像视场问题或许需要进一步结合THG与MRI、CT等宏观成像技术来解决。THG与这些宏观成像技术相结合能够有效地利用宏观医学影像的术中导航作用以及THG成像的组织放大作用。第二,对THG技术获取的多模态图像信息进行处理的技术还有待完善。THG成像往往可与SHG、多光子荧光成像同时进行,获得多通道数据信息,这些信息与H&E图像揭示的组织病理学信息并不完全吻合,甚至有着更加丰富而复杂的信息,需要开发新算法将多模态图像转换为H&E风格的图像,以便于医生便捷地阅读和翻译图像信息。同时,也需要进一步发展基于深度学习的自动化图像分析算法,实现对多模态图像的降噪、分割与分类等任务,以及实现对肿瘤细胞、免疫细胞、血管、EV、NADH/FAD等丰富的肿瘤微环境组分的分类识别。最后,本文虽然只着重调研了THG成像技术,但SRS、CARS等拉曼成像技术也是肿瘤术中诊断的重要候选技术,需要对其进一步开展研究,以明确THG与拉曼成像技术是否提供同样的肿瘤信息,尤其是这两类技术在肿瘤边界的判定上是否具有一致性。
综上,THG成像技术已在多类癌症的诊断研究中取得了进展,目前国外已经开发出了可用于术中诊断的小型化成像设备,但仅有荷兰和美国的几家医院对这些小型化设备进行了临床测试,而且这些设备在术中对肿瘤诊断的精度也尚未有明确的报道。THG内窥成像技术还需要进一步研究与发展。
[1] Xia C, Dong X, Li H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J]. Chinese Medical Journal, 2022, 135(5): 584-590.
[2] Stummer W, Tonn J C, Mehdorn H M, et al. Counterbalancing risks and gains from extended resections in malignant glioma surgery: a supplemental analysis from the randomized 5-aminolevulinic acid glioma resection study[J]. Journal of Neurosurgery, 2011, 114(3): 613-623.
[3] Damadian R. Tumor detection by nuclear magnetic resonance[J]. Science, 1971, 171(3976): 1151-1153.
[4] Rygh O M, Selbekk T, Torp S H, et al. Comparison of navigated 3D ultrasound findings with histopathology in subsequent phases of glioblastoma resection[J]. Acta Neurochirurgica, 2008, 150(10): 1033-1042.
[5] Barone D G, Lawrie T A, Hart M G. Image guided surgery for the resection of brain tumours[J]. Cochrane Database of Systematic Reviews, 2014, 2016(9): 9685.
[6] Kawashima A, Libshitz H I. Malignant pleural mesothelioma: CT manifestations in 50 cases[J]. American Journal of Roentgenology, 1990, 155(5): 965-969.
[7] Turkbey B, Pinto P A, Choyke P L. Imaging techniques for prostate cancer: implications for focal therapy[J]. Nature Reviews. Urology, 2009, 6(4): 191-203.
[8] Zhang Z Q, de Munck J C, Verburg N, et al. Quantitative third harmonic generation microscopy for assessment of glioma in human brain tissue[J]. Advanced Science, 2019, 6(11): 1900163.
[9] King D F, King L A. A brief historical note on staining by hematoxylin and eosin[J]. The American Journal of Dermatopathology, 1986, 8(2): 168.
[10] Preeti A, Sameer G, Kulranjan S, et al. Intra-operative frozen sections: experience at a tertiary care centre[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2016, 17(12): 5057-5061.
[11] Wu J L, Ji N, Tsia K. Speed scaling in multiphoton fluorescence microscopy[J]. Nature Photonics, 2021, 15: 800-812.
[12] Krishna R, Colak I. Advances in biomedical applications of Raman microscopy and data processing: a mini review[J]. Analytical Letters, 2023, 56(4): 576-617.
[13] Plekhanov A A, Gubarkova E V, Sirotkina M A, et al. Compression OCT-elastography combined with speckle-contrast analysis as an approach to the morphological assessment of breast cancer tissue[J]. Biomedical Optics Express, 2023, 14(6): 3037-3056.
[14] Aghigh A, Bancelin S, Rivard M, et al. Second harmonic generation microscopy: a powerful tool for bio-imaging[J]. Biophysical Reviews, 2023, 15(1): 43-70.
[15] Wu W T, Tang S. Harmonic generation and impact of phase matching in multimodal multiphoton microscopy[J]. IEEE Journal of Selected Topics in Quantum Electronics, 2023, 29(4): 7000309.
[16] Olivier N, Luengo-Oroz M A, Duloquin L, et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy[J]. Science, 2010, 329(5994): 967-971.
[17] Barad Y, Eisenberg H, Horowitz M, et al. Nonlinear scanning laser microscopy by third harmonic generation[J]. Applied Physics Letters, 1997, 70(8): 922-924.
[18] Boppart S A, You S X, Li L H, et al. Simultaneous label-free autofluorescence-multiharmonic microscopy and beyond[J]. APL Photonics, 2019, 4(10): 100901.
[19] You S X, Tu H H, Chaney E J, et al. Intravital imaging by simultaneous label-free autofluorescence-multiharmonic microscopy[J]. Nature Communications, 2018, 9: 2125.
[20] You S X, Barkalifa R, Chaney E J, et al. Label-free visualization and characterization of extracellular vesicles in breast cancer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(48): 24012-24018.
[21] Witte S, Negrean A, Lodder J C, et al. Label-free live brain imaging and targeted patching with third-harmonic generation microscopy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(15): 5970-5975.
[22] Zhang Z Q, Kuzmin N V, Groot M L, et al. Extracting morphologies from third harmonic generation images of structurally normal human brain tissue[J]. Bioinformatics, 2017, 33(11): 1712-1720.
[23] Zhang Z Q, Kuzmin N V, Groot M L, et al. Quantitative comparison of 3D third harmonic generation and fluorescence microscopy images[J]. Journal of Biophotonics, 2018, 11(1): 201600256.
[24] Squier J A, Müller M, Brakenhoff G J, et al. Third harmonic generation microscopy[J]. Optics Express, 1998, 3(9): 315-324.
[25] Mahou P, Olivier N, Labroille G, et al. Combined third-harmonic generation and four-wave mixing microscopy of tissues and embryos[J]. Biomedical Optics Express, 2011, 2(10): 2837-2849.
[26] Feng S, Winful H G. Physical origin of the Gouy phase shift[J]. Optics Letters, 2001, 26(8): 485-487.
[27] Lim H. Harmonic generation microscopy 2.0: new tricks empowering intravital imaging for neuroscience[J]. Frontiers in Molecular Biosciences, 2019, 6: 99.
[28] Ward J F, New G H C. Optical third harmonic generation in gases by a focused laser beam[J]. Physical Review, 1969, 185(1): 57-72.
[29] Tsang T Y F. Optical third-harmonic generation at interfaces[J]. Physical Review A, 1995, 52(5): 4116-4125.
[30] Cheng J X, Xie X S. Green's function formulation for third-harmonic generation microscopy[J]. Journal of the Optical Society of America B, 2002, 19(7): 1604-1610.
[31] Carrasco S, Saleh B E A, Teich M C, et al. Second- and third-harmonic generation with vector Gaussian beams[J]. Journal of the Optical Society of America B, 2006, 23(10): 2134-2141.
[32] Olivier N, Beaurepaire E. Third-harmonic generation microscopy with focus-engineered beams: a numerical study[J]. Optics Express, 2008, 16(19): 14703-14715.
[33] Débarre D, Supatto W, Pena A M, et al. Imaging lipid bodies in cells and tissues using third-harmonic generation microscopy[J]. Nature Methods, 2006, 3(1): 47-53.
[34] van Steenbergen V, Boesmans W, Li Z, et al. Molecular understanding of label-free second harmonic imaging of microtubules[J]. Nature Communications, 2019, 10: 3530.
[35] Kut C, Chaichana K L, Xi J F, et al. Detection of human brain cancer infiltration ex vivo and in vivo using quantitative optical coherence tomography[J]. Science Translational Medicine, 2015, 7(292): 292ra100.
[36] 刘风翔, 张礼豪, 黄霞. 拉曼光谱技术在肿瘤诊断中的应用[J]. 激光与光电子学进展, 2022, 59(6): 0617016.
[37] Freudiger C W, Min W, Saar B G, et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy[J]. Science, 2008, 322(5909): 1857-1861.
[38] Orringer D A, Pandian B, Niknafs Y S, et al. Rapid intraoperative histology of unprocessed surgical specimens via fibre-laser-based stimulated Raman scattering microscopy[J]. Nature Biomedical Engineering, 2017, 1: 27.
[39] Kuzmin N V, Wesseling P, Hamer P C, et al. Third harmonic generation imaging for fast, label-free pathology of human brain tumors[J]. Biomedical Optics Express, 2016, 7(5): 1889-1904.
[40] Zhang Z Q, Groot M L, de Munck J C. Tensor regularized total variation for denoising of third harmonic generation images of brain tumors[J]. Journal of Biophotonics, 2019, 12(1): e201800129.
[41] Vajpeyi R. WHO classification of tumours: pathology and genetics of tumours of the breast and female genital organs[J]. Journal of Clinical Pathology, 2005, 58(6): 671-672.
[42] de Mascarel I, MacGrogan G, Mathoulin-Pélissier S, et al. Breast ductal carcinoma in situ with microinvasion: a definition supported by a long-term study of 1248 serially sectioned ductal carcinomas[J]. Cancer, 2002, 94(8): 2134-2142.
[43] Allred D C. Ductal carcinoma in situ: terminology, classification, and natural history[J]. JNCI Monographs, 2010, 2010(41): 134-138.
[44] Chen Z, Guo W H, Kang D Y, et al. Label-free identification of early stages of breast ductal carcinoma via multiphoton microscopy[J]. Scanning, 2020, 2020: 9670514.
[45] van Huizen L M G, Kuzmin N V, Barbé E, et al. Second and third harmonic generation microscopy visualizes key structural components in fresh unprocessed healthy human breast tissue[J]. Journal of Biophotonics, 2019, 12(6): e201800297.
[46] You S, Chaney E J, Tu H, et al. Label-free deep profiling of the tumor microenvironment[J]. Cancer Research, 2021, 81(9): 2534-2544.
[47] You S X, Sun Y, Chaney E J, et al. Slide-free virtual histochemistry (part I): development via nonlinear optics[J]. Biomedical Optics Express, 2018, 9(11): 5240-5252.
[48] You S X, Sun Y, Chaney E J, et al. Slide-free virtual histochemistry (part II): detection of field cancerization[J]. Biomedical Optics Express, 2018, 9(11): 5253-5268.
[49] Yang L X, Park J, Chaney E J, et al. Label-free multimodal nonlinear optical imaging of needle biopsy cores for intraoperative cancer diagnosis[J]. Journal of Biomedical Optics, 2022, 27(5): 056504.
[50] Jain M, Narula N, Aggarwal A, et al. Multiphoton microscopy: a potential "optical biopsy" tool for real-time evaluation of lung tumors without the need for exogenous contrast agents[J]. Archives of Pathology Laboratory Medicine, 2014, 138(8): 1037-1047.
[51] van Huizen L M G, Radonic T, van Mourik F, et al. Compact portable multiphoton microscopy reveals histopathological hallmarks of unprocessed lung tumor tissue in real time[J]. Translational Biophotonics, 2020, 2(4): e202000009.
[52] Kaldawy A, Segev Y, Lavie O, et al. Low-grade serous ovarian cancer: a review[J]. Gynecologic Oncology, 2016, 143(2): 433-438.
[53] Williams R M, Flesken-Nikitin A, Ellenson L H, et al. Strategies for high-resolution imaging of epithelial ovarian cancer by laparoscopic nonlinear microscopy[J]. Translational Oncology, 2010, 3(3): 181-194.
[54] Adur J, Pelegati V B, Costa L F L, et al. Recognition of serous ovarian tumors in human samples by multimodal nonlinear optical microscopy[J]. Journal of Biomedical Optics, 2011, 16(9): 096017.
[55] Adur J, Pelegati V B, de Thomaz A A, et al. Optical biomarkers of serous and mucinous human ovarian tumor assessed with nonlinear optics microscopies[J]. PLoS One, 2012, 7(10): e47007.
[56] Pouli D, Thieu H T, Genega E M, et al. Label-free, high-resolution optical metabolic imaging of human cervical precancers reveals potential for intraepithelial neoplasia diagnosis[J]. Cell Reports Medicine, 2020, 1(2): 100017.
[57] Urabe F, Kimura T, Ito K, et al. Urinary extracellular vesicles: a rising star in bladder cancer management[J]. Translational Andrology and Urology, 2021, 10(4): 1878-1889.
[58] Jaena P, Rebecca L K, Marina M, et al. Label-free optical redox ratio from urinary extracellular vesicles as a screening biomarker for bladder cancer[J]. American Journal of Cancer Research, 2022, 12(5): 2068-2083.
[59] Kok S D, Schaap P M R, van Dommelen L, et al. Compact portable higher harmonic generation microscopy for the real time assessment of unprocessed thyroid tissue[J]. Journal of Biophotonics, 2023: 202300079.
[60] Sun Y, You S X, Du X X, et al. Real-time three-dimensional histology-like imaging by label-free nonlinear optical microscopy[J]. Quantitative Imaging in Medicine and Surgery, 2020, 10(11): 2177-2190.
[61] Llewellyn M E, Barretto R P J, Delp S L, et al. Minimally invasive high-speed imaging of sarcomere contractile dynamics in mice and humans[J]. Nature, 2008, 454(7205): 784-788.
[62] Jung J C, Schnitzer M J. Multiphoton endoscopy[J]. Optics Letters, 2003, 28(11): 902-904.
[63] Schenke-Layland K, Riemann I, Damour O, et al. Two-photon microscopes and in vivo multiphoton tomographs: powerful diagnostic tools for tissue engineering and drug delivery[J]. Advanced Drug Delivery Reviews, 2006, 58(7): 878-896.
[64] König K. Clinical multiphoton tomography[J]. Journal of Biophotonics, 2008, 1(1): 13-23.
[65] Dimitrow E, Ziemer M, Koehler M J, et al. Sensitivity and specificity of multiphoton laser tomography for in vivo and ex vivo diagnosis of malignant melanoma[J]. Journal of Investigative Dermatology, 2009, 129(7): 1752-1758.
[66] Weinigel M, Breunig H G, Uchugonova A, et al. Multipurpose nonlinear optical imaging system for in vivo and ex vivo multimodal histology[J]. Journal of Medical Imaging, 2015, 2(1): 016003.
[67] Liang W X, Hall G, Messerschmidt B, et al. Nonlinear optical endomicroscopy for label-free functional histology in vivo[J]. Light: Science & Applications, 2017, 6(11): e17082.
[68] Li A, Hall G, Chen D F, et al. A biopsy-needle compatible varifocal multiphoton rigid probe for depth-resolved optical biopsy[J]. Journal of Biophotonics, 2019, 12(1): 201800229.
[69] 梁艳梅, 杨子晗, 尚建伟, 等. 口腔癌筛查与诊断的影像学技术及发展趋势[J]. 中国激光, 2023, 50(15): 1507101.
[70] Gunalan A, Mattos L S. Towards OCT-guided endoscopic laser surgery: a review[J]. Diagnostics, 2023, 13(4): 677.
[71] Tearney G J, Brezinski M E, Fujimoto J G, et al. Scanning single-mode fiber optic catheter-endoscope for optical coherence tomography[J]. Optics Letters, 1996, 21(7): 543-545.
[72] Xie T Q, Mukai D, Guo S G, et al. Fiber-optic-bundle-based optical coherence tomography[J]. Optics Letters, 2005, 30(14): 1803-1805.
[73] Benboujja F, Garcia J A, Beaudette K, et al. Intraoperative imaging of pediatric vocal fold lesions using optical coherence tomography[J]. Journal of Biomedical Optics, 2016, 21(1): 016007.
[74] Kim K H, Park B H, Maguluri G N, et al. Two-axis magnetically-driven MEMS scanning catheter for endoscopic high-speed optical coherence tomography[J]. Optics Express, 2007, 15(26): 18130-18140.
[75] Lombardini A, Mytskaniuk V, Sivankutty S, et al. High-resolution multimodal flexible coherent Raman endoscope[J]. Light: Science & Applications, 2018, 7: 10.
[76] Shen B L, Liu S W, Li Y P, et al. Deep learning autofluorescence-harmonic microscopy[J]. Light: Science & Applications, 2022, 11: 76.
[77] Choe K, Hontani Y, Wang T Y, et al. Intravital three-photon microscopy allows visualization over the entire depth of mouse lymph nodes[J]. Nature Immunology, 2022, 23(2): 330-340.
[78] Wang T Y, Ouzounov D G, Wu C Y, et al. Three-photon imaging of mouse brain structure and function through the intact skull[J]. Nature Methods, 2018, 15(10): 789-792.
Article Outline
薄启宇, 吴宇辰, 邱斯奇, 张志清. 三次谐波显微成像在肿瘤诊断中的应用进展[J]. 中国激光, 2024, 51(3): 0307101. Qiyu Bo, Yuchen Wu, Siqi Qiu, Zhiqing Zhang. Current Progress of Third Harmonic Generation Microscopy in Tumor Diagnosis[J]. Chinese Journal of Lasers, 2024, 51(3): 0307101.