溶剂化对有机给、受体分子热激活延迟荧光的影响及调控  下载: 517次
下载: 517次
1 引言
近年来,具有高发光效率的有机给受体体系的热激活延迟荧光(Thermally activated delayed fluorescence,TADF)分子成为制备有机发光二极管(Organic light-emitting diodes,OLEDs)器件的一种新型发光材料,在照明、显示以及生物医疗等领域引起了极大关注[1-9]。与传统的荧光材料只能捕获单线态(25%)相比,TADF材料理论上不仅可以捕获单重态激子,还可以通过反向系间窜越(Reversible intersystem crossing,RISC)将三重态激子(75%)布居(Populate)到辐射发光的单重态上,从而可以实现100%的内量子效率。TADF材料是纯有机结构材料,不像磷光材料常含有贵重金属[10-11],故具有资源丰富、材料稳定、易制备、低成本等优势,对OLEDs器件商业应用的长期发展具有重要意义[12-13]。
热激活延迟荧光现象是Boudin于1930年首次发现的。随后,Parker和Hatchard对这一现象做出了科学的解释[5]。通常来讲,热激活延迟荧光现象能否发生取决于最低三重态T1向第一激发单重态S1转换的反向系间窜越过程是否高效。而获得高效RISC的一个关键因素则是得到足够小的S1和T1之间的能量差(ΔES-T)。理论上,单重态能量(ES)为轨道能量(E)、电子排斥能(K)与交换能(J)三项能量之和,三重态能量(ET)为前两项能量之和减去交换能(J)[14-15]
大量的TADF分子机理研究发现单、三重态的自旋轨道耦合(Spin-orbital coupling,SOC)也会影响RISC过程[22-31]。原则上,TADF分子的最低三重电荷转移激发态(The triplet charge transfer state,3CT)和最低单重电荷转移激发态(The singlet charge transfer state,1CT)具有相同类型的电子跃迁,二者间的SOC很弱[32]
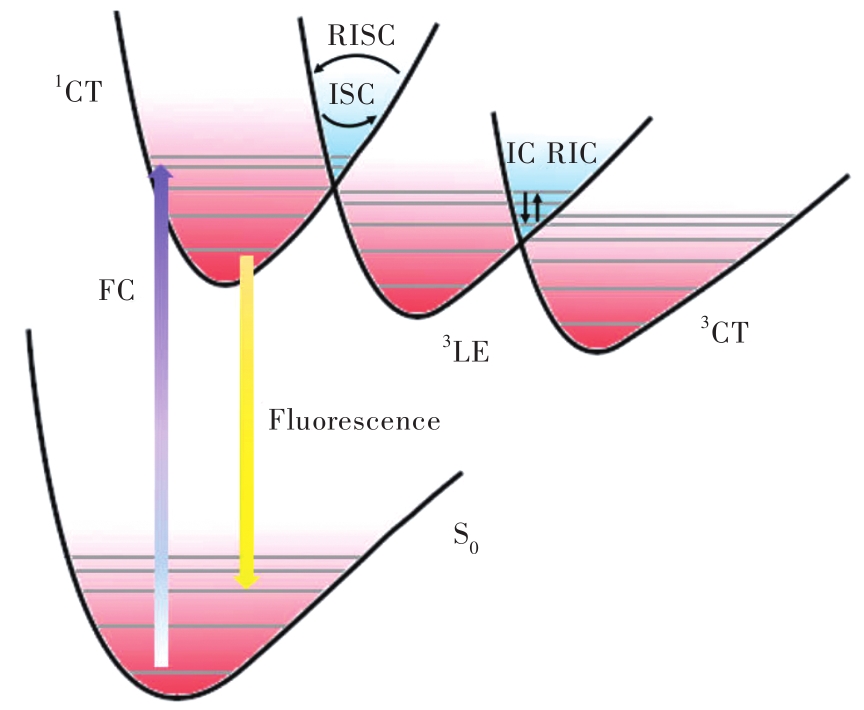
图 1. RISC过程示意图。其中FC代表垂直激发,IC 代表内转换,RIC代表反向的内转换。
Fig. 1. The RISC process. FC represents the vertical excitation. IC is the abbreviation for internal conversion,and RIC means the reverse IC.
分子的化学结构及其构象从本质上决定了一个ICT分子的电子激发态特性,这对于获得高效的RISC至关重要[35-38]。对于一个预扭转的D-A型分子而言,其D-A基团之间的空间位阻影响了若干低激发态的能量,尤其是电荷转移态CT的能量[39]。当分子被激励时,这种预扭转的分子结构常常会发生改变。改变后的激发态分子结构会影响低激发态的能级次序、跃迁性质(如纯CT态变为部分CT性质)、弛豫路径,甚至影响延迟荧光的发射[40-41]。而激发态分子结构扭转的影响,关键是取决于激发态时D-A基团二面角的大小,角度越接近90°,ΔES-T就越小,TADF就越强。
除了构象效应之外,分子所处的环境,比如溶剂的极性和粘度等,也会影响ICT分子的发光行为[42-51]。当溶质分子被激励到激发态时,周围的溶剂分子会发生重新排布,同时被激发的溶质分子在弛豫过程中也会将多余的能量转移给周围的介质,这一过程称为溶剂化过程。这种溶剂化过程广泛存在,它反映的是生色团周围的介电环境对生色团的基态和激发态的偶极矩变化的响应。这种溶剂环境对生色团基态和激发态偶极矩变化的响应会导致生色团的激发态演化途径的改变,从而会改变激发态化学反应的途径。比如,已有研究表明TADF分子被激发到1CT后,它的偶极矩增大,与周围环境,特别是与溶剂分子发生强烈的偶极-偶极相互作用。当ICT分子与溶剂发生偶极-偶极相互作用时,ICT分子通过转移给溶剂多余的能量,从而稳定在能量降低的发光态,这体现在荧光光谱上观测到发射峰红移。而且,溶剂极性越高,发射峰红移越大[52-54]。再比如,溶剂的扰动还会导致对称分子激发态对称性破坏电荷转移(或分离),并使发色团稳定在极化状态上,这一过程也称之为溶剂化诱导的构象弛豫。它的光谱特点通常是在发射光谱上观察到明显的溶剂化显色效应,而吸收光谱却随极性增加无明显变化[1, 55]。在液相中,溶剂化过程通常发生在皮秒、甚至飞秒的时间尺度上,而且常与激发后的振动弛豫和ICT过程相耦合[56-59]。比如,在极性溶剂中,空间对称并具有结构灵活性的给体-受体-给体(Donor-acceptor-donor, D-A-D)型分子的瞬态吸收光谱上展现了明确的溶剂化和构象弛豫耦合的光谱演化特征[56-58]。在OLED 等固态器件中,TADF分子作为发光层往往采取主客体掺杂的形式以共蒸或旋涂的方式制备成膜,此时,主体材料的极性环境对TADF分子光物理性能影响甚大,即所谓的固态溶剂化效应[60-62]。与液态中的溶剂-溶质相互作用类似,基底中的掺杂物TADF分子在光诱导下电子组态、偶极矩也会发生变化,主体材料也会在超快时间尺度下发生介电环境的变化,从而降低溶质(掺杂物激发态分子)⁃溶剂(主体材料)系统的能量。总之,溶剂化过程泛指生色团或者固体里发光中心因为基态和激发态固有偶极矩不同而导致周围介电环境重新响应的程度不同,进而影响激发态演化的过程和化学反应途径的改变。正是因为溶剂化的复杂性,导致目前人们无法用合适的方程或者模型来描述复杂体系的溶剂化过程,因而需要更多的课题组来专门从事溶剂化相关的激发态过程的研究。
此外,在固态下掺杂物和主体材料的分子运动、旋转明显受到空间的束缚。空间的束缚也使TADF分子的D-A基团二面角的扭转受限,这导致在激发态时,TADF分子的D-A基团二面角的扭转程度可能是不同的,因而ΔES-T存在一定的分布。受此影响,延时荧光的寿命也存在不同[63-64]。从这一点上说,尽管固态溶剂化过程也遵循偶极-偶极相互作用,但它比液相溶剂化过程更加复杂[23, 60-64]。由于TADF分子最终将应用在OLED 固态器件中,固态溶剂化效应将会影响主体材料的选择,是未来研究溶剂化对TADF材料发光效率影响的重要内容之一。然而,无论在液相还是在固态中,快速且复杂的溶剂化过程均大大地增加了理解ICT过程及其复杂的光谱性质的难度,这使得包括RISC过程在内的TADF材料激发态动力学研究更富有挑战性。由于激发态动力学对阐明TADF材料发射机制具有重要作用,因此揭示不同极性溶剂环境下溶剂-溶质的相互作用如何影响ICT型TADF材料激发态动力学是十分必要的。
本文主要综述了本研究小组近年来在溶剂化对延迟荧光的影响及调控方面所取得的进展。我们采用了稳态光谱技术、瞬态(飞秒和纳秒)光谱技术,并结合量子化学计算,以不同类型:给体-π-受体(Donor-π-acceptor, D-π-A)型,给体-π-受体-π-给体(Donor-π-acceptor-π-donor, D-π-A-π-D)型和D-A型及其二聚体的TADF分子中的典型分子:tri-phenoxazine-2,4,6-triphenyl-1,3,5-triazine(tri-PXZ-TRZ)、2,6-bis[4-(diphenylamino)phenyl]-9,10-anthraquinone(AQ(PhDPA)2)、(5r,6s)-5,6-di(9H-carbazol-9-yl)-2-cyclohexylisoindoline-1,3-dione(AI-Cz)和2,2'-((1R,2R)-cyclohexyl-1,2 disubstituted)di(5,6-di9H-carbazolyl-isoindoline-1,3 dione(CaI-Cz)作为模型体系(

图 2. 不同D-A体系tri-PXZ-TRZ(a)、AQ(PhDPA)2(b)、AI-Cz(c)、CaI-Cz(d)的分子结构。
Fig. 2. Molecular structures of different D-A systems.(a)tri-PXZ-TRZ.(b)AQ(PhDPA)2.(c)AI-Cz.(d)CaI-Cz.
2 D⁃π⁃A型TADF分子:tri⁃PXZ⁃TRZ分子
tri-phenoxazine-2,4,6-triphenyl-1,3,5-triazine(tri-PXZ-TRZ)是典型的D-π-A型延迟荧光分子[65],具有很强的延迟荧光[66]。如
该分子tri-PXZ-TRZ因为基态的偶极矩非常小,吸收光谱在不同极性溶剂里基本一样,但是它的荧光发射峰具有很强的溶剂极性依赖性,会随着溶剂极性的增加而不断红移(

图 3. (a)tri-PXZ-TRZ分子在甲苯(Toluene)与四氢呋喃(Tetrahydrofuran,THF)中的紫外-可见吸收光谱与荧光光谱;(b)不同溶剂中tri-PXZ-TRZ分子的稳态荧光光谱。其中MS为甲苯与四氢呋喃的混合溶剂。MS1的混合比例为8∶2,MS2的混合比例为3∶7。
Fig. 3. (a)Ultraviolet-visible absorption and fluorescence spectra of tri-PXZ-TRZ molecules in toluene and tetrahydrofuran(THF).(b)Steady-state fluorescence spectra of tri-PXZ-TRZ molecules in different solvents. MS is a mixed solvent of toluene and tetrahydrofuran. The mixing ratio of MS1 is 8∶2. The mixing ratio of MS2 is 3∶7.
飞秒瞬态吸收、纳秒时间分辨闪光光解实验进一步揭示了溶剂化对tri-PXZ-TRZ 分子激发态动力学的重要影响。

图 4. tri-PXZ-TRZ在甲苯(Toluene)与四氢呋喃(Tetrahydrofuran,THF)溶液中的瞬态吸收光谱
Fig. 4. Transient absorption spectra of tri-PXZ-TRZ in toluene and tetrahydrofuran(THF)
因此,我们提出了极性溶剂中激发态的溶剂化过程与单重激发态到三重激发态的系间窜越过程的竞争机制,阐明了延迟荧光猝灭的原理:由于剧烈的溶剂化作用使绝大部分电子弛豫到了溶剂稳定的电荷转移态,只有极少S1态分子通过系间窜越到了三重激发态。同时,由于强烈的溶剂与溶质的相互作用,使得非辐射速率增加,该分子的荧光量子产率降低。这些结果为热延迟荧光材料的应用与合成提供了理论指导。
3 D⁃π⁃A⁃π⁃D型TADF分子:AQ⁃(PhDPA)2
2,6-双[4-二苯胺基苯基]-9,10-蒽醌(2,6-bis[4-(diphenylamino)phenyl]-9,10-anthraquinone,AQ-(PhDPA)2)[67]是一种新型的高效延迟荧光分子[68],具有双极D-π-A-π-D的对称结构,其分子结构如
对于双极对称的D-A-D型分子,强极性溶剂环境会导致弛豫的对称性破缺态(Symmetry-broken state),这一过程也称之为溶剂化诱导的构象弛豫。这种效应对于分子的激发态尤为敏感,而对于基态分子影响很小。因此稳态发射光谱表现出明显的溶剂化显色效应,而稳态吸收光谱随着溶剂极性的增加变化轻微。这种效应最重要的影响是在极性溶剂THF中AQ(PhDPA)2分子无法观察到延迟荧光。为了限制这种分子构象弛豫,我们采用了非极性溶剂甲苯稀释的非极性Zeonex掺杂膜和纯AQ(PhDPA)2膜(固态)作为分子的环境,并调制了溶液的粘度来限制蒽醌受体和二苯胺基给体所在的两个平面预扭曲,使它们在激发态时可以保持较大的角度(约70°),从而保证了ΔES-T的最小化。实验结果发现,在甲苯的掺杂膜中TADF的产率(ΦTADF)较大,并且ΦTADF随着溶液粘度的增大而增大。
为了理解激发态的弛豫过程,飞秒瞬态吸收光谱帮助我们确认了在皮秒-纳秒时间尺度上的激发态动力学(其动力学模型见
表 1. 纳秒激光激发下 AQ(PhDPA)2 在不同粘度的溶剂和掺杂膜中的弛豫动力学参数
Table 1. Relaxation kinetics parameters of AQ(PhDPA)2 in solvents with different viscosities and the doping film upon nanosecond laser excitation
|

图 5. AQ(PhDPA)2在甲苯(a)和四氢呋喃(b)溶液中的弛豫模型
Fig. 5. Relaxation models of AQ(PhDPA)2 in toluene(a)and tetrahydrofuran(THF)(b)
纳秒时间分辨的闪光光解实验进一步描述了在纳秒-微秒时间尺度的激发态动力学(其动力学模型见
稳态和瞬态的实验结果以及量子化学计算结果表明,构象弛豫在AQ(PhDPA)2分子的RISC和TADF过程中扮演着重要的角色。对AQ(PhDPA)2分子而言,苯基桥连的D-π-A-π-D结构具有很大的扭转自由度。当分子布居到三重态时,受体和给体之间的扭转角度减小,不利于HOMO和LUMO轨道的分离,导致ΔES-T增大,因此抑制三重态的构象弛豫,对于实现高效TADF非常重要。鉴于AQ(PhDPA)2分子具有很强的溶剂化效应,人们可以通过调节溶剂的极性和粘度来限制这种构型弛豫,从而达到调控RISC速率和TADF的发光效率的目的。或者,对这种预扭转的D-A-D型分子引入一些适当的基团,减小它的扭转自由度,以限制它的激发态的构型弛豫。
4 D⁃A型TADF分子及二聚体:AI⁃Cz(单体分子)和CaI⁃Cz(二聚体分子)
(5r,6s)-5,6-di(9H-carbazol-9-yl)-2-cyclohexylisoindoline-1,3-dione(AI-Cz)[69]是近年来新发展的一种高效TADF分子,使用它作为掺杂剂的有机发光二极管的性能优异,外部量子效率高达23.2%[70]。在单体基础上发展起来的二聚体2,2'-((1R,2R)-cyclohexyl-1,2 disubstituted)di(5,6-di9H-carbazolyl-isoindoline-1,3 dione(CaI-Cz)[69]是首批圆偏振发光二极管的TADF材料,具有约19.7%的外部量子产率[71]。在AI-Cz和CaI-Cz的结构中(
激发态的计算结果发现这两个分子被激发后,给受体的二面角在激发态构型中更加扭转,角度变得更大,这使得电子给受体之间的共轭性质进一步减弱,有利于得到更小的ΔES-T。所以该分子在激发态演化过程中存在一个由小角度到大角度扭转的过程,这一过程有利于增强TADF的产率。例如,从S0态到电荷转移态S1,单体给受体之间的二面角增加了36°,HOMO和LUMO的轨道 重叠系数Iij则从基态的4.457×10-4 a.u.降到了0.394×10-4 a.u.,从而有效地分离了轨道,ΔES-T下降到0.016 eV;二聚体其中一支的结构没有明显变化,另一支则与单体的情况一样,给受体的二面角增加了30°左右,轨道重叠系数Iij则从基态的1.803×10-4 a.u.降到了0.471×10-4 a.u.,ΔES-T也因此变得更小,为0.021 eV。正如引言所述,ΔES-T越小,kRISC将越大,延迟荧光的量子产率也越高。激发态构象的进一步扭转,很可能是单体和二聚体具有很高TADF量子产率的原因之一。这种有利于RISC和TADF的激发态结构变化是否会受到溶剂化效应的影响和调控呢?
可以发现,单体和二聚体在溶液中存在明显的溶剂化效应,具体表现为随着极性增大,稳态吸收光谱有明显的蓝移,而稳态荧光光谱则发生了显著的红移。极性依赖的荧光产率实验表明,无论单体还是二聚体,它们的荧光发射过程均宜在非极性溶剂中进行,因为快速荧光量子产率和延迟荧光量子产率在非极性溶剂中都比在极性溶剂中大2~3倍;溶剂粘度相关的控制实验证实单体、二聚体的快速荧光量子产率与粘度无关,而延迟荧光量子产率的大小与粘度成反比。粘度大的非极性溶剂削弱或限制了激发态的构象扭转,因而导致TADF产率下降。值得注意的是,同样条件下,单体的延迟荧光组分的比例高于二体。

图 6. 分子结构变化导致ΔES-T的改变
Fig. 6. Alterations of ΔES-T values induced by molecular structure changes
飞秒和纳秒时间分辨光谱测量证实了单体和二聚体的发光态S1都会先经历一个快速的溶剂化过程和构象扭转过程,且单体的溶剂化相关的构象扭转动力学要快于二聚体,然后通过两个通道回到基态:快速荧光过程和经历ISC到三重态、再经历RISC回到S1态发射延迟荧光的过程。但在极性溶剂中,由于溶剂和溶质的相互作用导致非辐射跃迁增强,因此削弱了S1的快速荧光和延迟荧光。当更换粘度更大的非极性溶剂时,S1的构象扭转受限,ISC速率也变慢。
通过量化计算、稳态光谱及超快光谱,我们阐述了激发态构象扭转、溶剂化作用与TADF性质的关系,并发现单体的TADF性质明显优于二体。根据研究结果我们指出,只有那种激发态二面角变大且构象稳定的D-A分子有利于减小ΔES-T。因此,在实际TADF分子设计和合成过程中,可以通过增大D-A二面角并通过空间位阻作用或增强分子刚性来合成ΔES-T较小、构象稳定的分子,从而可以控制RISC过程并得到高效的TADF分子。
5 总结
综上所述,反向系间窜越和延迟荧光发射取决于由分子结构(构象)决定的TADF分子的激发态特性。为降低TADF分子的ΔES-T,一般TADF分子都会有预扭转的D-A结构。然而,当分子吸收光跃迁至激发态后,其分子构象往往会发生变化(有角度变大、也有角度变小),这种激发态构象的变化对ΔES-T产生明显的影响。另外,由于D-A型TADF分子的激发态固有偶极矩明显大于基态的固有偶极矩,其激发态弛豫过程会受到溶剂的偶极-偶极作用,发生溶剂化过程。这种溶剂化过程在溶液和固态中均会发生。
上面介绍的tri-PXZ-TRZ分子、AQ(PhDPA)2、AI-Cz(单体)和CaI-Cz(二聚体)是高效的不同类型(D-π-A、D-π-A-π-D、D-A)的TADF分子。我们借助理论计算和飞秒-纳秒瞬态吸收光谱研究了从光激发到正常荧光和延迟荧光的辐射过程,并讨论了溶剂极性和激发态结构弛豫对荧光特性的影响。结果发现强极性溶剂的溶剂化作用会导致ΔES-T减小(因为降低了单重态能级),但同时强烈的溶剂化作用也会增加非辐射弛豫,并导致发生ISC的分子布居数(Population)减小,延迟荧光也因此减弱,甚至消失。理论计算和稳态光谱推测AQ(PhDPA)2、AI-Cz和CAI-Cz在激发态存在构象扭转。有趣的是,瞬态光谱实验表明,AQ(PhDPA)2的构象弛豫发生在CT三重态,而AI-Cz和CaI-Cz的构象弛豫发生在CT单重态。前者导致了部分3CT稳定在不发光的三重态上,削弱了RISC,增大溶剂粘度或掺杂在非极性基底 Zeonex的薄膜中会抑制3CT的构象弛豫,有利于保持较小的ΔES-T,进而获得高效的RISC和延迟荧光。而后者会得到有利于HOMO、LUMO分离的构象,增大溶剂粘度则会限制激发态分子的自由扭转,不利于ISC和RISC。结果显示,激发态分子的构象弛豫与溶剂化作用对热激活延迟荧光分子的反向系间窜越和延迟荧光发射有着显著的影响。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20230079.
[6] 马志华, 马荣荣, 董文月, 等. 树枝状热活化延迟荧光材料研究进展[J]. 发光学报, 2021, 42(7): 904-916.
[7] 吴育南, 何缘, 靳焘, 等. 空间电荷转移热活性延迟荧光化合物的合成和应用[J]. 发光学报, 2023.
[8] 曹云锋, 李旭萍, 卢建军. 基于热活化延迟荧光双发射的有机电子给体-受体型材料研究进展[J]. 发光学报, 2021, 42(9): 1386-1395.
[9] 陆梦瑶, 宋祥安, 邹盛南, 等. 基于嘧啶及其衍生物受体的热激活延迟荧光材料研究进展[J]. 发光学报, 2022, 43(12): 1892-1904.
[15] TURRON J. Modern Molecular Photochemistry [M]. Menlo Park, CA: Benjamin/Cummings Publisher, 1978.
Article Outline
宋迪, 郑天睿, 匡卓然, 夏安东. 溶剂化对有机给、受体分子热激活延迟荧光的影响及调控[J]. 发光学报, 2023, 44(7): 1239. Di SONG, Tianrui ZHENG, Zhuoran KUANG, Andong XIA. Effect of Solvation on Thermally Activated Delayed Fluorescence Within Electron Donor/Acceptor Chromophores[J]. Chinese Journal of Luminescence, 2023, 44(7): 1239.



