飞秒激光双光子聚合制备3D水凝胶微结构及其应用
Extracellular matrix (ECM), which has an important impact on cell morphogenesis, adhesion, proliferation, and differentiation, is a dynamic and complex microenvironment. However, the mechanism by which cells receive and process information through ECM remains unclear. Therefore, investigating the mechanism of interaction between cells and the ECM will be of great significance in cell culture, tissue engineering, and other fields.
Research has shown that the microstructure of a material surface can regulate the proliferation, differentiation, and migration of cells. Hydrogels have a certain geometric shape and moisture content similar to soft tissue, and thus can simulate the ECM in vitro as well as locate and deliver therapeutic proteins in a controlled manner as a vehicle for cell transplantation. The patterned surfaces of hydrogels, cell scaffolds, and other microstructures prepared via micro/nano fabrication technology can simulate the growth and development environment of cells in vitro, particularly in a three-dimensional (3D) environment, enabling analysis of the correlation between the shape and function of cells, as well as of the mechanism behind the interaction between cells and the matrix. Traditional methods for preparing hydrogel microstructures have shortcomings including low accuracy and difficulty in regulating the morphology, which limits their application in the future.
Two-photon polymerization (TPP) technology, which uses a deep-penetrating near-infrared laser as the light source, is a new micro-nano manufacturing technology with true 3D fabrication capability and high penetration depth. It can be used to fabricate 3D micro-nano structures with arbitrary high resolution and is widely used in micro-nano photonics, micro-electromechanical systems, tissue engineering, and other fields. The 3D hydrogel microstructure prepared using TPP technology has a controllable morphology, high precision, appropriate stiffness, and good biocompatibility. This can better simulate the in vitro microenvironment required in tissue engineering and other fields, demonstrating its great potential for practical applications in the biomedical field. However, most photoinitiators lead to residues in organic solvents, and the generated cytotoxicity has corresponding effects on the biological environment. Therefore, it is necessary to design and prepare biocompatible water-soluble TPP initiators.
In summary, the application of hydrogel microstructures prepared using TPP technology in cell culture has made some progress, but there are still a series of challenges in the design of biocompatible TPP photoinitiators as well as in the application of bionics, tissue engineering, and other fields. Therefore, it is essential to summarize the relevant research for a comprehensive understanding of the hurdles in the application of hydrogel microstructures and future development directions.
In this review, the principle of two-photon polymerization and the research progress on photoinitiators are briefly introduced. Moreover, synthesis methods for water-soluble TPP photoinitiators with high initiation efficiencies have been introduced, including host-guest chemistry, hydrophobic interactions, introduction of non-ionic surfactants, and modification of hydrophilic groups. To enable 3D hydrogel microstructures to be fully applied in the field of biomedicine, TPP photoinitiators must exhibit lower cytotoxicity. Xing et al. efficiently prepared water-soluble TPP photoinitiators with high TPA cross sections and low threshold power through the Witting reaction and host-guest chemical interactions, and fabricated a high-resolution 3D hydrogel microstructure. Gao et al. prepared a new ionic water-soluble carbazole photoinitiator through host-guest interactions (Fig.4) and achieved the low laser threshold of 3.7 mW and high resolution of 180 nm, while the 3D hydrogel microscaffold structure maintained great biocompatibility in an aqueous environment. Introducing a nonionic surfactant or modifying hydrophilic groups is a simple and efficient method for improving water solubility. Li et al. synthesized a series of cyclic benzylketone-based TPP photoinitiators containing sodium carboxylates to enhance the water solubility through an aldol condensation reaction. They were evaluated in the dark using the MG63 cell line and found to have low cytotoxicity. Subsequently, the preparation of a 3D hydrogel microstructure via TPP and its application in biomimetics and biomedicine are introduced. Inspired by the response of the flytrap to external stimuli, Wang et al. used femtosecond laser fabrication technology to obtain intelligent responsive hydrogel microdrivers based on bionic asymmetric structures (Fig.7), achieving and adjusting the grasping and release behavior of microtargets by changing the pH value. Zhang et al. designed and prepared a series of 3D hydrogel microscaffolds with different pore sizes using biocompatible materials, such as PEGDA and PE-3A. The porosity of the scaffold was adjusted from 69.7% to 89.3% by changing the pillars and pillar spacing of the scaffold, and by regulating the cell behavior of the 3D hydrogel microscaffolds with different pore sizes (Fig.12). Finally, problems in the application of 3D hydrogel microstructures and their development prospects are summarized.
In recent years, many studies have focused on developing photoinitiators with high initiation efficiencies and low thresholds. To realize photo-crosslinking in an aqueous environment, a series of water-soluble TPP photoinitiators with high initiation efficiencies have been designed and prepared, expanding their applications in biomedical fields such as tissue engineering and drug delivery. Although some progress has been achieved in research on water-soluble TPP photoinitiators, the specific polymerization mechanism in aqueous environments requires further exploration. However, current TPP technology cannot satisfy the requirement for the rapid preparation of a large number of hydrogel microstructures, which hinders the mass culture of cells and tissues in vitro. Therefore, in future, the rapid fabrication of large-area hydrogel microstructures using TPP should be considered.
1 引言
水凝胶是一种具有三维(3D)空间网络结构的交联聚合物材料,其亲水基团可与水分子结合,将水分子连接在网状结构内部,而疏水部分则遇水膨胀。水凝胶具有一定的几何外形以及与软组织相似的含水量,在保持形状的同时能够变形,这些特性不仅使其可在体外模拟细胞外基质(ECM),还能使其以可控的方式定位和递送治疗蛋白,作为细胞移植的运载工具,因而水凝胶在组织工程、药物递送、再生医学等生物医学领域被广泛应用[1-2]。制备水凝胶微结构的方法众多,包括光刻法[3]、湿法纺丝[4]、3D生物打印[5-6]、磁模板法[7]等。Nakashima等[8]通过光刻和湿法刻蚀,利用玻璃板上的海藻酸盐薄膜制备了不同细胞类型的细胞微图案,有助于改进由异质细胞形成的人工组织的制备方法。Yang等[9]通过湿法纺丝制备了直径可调的连续水凝胶微纤维,并发现微纤维的直径取决于灌注速度和凝固轮转速。Ersumo等[10]通过3D生物打印使用BioBots Beta气动挤出机制备了交联明胶基水凝胶,测试其力学性能和溶胀性能后发现其弹性模量和最佳挤出压力都随着聚合物含量的增加而增大,印刷分辨率随着印刷速度和喷嘴规格的增加而提高。Lacko等[11]利用磁模板法去除可溶磁性海藻酸盐颗粒在外加磁场下形成的具有一定取向的柱状结构后得到了排列整齐的管状微结构支架,该支架可促进细胞重塑。但是,上述微加工制备方法因比较复杂,而且制备出的微结构精细度不高、形貌不可调控等,限制了水凝胶微结构在生物医药领域的发展。
近年来,激光直写技术快速发展,目前已成为国内外的研究热点。其中的飞秒激光双光子聚合(TPP)加工技术采用近红外激光作为光源,是一种具有任意可设计真三维加工能力和高穿透深度的新型微纳制造技术,可以制备任意高分辨率的三维微纳结构,已被广泛应用于微纳光子学、微机电系统、组织工程、药物递送等领域。与单光子相比,双光子吸收概率与激光功率的平方成正比,因此光聚合反应仅仅发生在激光焦点中心处光子数密度极高的区域,可以突破光学衍射极限的限制,实现具有超高分辨率微纳结构的精细加工。
采用TPP加工技术制备的3D水凝胶微结构具有形貌可控、精度高、刚度适当以及良好的生物相容性等优势,可以更好地在体外模拟组织工程等领域所需的体内微环境(尤其是三维环境)中研究细胞形状与细胞功能之间的相关性,以及研究细胞与基质间相互作用背后的机理,因而在生物医学领域具有巨大的应用潜力[12]。Costa等[13]使用两种TPP装置(商业化TPP装置和定制的TPP装置)制备了基于木堆结构的3D支架,研究了支架尺寸及其力学性能对骨髓间充质干细胞黏附和增殖的影响。实验结果表明:涂覆纤维连接蛋白的大间隙木堆结构表现出了更高的增殖率,3D支架几何结构和材料的结合在共培养环境下细胞行为的研究方面具有很大潜力。Zhang等[14]采用TPP加工技术制备了生物相容性3D水凝胶微支架,并通过调节孔隙率(从69.7%到89.3%)研究了细胞行为的调制,结果显示:利用3D微支架可以实现对纤维状肌动蛋白形状的显著调控。Huang等[15]在多光子共聚焦扫描激光显微镜下,采用TPP技术使用含有亲水性光引发剂和甲基丙烯酸缩水甘油酯改性明胶的高生物相容性生物墨水,制备了封装正常小鼠成纤维细胞(L929)的3D水凝胶支架,并且未在激光照射区域内观察到对L929细胞的明显损伤。他们的实验结果显示:经4 d孵育后,支架内的L929增殖能力强且占据了支架内的大部分可用空间。这一结果验证了该生物墨水在生物打印领域的应用潜力。总而言之,不同于传统技术制备的水凝胶(精度低且缺陷不可控),通过TPP加工技术制备的水凝胶微结构具有形貌可控、加工分辨率高等优势,并且由于TPP的加工条件比较温和,使用近红外光进行激发,适合在细胞存在的情况下诱导聚合,因此具有良好的生物相容性,在生物打印、组织工程等生物医药领域具有广阔的应用前景。
目前的双光子聚合材料主要由光引发剂、单体及交联剂组成,可分为负性光刻胶和正性光刻胶,最常用的是含丙烯酸低聚物或环氧树脂的负性光刻胶。尽管丙烯酸酯类聚合物表现出了一定的生物相容性,但其水解产物具有毒性,采用该类材料制备的3D微支架在细胞培养时会影响细胞活性。制备水凝胶常用的光刻胶包括商业光刻胶、多糖、聚乙二醇(PEG)和蛋白质基光刻胶,它们可在光引发剂的作用下发生局域化反应。以丙烯酸酯或环氧化合物等有机基团功能化的无机(—Si—O—Si—)为主链的商业光刻胶有机改性陶瓷在双光子聚合加工技术中得到广泛应用。有机改性陶瓷具有大硬度、化学稳定性、热稳定性、光学透明性等优异性能,其有机侧链可以交联形成持久且具有生物相容性的固体。PEG已被美国食品药品监督管理局(FDA)批准作为食品添加剂、药物配方和化妆品等行业的原料,此外,其以良好的生物相容性被广泛用于组织工程,适合在TPP加工中用于制备3D水凝胶。
2 双光子聚合原理及加工系统
2.1 双光子聚合过程
双光子吸收(TPA)效应是指分子同时吸收两个能量低于其跃迁至最低激发态能级能量的光子,从基态跃迁至激发态的一种三阶非线性光学效应,其中吸收率与入射光强度呈非线性关系。单光子吸收和双光子吸收过程如
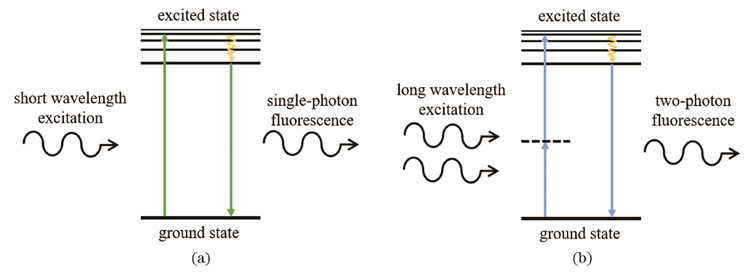
图 1. 单光子与双光子激发过程示意图。(a)单光子激发过程;(b)双光子激发过程
Fig. 1. Schematic diagrams of single-photon and two-photon excitation processes. (a) Single-photon excitation process; (b) two-photon excitation process
在双光子聚合过程中,由于单个近红外光光子的能量要远低于材料分子的吸收带隙,材料需要吸收两个光子的能量才能发生聚合,即光敏物质同时吸收两个光子后跃迁到激发态,紧接着分解产生自由基或阳离子等活性物种,从而引发单体发生聚合反应。由于材料的双光子吸收率与入射光强呈非线性关系,只有当激光焦点处的功率达到双光子聚合阈值时才能发生聚合反应,即该过程具有局域化激发的特点。因此,通过控制激光强度可以使达到双光子聚合阈值的材料区域远小于通过透镜聚焦后光斑的面积,从而使聚合结构的尺寸远小于光的衍射极限。
根据引发单体聚合的活性物种的不同,双光子聚合可分为自由基聚合和阳离子聚合。在此过程中,引发剂分子或染料敏化引发剂体系同时吸收两个光子跃迁到激发单重态,并通过系间窜越到达激发三重态,随后裂解产生自由基或阳离子等活性物种,或者通过夺取氢给体的质子产生自由基等活性物种。活性物种引发单体发生聚合反应,最终通过链终止或者链转移失活形成聚合物[16]。
2.2 双光子聚合加工系统
飞秒激光双光子微纳加工系统主要由光源、光束整形模块、三维样品台模块、实时观察模块和软件控制模块构成,如
3 双光子引发剂的研究进展
光刻胶是双光子聚合过程中必不可少的材料,可分为负性光刻胶和正性光刻胶,其基本成分通常为光引发剂、单体和交联剂。其中用于自由基生成的光引发剂在双光子聚合过程中至关重要,制备出的微结构的精度在很大程度上依赖于双光子引发剂的引发效率。双光子引发剂是TPP前驱体材料的重要组分之一,其在激光辐射下同时吸收两个能量较低的长波长光子,从基态跃迁到激发态,进而引发单体发生聚合。最初的关于双光子引发剂的分子设计策略由Perry和Marder提出[18-19],主要包括:1)具有较大TPA截面的发色基团;2)具有高引发效率的化学官能度;3)生色团的激发导致化学功能性激活的机制。由于分子内电荷转移是TPA的“驱动力”,因此需要电子给体或电子受体基团。此外,共面的π共轭桥导致的扩展电荷分离态是提高分子内电荷转移效率的重要因素。
双光子引发剂的引发效率会影响制备的3D微结构的分辨率,故而开发高效且具有生物相容性的双光子引发剂成为了研究热点。Xing等[20-23]设计合成了具有大TPA截面、低荧光量子效率和C2v对称结构的双光子引发剂,该双光子引发剂包括一系列蒽衍生物、蒽醌衍生物、咔唑衍生物等,如
![具有C2v对称结构的双光子引发剂[23]。(a)蒽醌类双光子引发剂;(b)咔唑类双光子引发剂;(c)蒽类双光子引发剂;(d)蒽醌类双光子引发剂与环糊精组装的水溶性双光子引发剂](/richHtml/zgjg/2023/50/21/2107401/img_03.jpg)
图 3. 具有C2v对称结构的双光子引发剂[23]。(a)蒽醌类双光子引发剂;(b)咔唑类双光子引发剂;(c)蒽类双光子引发剂;(d)蒽醌类双光子引发剂与环糊精组装的水溶性双光子引发剂
Fig. 3. TPP photoinitiator with C2v symmetric structure[23]. (a) Anthraquinone TPP photoinitiator; (b) carbazole TPP photoinitiator; (c) anthracene TPP photoinitiator; (d) water-soluble TPP photoinitiator assembled by anthraquinone TPP photoinitiator and cyclodextrin
双光子引发剂由于平面结构和共轭体系的存在导致其水溶性较差,往往需要在光刻胶体系中加入有机溶剂助溶。但有机溶剂残留易对生物环境造成较大影响,并且会导致制备的结构的精度差,从而限制了其在组织工程等生物医药领域的应用。因此,亟须发展水溶性好且具有良好双光子吸收特性的双光子引发剂。
Xing等[24]提出了一种采用主客体化学作用高效制备水溶性双光子引发剂的方法,即:先通过Wittig反应合成疏水性双光子引发剂2,7-二(2-(4-戊氧基-苯基)-乙烯基)蒽醌,再将其与2-羟丙基-β-环糊精进行组装,借助主客体化学作用制备出水溶性双光子引发剂,如
![利用量子化学模拟的主客体化学相互作用得到的水溶性双光子引发剂构型[26]。(a)BMVMC的优化结合构型示意图;(b)CB7的俯视图;(c)CB7的侧视图;(d)优化几何构型的CB7/BMVMC的俯视图;(e)CB7/BMVMC的侧视图](/richHtml/zgjg/2023/50/21/2107401/img_04.jpg)
图 4. 利用量子化学模拟的主客体化学相互作用得到的水溶性双光子引发剂构型[26]。(a)BMVMC的优化结合构型示意图;(b)CB7的俯视图;(c)CB7的侧视图;(d)优化几何构型的CB7/BMVMC的俯视图;(e)CB7/BMVMC的侧视图
Fig. 4. Configuration of water-soluble two-photon initiator obtained from the host-guest chemical interaction simulated by quantum chemistry[26]. (a) Optimized binding configurations of BMVMC; (b) bird view of CB7; (c) side view of CB7; (d) bird view of CB7/BMVMC with optimized geometrical configuration; (e) side view of CB7/BMVMC
另外,引入非离子表面活性剂或修饰亲水基团也可以制备出水溶性光引发剂。Jhaveri等[29]使用非离子表面活性剂PF127增加2,2-二甲氧基-2-苯基苯乙酮在水中的溶解度,通过引发甲基丙烯酸-2-羟乙酯和PEGDA聚合制备了水凝胶微结构。Li等[30]通过羟醛缩合反应合成了一系列含有羧酸钠盐(羧酸钠盐可以改善水溶性)的环状苄基酮类双光子引发剂,其化学结构如
![引入离子基团的水溶性双光子引发剂的化学结构[30]](/richHtml/zgjg/2023/50/21/2107401/img_05.jpg)
图 5. 引入离子基团的水溶性双光子引发剂的化学结构[30]
Fig. 5. Chemical structure of water-soluble TPP initiator with ionic groups[30]
双光子引发剂的引发效率在很大程度上决定了TPP的效率,而双光子引发剂引发效率的提高对于降低阈值功率、提高所制备微结构的分辨率有着重要意义。通过增加双光子引发剂的水溶性可以防止有机溶剂残留对生物环境造成的影响,从而降低细胞毒性。但若要将其应用于组织工程等生物医药领域还需要考虑双光子引发剂是否具有生物相容性和生物可降解性。目前制备水溶性双光子引发剂还存在一些挑战:引入修饰基团、利用主客体化学作用虽然可以在一定程度上改善引发剂的水溶性,但要将其应用于生物医药领域,还需要平衡好引发效率和生物相容性,以制备兼具高引发效率和生物可降解性的水溶性双光子引发剂。
4 TPP加工制备水凝胶微结构及其应用
4.1 TPP加工制备水凝胶微结构
用于生物医药领域的水凝胶通常来源于人工合成材料或天然衍生材料。合成材料的性能便于控制,但普遍缺乏生物相容性;明胶、蛋白质、透明质酸等天然衍生材料虽然具有良好的生物相容性,但其力学性能通常较差,需要进行一定的化学修饰。国内外使用合成/天然水凝胶以及对其进行化学修饰的水凝胶材料制备了一系列水凝胶微结构。
人工合成水凝胶材料的性能可调控,通常具有良好的力学性能,如丙烯酰胺类水凝胶材料等,可用于微驱动器、微流控等领域。孙洪波课题组[32]通过飞秒激光直写离子交换光致聚合物聚(2-丙烯酰胺基-2-甲基-1-丙磺酸)制备了离子交换微结构,在水溶液中带负电荷的微结构可以通过静电作用吸附带正电荷的金属离子、纳米颗粒或蛋白质,用于芯片功能化的部件。离子交换微结构在柔性芯片功能化方面展现出了应用潜力,为器官芯片系统提供了新的可能。Scarpa等[33]采用一种优化的方案实现了高分子质量(10 kDa,1 Da=1 u)PEGDA的TPP制备,获得了金字塔和圆顶状微结构。在微尺度下对微结构进行力学表征和pH响应性测试,结果显示,可以通过调节PEGDA的浓度和/或几何形状来改变所制备结构的溶胀响应,为自主设计与制备具有机械和pH响应性能的3D水凝胶微结构提供了途径,该微结构有望用于生物传感器或作为执行器、泵和微筛的微流控平台。Xiong等[34]采用含有0.96%(质量分数)Fe3O4纳米颗粒的磁性凝胶光刻胶制备了磁场驱动的3D水凝胶微结构,并详细研究了含有不同Fe3O4纳米颗粒的凝胶光刻胶的TPP加工特性,结果显示:Fe3O4纳米颗粒质量分数为0.32%的凝胶光刻胶的双光子聚合线宽最小可达106 nm,长度为12.4 μm、直径为10.6 μm的3D水凝胶微钉结构在外磁场驱动下发生了明显且可逆的弯曲行为。Xing等[28]利用水溶性双光子引发剂在接近TPP阈值功率的激光下制备了高精度模拟腺病毒形貌的微结构,如
![TPP制备的3D水凝胶微结构的扫描电子显微镜(SEM)图像。(a)腺病毒水凝胶微结构[28];(b)红细胞微结构[35];(c)莲花状微结构、内部有悬浮球的立方体框架微结构及微柱阵列上的水凝胶“桥”微结构[36];(d)三维木堆微结构[24];(e)单层蜘蛛网微结构[37]](/richHtml/zgjg/2023/50/21/2107401/img_06.jpg)
图 6. TPP制备的3D水凝胶微结构的扫描电子显微镜(SEM)图像。(a)腺病毒水凝胶微结构[28];(b)红细胞微结构[35];(c)莲花状微结构、内部有悬浮球的立方体框架微结构及微柱阵列上的水凝胶“桥”微结构[36];(d)三维木堆微结构[24];(e)单层蜘蛛网微结构[37]
Fig. 6. Scanning electron microscopy (SEM) images of three-dimensional (3D) hydrogel microstructure prepared by TPP. (a) Adenovirus hydrogel microstructure[28]; (b) red blood cell microstructure[35]; (c) lotus-like microstructure, cube frame microstructure with suspended spheres inside and hydrogel “bridge” microstructure on the micro column array[36]; (d) 3D woodpile microstructure[24]; (e) single-layer spider web microstructure[37]
组织工程等生物医药领域往往对水凝胶微结构的生物相容性、生物可降解性有着更高的要求,因此,常用天然水凝胶材料作为水凝胶前驱体,如明胶基、蛋白基等水凝胶材料。Yuan等[37]采用质量浓度为12%的光敏性GelMA水凝胶溶液,在激光扫描速度为150 μm/s、激光功率为7.8 mW、层间距为150 nm的条件下,制备了具有良好生物相容性的单层蜘蛛网形3D微支架,如
4.2 3D水凝胶微结构在仿生学中的应用
刺激响应行为是生命系统中的一个基本现象。在自然界中,动植物的刺激响应行为与其生存、繁衍息息相关,模仿自然界中的刺激响应行为对于解决生命科学中存在的问题具有重要意义。近年来,受自然界生物刺激响应行为的启发,基于仿生学的具有响应外界刺激并产生可控形变能力的水凝胶微器件引起了研究人员的兴趣,这些基于pH、温度、湿度[42]等条件的刺激响应型微器件可以应用于仿生器件、可穿戴电子设备、精密传感器等领域。
Xiong等[43]采用一种非对称TPP微加工方法制备了尺寸和形状可控的刺激响应型非对称水凝胶微悬臂梁结构,如
![TPP制备的刺激响应型微结构。(a)可逆离子响应型水凝胶微悬臂梁在水、1 mol/L NaCl溶液、再次在水中的SEM图像以及干燥微悬臂梁的SEM图像[43];(b)仿冠状病毒、梅花、乌龟微结构[27];(c)仿生水凝胶微驱动器捕获和释放行为示意图及明场图像[44];(d)有无光刺激时微柱纤毛的示意图和光学显微照片[45];(e)无光刺激和有光刺激时微型心脏的光学显微照片[45]](/richHtml/zgjg/2023/50/21/2107401/img_07.jpg)
图 7. TPP制备的刺激响应型微结构。(a)可逆离子响应型水凝胶微悬臂梁在水、1 mol/L NaCl溶液、再次在水中的SEM图像以及干燥微悬臂梁的SEM图像[43];(b)仿冠状病毒、梅花、乌龟微结构[27];(c)仿生水凝胶微驱动器捕获和释放行为示意图及明场图像[44];(d)有无光刺激时微柱纤毛的示意图和光学显微照片[45];(e)无光刺激和有光刺激时微型心脏的光学显微照片[45]
Fig. 7. Microstructures with stimulus-response fabricated by TPP. (a) SEM images of reversible ion responsive hydrogel microcantilever in water, 1 mol/L NaCl solution, again in water and dry microcantilever[43];(b) microstructures of imitated coronavirus, plum blossom and tortoise[27];(c) schematic diagrams and bright field images of capture and release behavior of biomimetic hydrogel micro actuator[44];(d) schematic and optical micrographs of the micropillar cilia with and without light stimulation[45];(e) optical micrograph of the micro heart without and with light stimulation[45]
此外,Lee等[46]制备了整体尺寸为10~30 μm且形状不同的三维BSA蛋白水凝胶微结构,并通过在纳米尺度上对激光写入z轴距离进行纳米级调制来控制BSA的交联密度,进而以高精度量化和控制微结构的溶胀程度,实现了可控的定向响应性。Lee等采用这种分段模量的方法设计了具有刺激诱导手性的形状变化的微结构,并制造了能响应pH变化的自支撑三维微捕获器,如
![具有刺激响应的仿生微器件。(a)BSA蛋白动态可逆3D陷阱状结构的光学显微镜和3D拉曼成像检测结果(pH为5时表现为直立和“打开”,pH从5变化到11时,4个双柱结构向内弯曲,相互靠近)[46];(b)具有可逆形变的3D熊猫浮雕在改变pH值时的共聚焦荧光图像[47];(c)pH值从13切换到5时微蜘蛛的驱动[48];(d)操纵的真实过程(定位、驱动、搬运、释放)[48]](/richHtml/zgjg/2023/50/21/2107401/img_08.jpg)
图 8. 具有刺激响应的仿生微器件。(a)BSA蛋白动态可逆3D陷阱状结构的光学显微镜和3D拉曼成像检测结果(pH为5时表现为直立和“打开”,pH从5变化到11时,4个双柱结构向内弯曲,相互靠近)[46];(b)具有可逆形变的3D熊猫浮雕在改变pH值时的共聚焦荧光图像[47];(c)pH值从13切换到5时微蜘蛛的驱动[48];(d)操纵的真实过程(定位、驱动、搬运、释放)[48]
Fig. 8. Bionic micro-device with stimulus-response. (a) Dynamic reversible 3D trap structure of BSA protein was detected by optical microscope and 3D Raman imaging (the structure was upright and “open” when pH was 5, and four double-column structures bent inward and closed to each other when pH changed from 5 to 11)[46];(b) confocal fluorescence images of the 3D panda relief with reversible deformation at changing pH values[47]; (c) actuation of the micro-spider when the pH value was switched from 13 to 5[48];(d) actual process of manipulation (positioning, driving, handling, and releasing)[48]
结构色是可见光在微纳米尺度上与某些结构特征发生散射、衍射或干涉而产生的颜色,如蝴蝶的翅膀及贝壳表面的颜色会随着观察角度的变化而改变。刺激响应型结构色(SCs)表面可通过外界刺激产生可调的光学性能,从而应用于微传感器、防伪等领域。在信息加/解密[50]和智能执行器等微功能结构领域,SCs可以起到增强可视化和提高识别性的作用。传统的制备宏观SCs表面的方法因需要固定的模板或复杂的后处理,而且其结构变形所需的pH往往不适合生物医学应用,因而并不适用于制备微观多色SCs表面。利用TPP技术通过飞秒激光直写4D打印微观SCs表面已经被用于构建微执行器[51]等领域。Liu等[52]通过飞秒激光直写法和改性的pH响应性水凝胶在溶液条件下实现了4D打印的微观刺激响应型SCs表面。具有不同横向和轴向结构参数的3D正交光栅堆叠木堆结构因不同木堆层对透射光束的衍射而呈现出不同的颜色。调节溶液pH,双变色的鱼和蝴蝶图案化结构(如
![仿生刺激响应型结构色微器件[52]。(a)木堆结构的SEM图像;(b)在透射模式下用物镜观察到的原始或变形状态下木堆结构的不同颜色;(c)红、蓝木堆鱼在原始、变形和恢复状态下的颜色变化;(d)pH响应型蝴蝶图像](/richHtml/zgjg/2023/50/21/2107401/img_09.jpg)
图 9. 仿生刺激响应型结构色微器件[52]。(a)木堆结构的SEM图像;(b)在透射模式下用物镜观察到的原始或变形状态下木堆结构的不同颜色;(c)红、蓝木堆鱼在原始、变形和恢复状态下的颜色变化;(d)pH响应型蝴蝶图像
Fig. 9. Structural color micro-device with stimulus-response[52]. (a) SEM image of the woodpile structure;(b) different colors of woodpile structures in original or deformed status were observed by the objective lens in transmittance mode; (c) the color change of red and blue woodpile fish in original, deformed, and recover status, respectively;(d) images showing the pH-responsive butterfly painting
4.3 3D水凝胶微结构在生物医药领域的应用
TPP加工制备的水凝胶微结构在生物医药领域展现出了巨大潜力,因此水凝胶前驱体的生物相容性、生物可降解性、刺激响应性等物理化学性质受到了国内外的广泛关注。除了常用的含有丙烯酰胺类、PEG/PEGDA等的高分子材料以外,由糖类、蛋白质类、明胶衍生物等具有生物相容性材料制备的水凝胶微结构也被广泛研究,并被应用于药物递送、细胞工程等生物医药领域。
药物递送常用于靶向治疗,但将药物精准运输到病灶部位并释放仍具挑战性,因此可用于显微样品操控和靶向药物递送的微机器人受到广泛关注。在生物医学和生物工程领域,微型机器人因具有较小的尺寸以及在人体内的运行优势而在生物医药领域具有一定的应用潜力。Peters等[53]提出了一种由Fe3O4纳米颗粒、PEGDA和季戊四醇三丙烯酸酯组成的超顺磁性聚合物材料,其中水凝胶人工细菌鞭毛结构利用弱旋转磁场进行无线驱动,并基于螺旋推进运动将药物靶向运输到3T3成纤维细胞。该聚合物材料的降解产物具有很低的细胞毒性,可在生理环境中降解并排出体外。该方法为水凝胶微器件的便捷制备、高效驱动及其在药物递送领域的应用提供了新的解决方案。然而,在进入人体时,微型机器人需要面对来自人体免疫系统抵御外来威胁的防御机制。Cabanach等[54]首次利用TPP技术制备了用于3D打印水凝胶微机器人的两性离子光刻胶,并制备出了能避免被免疫细胞识别的非免疫原性两性离子微机器人,这种两性离子材料还可以进行充分的功能化,如可调力学性能、磁性纳米粒子的嵌入、生物分子的封装以及表面功能化。此外,经巨噬细胞检测超90 h后,该两性离子机器人仍未被发现,如
![TPP技术在药物递送领域的应用。(a)传统PEG微机器人与S30微机器人遇到巨噬细胞时的对比[54];(b)磁性SMMFs通过形状变形靶向释放DOX治疗癌细胞示意图以及药物释放区域和对照区域HeLa细胞活力的图像[55]](/richHtml/zgjg/2023/50/21/2107401/img_10.jpg)
图 10. TPP技术在药物递送领域的应用。(a)传统PEG微机器人与S30微机器人遇到巨噬细胞时的对比[54];(b)磁性SMMFs通过形状变形靶向释放DOX治疗癌细胞示意图以及药物释放区域和对照区域HeLa细胞活力的图像[55]
Fig. 10. Application of TPP technology in drug delivery. (a) Comparison between traditional PEG and S30 microrobots when they encountered macrophages[54]; (b) schematic illustration of magnetic SMMFs for targeted DOX release to treat cancer cells by shape morphing, and snapshots of the viability of HeLa cells in the DOX-releasing area and the control area[55]
在细胞工程领域,细胞所处的3D微环境力学特性可以调控重要的细胞过程。3D微支架可以在组织形成的初始阶段起到支撑细胞的作用,同时微支架的孔隙率和内部孔隙组织会影响细胞迁移,从而对支架的生物降解动力学、机械稳定性以及营养物质扩散起到主要作用。构建具有预设几何形状和孔隙率的3D水凝胶微环境在组织工程和再生医学中具有重要意义。若要实现可以调控细胞行为、控制细胞迁徙和细胞相互作用的3D支架,就需要能按照预设结构构建三维微结构的技术,因此,具备高精度和真3D加工能力的TPP技术无疑是一个较好的选择。Hippler等[56]利用基于β-环糊精丙烯酰胺和金刚烷丙烯酰胺的主客体水凝胶,通过飞秒激光TPP技术制备了刺激响应型复合微支架。该微支架由抗蛋白质吸附基底、蛋白质黏附梁和中央刺激响应主客体水凝胶组成,它可在生理条件下通过应用可溶性竞争客体进行可逆驱动,在定制的微环境下可同时拉伸单个细胞并研究其动态行为。基于PEGDA的三维微结构具有细胞相容性以及类似于ECM的特性,用于培养细胞时能够保持细胞活性,在组织工程中便于研究三维环境下细胞与基质间的相互作用机理。Ovsianikov等[57]利用TPP技术在分子质量为742 Da的PEGDA上制备了三维微结构,并结合激光诱导前向转移(LIFT)方法将细胞接种到所制备的高度多孔三维细胞支架上[如
![PEGDA 3D水凝胶支架。(a)通过LIFT方法将支架与细胞共培养的暗场成像、LIFT后不同类型细胞的荧光图像以及边界区域的详细图像[57];(b)PEGDA水凝胶支架上细胞的生长及黏附行为[58];(c)完整的六角形网络支架的斜向SEM图像、共聚焦荧光图像和明场图像,以及HeLa细胞和网格支架共培养的共聚焦荧光图像和明场图像[25]](/richHtml/zgjg/2023/50/21/2107401/img_11.jpg)
图 11. PEGDA 3D水凝胶支架。(a)通过LIFT方法将支架与细胞共培养的暗场成像、LIFT后不同类型细胞的荧光图像以及边界区域的详细图像[57];(b)PEGDA水凝胶支架上细胞的生长及黏附行为[58];(c)完整的六角形网络支架的斜向SEM图像、共聚焦荧光图像和明场图像,以及HeLa细胞和网格支架共培养的共聚焦荧光图像和明场图像[25]
Fig. 11. PEGDA 3D hydrogel scaffold. (a) Dark-field image of co-culture of scaffold and cell by LIFT, fluorescence image of different types of cells and detailed image of boundary area after LIFT[57];(b) cell growth and adhesion behavior on PEGDA hydrogel scaffold[58]; (c) oblique SEM image, confocal fluorescence image and bright field image of a complete hexagonal grid scaffold, and confocal fluorescence image and bright field image of HeLa cells co-culturing with the grid scaffold[25]
为了研究三维微支架对细胞行为的调控作用,Zhang等[14]利用飞秒激光TPP加工技术,基于PEGDA、PE-3A等生物相容性材料,制备了一系列不同孔径尺寸的3D水凝胶微支架,通过改变支柱与支柱的间距在69.7%到89.3%之间调节支架孔隙率,研究了不同孔径的3D水凝胶微支架对细胞行为的调控作用,如
![支柱间距分别为10、15、20、25、30 μm的支架和生长在3D微支架上的细胞的共聚焦荧光显微图像以及丝状伪足通过感知信息调节纤维状肌动蛋白合成机制的示意图[14]](/richHtml/zgjg/2023/50/21/2107401/img_12.jpg)
图 12. 支柱间距分别为10、15、20、25、30 μm的支架和生长在3D微支架上的细胞的共聚焦荧光显微图像以及丝状伪足通过感知信息调节纤维状肌动蛋白合成机制的示意图[14]
Fig. 12. Confocal fluorescent microscopy images of scaffold and cells grown on 3D microscaffolds with strut spacing of 10, 15, 20, 25, 30 μm, and schematic of the mechanism for regulating F-actin synthesis through sensing information by filopodia[14]
细胞工程领域需要亲水性单体等能提高支架生物活性的材料,因此,天然ECM中的成分被广泛研究并用作加工单体。天然水凝胶材料透明质酸(HA)是ECM的主要成分,广泛分布于人体组织中,是TPP加工制备水凝胶微结构时常用的生物材料,但其力学性能不佳,因此通常会将HA与PEGDA等结合进行化学修饰后再制备水凝胶微结构。Kufelt等[59]为了改善HA的力学性能,先用甲基丙烯酸缩水甘油酯化HA,然后将其与PEGDA原位结合并进行共价交联,接着采用TPP加工技术制备了几何形状和孔径均不相同的精细三维HA和HA-PEGDA微支架,同时用人表皮生长因子功能化HA,以增强其生物相容性。壳聚糖(CH)也是一种具有生物相容性、生物可降解性的生物材料,但该材料的微观结构限制了其作为引导组织形成的功能性支撑材料的应用,因此可以利用TPP技术将化学修饰的CH应用于可重复3D细胞支架的生物制造。Kufelt等[60]将CH与PEGDA进行复合和交联以调节材料的力学性能和生物化学性能,并将CH与光敏修饰的血管内皮生长因子(VEGF)共价交联。研究表明:改性CH具有生物相容性,VEGF可以增强其生物活性,3D CH支架可以成功接种细胞,在组织工程中的应用前景广阔。Yu等[61]制备了透明质酸钠(SH)和羧甲基壳聚糖的3D水凝胶细胞支架,获得了2.94 mW的最小加工阈值功率和80 nm的特征线宽。研究结果显示:可以通过调节水凝胶中交联剂的含量优化3D水凝胶支架的力学性能。细胞在SH和壳聚糖支架上生长的共聚焦荧光图像显示细胞支架在488 nm激光激发下表现出了更强的荧光,该工作为组织工程提供了一种简单的制备三维生物相容性水凝胶细胞支架的方法。
此外,TPP还能直接对包埋微生物的光刻胶前驱体进行加工。牛血清白蛋白(BSA)是从牛血清中分离出的球蛋白,由具有许多可氧化残基的氨基酸组成,其光交联反应是通过吸收色氨酸等基团或通过光敏材料氧化氨基酸残基产生过氧自由基进行的。通过TPP技术制备的BSA微结构同样具有良好的生物相容性。Hasselmann等[62]在BSA与核黄素5′-单磷酸钠水合物的水凝胶前驱体中实现了TPP在活细菌存在下的原位交联,并通过细胞膜渗漏和运动性实验测定了交联前后暴露在前驱体溶液中的细菌的活性。研究表明,这种亚微米尺度下高度局域化结构的制造以及该结构所具有的生物相容性使得该方法可用于固定单个预选细菌,这也说明通过附着的微结构控制运动动力学是有可能的。
除了3D微支架以外,高分辨率的图案化基底同样会影响细胞的生长。Pennacchio等[63]先对明胶进行改性,然后采用TPP技术对经过化学修饰的明胶进行图案化,以在微米尺度上制备具有指向性的水凝胶模块,从而有助于生成有序的体外组织。明胶微结构的表面上被引入了一种特殊的线性形貌,该形貌的存在强烈地增强了细胞排列,从而在结构内外产生定向的人真皮组织前驱体(HD-μTP),进一步增加了建立完全排列的HD-μTP的可能性。生物学研究结果验证了HD-μTP取向与这种拓扑结构之间的强关联性。
5 结束语
本文综述了双光子引发剂的研究进展以及双光子聚合水凝胶微结构在细胞培养、细胞行为调控、响应型微器件等方面的应用。TPP技术不仅在微纳光学、微机电系统等方面有所应用,而且在组织工程、药物递送等生物医学领域也具有一定应用潜力,其主要优势在于制备出的微纳结构形貌可控并且加工分辨率高。通过TPP制备的水凝胶微结构可以模仿天然的ECM,在体外提供3D微环境,从而控制附着在微结构上的细胞迁移、增殖、分化等行为,对于系统研究细胞-基质间的相互作用机理具有重要意义。然而,TPP技术在制备水凝胶微结构时通常耗时较长,因此需要高引发效率的双光子引发剂。为适用于水相环境的光交联,双光子引发剂需具有水溶性,可采用主客体化学作用、亲水疏水相互作用、化学修饰等策略来提高双光子引发剂的水溶性。同时,为了使水凝胶微结构适合细胞培养,要求双光子引发剂的细胞毒性尽可能低,因此,具有高引发效率和生物相容性的水溶性双光子引发剂成为了研究热点。TPP加工技术制备的水凝胶微结构在仿生领域、生物医药领域具有一定的应用潜力。从仿生学角度制备的一系列具有刺激响应功能的水凝胶微器件被广泛研究,以实现其在仿生微器件、精密传感器等领域的应用。在生物医药领域,糖类、蛋白质类、明胶衍生物等具有生物相容性的材料也已被广泛应用于制备3D水凝胶微结构,但这些材料制备的微结构往往存在力学性能不足等缺陷,可通过化学修饰、掺杂有机聚合物等方法改善其加工性能。
目前,TPP技术制备水凝胶微结构还存在一些挑战:1)采用TPP技术制备水凝胶微结构通常耗时较长,且难以批量化加工;2)具有良好的非线性吸收特性、生物相容性的水凝胶光刻胶前驱体材料亟待研发,且其双光子聚合作用机制尚不明确。因此,未来需要进一步开发提高TPP加工效率的技术策略,如并行处理技术、高速扫描技术、混合加工技术、面投影曝光等,以快速制备兼具大尺寸[64]和高精细度的3D水凝胶微结构;同时,还应关注新型水凝胶光刻胶前驱体材料的研发及其双光子聚合过程中的物理化学机制研究。
[1] Mather M L, Tomlins P E. Hydrogels in regenerative medicine: towards understanding structure-function relationships[J]. Regenerative Medicine, 2010, 5(5): 809-821.
[2] Lai W F, He Z D. Design and fabrication of hydrogel-based nanoparticulate systems for in vivo drug delivery[J]. Journal of Controlled Release, 2016, 243: 269-282.
[3] Sumaru K, Takagi T, Morishita K, et al. Fabrication of pocket-like hydrogel microstructures through photolithography[J]. Soft Matter, 2018, 14(28): 5710-5714.
[4] Chalard A, Joseph P, Souleille S, et al. Wet spinning and radial self-assembly of a carbohydrate low molecular weight gelator into well organized hydrogel filaments[J]. Nanoscale, 2019, 11(32): 15043-15056.
[5] Chen N, Zhang X B, Lyu J Y, et al. Preparation of a novel regenerated silk fibroin-based hydrogel for extrusion bioprinting[J]. Soft Matter, 2022, 18(38): 7360-7368.
[6] Wang Z J, Kumar H, Tian Z L, et al. Visible light photoinitiation of cell-adhesive gelatin methacryloyl hydrogels for stereolithography 3D bioprinting[J]. ACS Applied Materials & Interfaces, 2018, 10(32): 26859-26869.
[7] Singh I, Lacko C S, Zhao Z Y, et al. Preparation and evaluation of microfluidic magnetic alginate microparticles for magnetically templated hydrogels[J]. Journal of Colloid and Interface Science, 2020, 561: 647-658.
[8] Nakashima Y, Yamamoto Y, Hikichi Y, et al. Creation of cell micropatterns using a newly developed gel micromachining technique[J]. Biofabrication, 2016, 8(3): 035006.
[9] Yang Y, Liu X L, Wei D, et al. Automated fabrication of hydrogel microfibers with tunable diameters for controlled cell alignment[J]. Biofabrication, 2017, 9(4): 045009.
[10] Ersumo N, Witherel C E, Spiller K L. Differences in time-dependent mechanical properties between extruded and molded hydrogels[J]. Biofabrication, 2016, 8(3): 035012.
[11] Lacko C S, Singh I, Wall M A, et al. Magnetic particle templating of hydrogels: engineering naturally derived hydrogel scaffolds with 3D aligned microarchitecture for nerve repair[J]. Journal of Neural Engineering, 2020, 17(1): 016057.
[12] Torgersen J, Qin X H, Li Z Q, et al. Hydrogels for two-photon polymerization: a toolbox for mimicking the extracellular matrix[J]. Advanced Functional Materials, 2013, 23(36): 4542-4554.
[13] Costa B N L, Adão R M R, Maibohm C, et al. Cellular interaction of bone marrow mesenchymal stem cells with polymer and hydrogel 3D microscaffold templates[J]. ACS Applied Materials & Interfaces, 2022, 14(11): 13013-13024.
[14] Zhang W C, Zheng M L, Liu J E, et al. Modulation of cell behavior by 3D biocompatible hydrogel microscaffolds with precise configuration[J]. Nanomaterials, 2021, 11(9): 2325.
[15] Huang X, Zhang Y X, Shi M Q, et al. A highly biocompatible bio-ink for 3D hydrogel scaffolds fabrication in the presence of living cells by two-photon polymerization[J]. European Polymer Journal, 2021, 153: 110505.
[16] 郑美玲, 金峰, 董贤子, 等. 双光子光聚合与功能微纳结构制备[J]. 影像科学与光化学, 2017, 35(4): 413-428.
Zheng M L, Jin F, Dong X Z, et al. Two-photon photopolymerization and functional micro/nanostructure fabrication[J]. Imaging Science and Photochemistry, 2017, 35(4): 413-428.
[17] 张维彩, 郑美玲. 高效双光子引发剂及水相中制备水凝胶微结构的研究进展[J]. 中国激光, 2021, 48(2): 0202007.
[18] Cumpston B H, Ananthavel S P, Barlow S, et al. Two-photon polymerization initiators for three-dimensional optical data storage and microfabrication[J]. Nature, 1999, 398(6722): 51-54.
[19] Albota M, Beljonne D, Brédas J L, et al. Design of organic molecules with large two-photon absorption cross sections[J]. Science, 1998, 281(5383): 1653-1656.
[20] Xing J F, Chen W Q, Gu J, et al. Design of high efficiency for two-photon polymerization initiator: combination of radical stabilization and large two-photon cross-section achieved by N-benzyl 3, 6-bis(phenylethynyl)carbazole derivatives[J]. Journal of Materials Chemistry, 2007, 17(14): 1433-1438.
[21] Xing J F, Chen W Q, Dong X Z, et al. Synthesis, optical and initiating properties of new two-photon polymerization initiators: 2, 7-Bis(styryl)anthraquinone derivatives[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2007, 189(2/3): 398-404.
[22] Xing J F, Zheng M L, Chen W Q, et al. C2v symmetrical two-photon polymerization initiators with anthracene core: synthesis, optical and initiating properties[J]. Physical Chemistry Chemical Physics, 2012, 14(45): 15785-15792.
[23] Xing J F, Zheng M L, Duan X M. Two-photon polymerization microfabrication of hydrogels: an advanced 3D printing technology for tissue engineering and drug delivery[J]. Chemical Society Reviews, 2015, 44(15): 5031-5039.
[24] Xing J F, Liu J H, Zhang T B, et al. A water soluble initiator prepared through host-guest chemical interaction for microfabrication of 3D hydrogels via two-photon polymerization[J]. Journal of Materials Chemistry B, 2014, 2(27): 4318-4323.
[25] Zheng Y C, Zhao Y Y, Zheng M L, et al. Cucurbit[7]uril-carbazole two-photon photoinitiators for the fabrication of biocompatible three-dimensional hydrogel scaffolds by laser direct writing in aqueous solutions[J]. ACS Applied Materials & Interfaces, 2019, 11(2): 1782-1789.
[26] Gao W, Chao H, Zheng Y C, et al. Ionic carbazole-based water-soluble two-photon photoinitiator and the fabrication of biocompatible 3D hydrogel scaffold[J]. ACS Applied Materials & Interfaces, 2021, 13(24): 27796-27805.
[27] Bin F C, Guo M, Li T, et al. Carbazole-based anion ionic water-soluble two-photon initiator for achieving 3D hydrogel structures[J]. Advanced Functional Materials, 2023: 2300293.
[28] Xing J F, Liu L, Song X Y, et al. 3D hydrogels with high resolution fabricated by two-photon polymerization with sensitive water soluble initiators[J]. Journal of Materials Chemistry B, 2015, 3(43): 8486-8491.
[29] Jhaveri S J, McMullen J D, Sijbesma R, et al. Direct three-dimensional microfabrication of hydrogels via two-photon lithography in aqueous solution[J]. Chemistry of Materials, 2009, 21(10): 2003-2006.
[30] Li Z Q, Torgersen J, Ajami A, et al. Initiation efficiency and cytotoxicity of novel water-soluble two-photon photoinitiators for direct 3D microfabrication of hydrogels[J]. RSC Advances, 2013, 3(36): 15939-15946.
[31] Huang X, Wang X P, Zhao Y X. Study on a series of water-soluble photoinitiators for fabrication of 3D hydrogels by two-photon polymerization[J]. Dyes and Pigments, 2017, 141: 413-419.
[32] Wang H A, Zhang Y L, Zhu R, et al. Femtosecond laser direct writing of ion exchangeable multifunctional microstructures[J]. Optics Letters, 2018, 43(5): 1139-1142.
[33] Scarpa E, Lemma E D, Fiammengo R, et al. Microfabrication of pH-responsive 3D hydrogel structures via two-photon polymerization of high-molecular-weight poly(ethylene glycol) diacrylates[J]. Sensors and Actuators B: Chemical, 2019, 279: 418-426.
[34] Xiong Z, Zheng C L, Jin F, et al. Magnetic-field-driven ultra-small 3D hydrogel microstructures: preparation of gel photoresist and two-photon polymerization microfabrication[J]. Sensors and Actuators B: Chemical, 2018, 274: 541-550.
[35] Gou X R, Zheng M L, Zhao Y Y, et al. Mechanical property of PEG hydrogel and the 3D red blood cell microstructures fabricated by two-photon polymerization[J]. Applied Surface Science, 2017, 416: 273-280.
[36] Liu K L, Ding H B, Li S, et al. 3D printing colloidal crystal microstructures via sacrificial-scaffold-mediated two-photon lithography[J]. Nature Communications, 2022, 13: 4563.
[37] Yuan Y P, Chen L, Shi Z Y, et al. Micro/nanoarchitectonics of 3D printed scaffolds with excellent biocompatibility prepared using femtosecond laser two-photon polymerization for tissue engineering applications[J]. Nanomaterials, 2022, 12(3): 391.
[38] Qin X H, Torgersen J, Saf R, et al. Three-dimensional microfabrication of protein hydrogels via two-photon-excited thiol-vinyl ester photopolymerization[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2013, 51(22): 4799-4810.
[39] Sun Y L, Li Q, Sun S M, et al. Aqueous multiphoton lithography with multifunctional silk-centred bio-resists[J]. Nature Communications, 2015, 6: 8612.
[40] Nekrasov N, Yakunina N, Nevolin V, et al. Two-photon polymerization of albumin hydrogel nanowires strengthened with graphene oxide[J]. Biomimetics, 2021, 6(4): 66.
[41] Pennacchio F A, Fedele C, De Martino S, et al. Three-dimensional microstructured azobenzene-containing gelatin as a photoactuable cell confining system[J]. ACS Applied Materials & Interfaces, 2018, 10(1): 91-97.
[42] 邓春三, 范旭浩, 陶宇峰, 等. 基于湿度刺激响应水凝胶的飞秒激光四维打印研究[J]. 中国激光, 2021, 48(2): 0202016.
[43] Xiong Z, Zheng M L, Dong X Z, et al. Asymmetric microstructure of hydrogel: two-photon microfabrication and stimuli-responsive behavior[J]. Soft Matter, 2011, 7(21): 10353-10359.
[44] Wang J Y, Jin F, Dong X Z, et al. Flytrap inspired pH-driven 3D hydrogel actuator by femtosecond laser microfabrication[J]. Advanced Materials Technologies, 2022, 7(8): 2200276.
[45] Deng C S, Liu Y C, Fan X H, et al. Femtosecond laser 4D printing of light-driven intelligent micromachines[J]. Advanced Functional Materials, 2023, 33(11): 2211473.
[46] Lee M R, Phang I Y, Cui Y, et al. Shape-shifting 3D protein microstructures with programmable directionality via quantitative nanoscale stiffness modulation[J]. Small, 2015, 11(6): 740-748.
[47] Wei S X, Liu J E, Zhao Y Y, et al. Protein-based 3D microstructures with controllable morphology and pH-responsive properties[J]. ACS Applied Materials & Interfaces, 2017, 9(48): 42247-42257.
[48] Ma Z C, Zhang Y L, Han B, et al. Femtosecond laser programmed artificial musculoskeletal systems[J]. Nature Communications, 2020, 11: 4536.
[49] 胡昕宇, 马卓晨, 韩冰, 等. 飞秒激光制备蛋白质智能软体执行器[J]. 中国激光, 2021, 48(14): 1402001.
[50] 孙锐, 王重宇, 胡衍雷, 等. 飞秒激光加工水凝胶双面神微柱及其应用[J]. 中国激光, 2019, 46(9): 0902001.
[51] Del Pozo M, Delaney C, Bastiaansen C W M, et al. Direct laser writing of four-dimensional structural color microactuators using a photonic photoresist[J]. ACS Nano, 2020, 14(8): 9832-9839.
[52] Liu B R, Dong B, Xin C, et al. 4D direct laser writing of submerged structural colors at the microscale[J]. Small, 2023, 19(2): 2204630.
[53] Peters C, Hoop M, Pané S, et al. Degradable magnetic composites for minimally invasive interventions: device fabrication, targeted drug delivery, and cytotoxicity tests[J]. Advanced Materials, 2016, 28(3): 533-538.
[54] Cabanach P, Pena-Francesch A, Sheehan D, et al. Zwitterionic 3D-printed non-immunogenic stealth microrobots[J]. Advanced Materials, 2020, 32(42): 2003013.
[55] Xin C, Jin D D, Hu Y L, et al. Environmentally adaptive shape-morphing microrobots for localized cancer cell treatment[J]. ACS Nano, 2021, 15(11): 18048-18059.
[56] Hippler M, Weißenbruch K, Richler K, et al. Mechanical stimulation of single cells by reversible host-guest interactions in 3D microscaffolds[J]. Science Advances, 2020, 6(39): eabc2648.
[57] Ovsianikov A, Gruene M, Pflaum M, et al. Laser printing of cells into 3D scaffolds[J]. Biofabrication, 2010, 2(1): 014104.
[58] Accardo A, Blatché M C, Courson R, et al. Two-photon lithography and microscopy of 3D hydrogel scaffolds for neuronal cell growth[J]. Biomedical Physics & Engineering Express, 2018, 4(2): 027009.
[59] Kufelt O, El-Tamer A, Sehring C, et al. Hyaluronic acid based materials for scaffolding via two-photon polymerization[J]. Biomacromolecules, 2014, 15(2): 650-659.
[60] Kufelt O, El-Tamer A, Sehring C, et al. Water-soluble photopolymerizable chitosan hydrogels for biofabrication via two-photon polymerization[J]. Acta Biomaterialia, 2015, 18: 186-195.
[61] Yu H, Liu J E, Zhao Y Y, et al. Biocompatible three-dimensional hydrogel cell scaffold fabricated by sodium hyaluronate and chitosan assisted two-photon polymerization[J]. ACS Applied Bio Materials, 2019, 2(7): 3077-3083.
[62] Hasselmann N F, Horn W. Attachment of microstructures to single bacteria by two-photon patterning of a protein based hydrogel[J]. Biomedical Physics & Engineering Express, 2018, 4(3): 035004.
[63] Pennacchio F A, Casale C, Urciuolo F, et al. Controlling the orientation of a cell-synthesized extracellular matrix by using engineered gelatin-based building blocks[J]. Biomaterials Science, 2018, 6(8): 2084-2091.
[64] 高文, 郑美玲, 金峰, 等. 飞秒激光快速制备大面积二维微纳结构[J]. 激光与光电子学进展, 2020, 57(11): 111421.
Article Outline
武昕宜, 段琦, 宾凡淳, 郑美玲. 飞秒激光双光子聚合制备3D水凝胶微结构及其应用[J]. 中国激光, 2023, 50(21): 2107401. Xinyi Wu, Qi Duan, Fanchun Bin, Meiling Zheng. Femtosecond Laser Two‑Photon Polymerization of 3D Hydrogel Microstructures and Their Applications[J]. Chinese Journal of Lasers, 2023, 50(21): 2107401.

![飞秒激光双光子微纳加工示意图[17]](/richHtml/zgjg/2023/50/21/2107401/img_02.jpg)





