60Co-γ 射线处理油菜秸秆降解产物分析及其对酶解发酵的影响
油菜是继小麦、玉米、水稻和大豆之外的我国又一大农作物,耕作面积和收获产量约占世界1/3[1]。油菜秸秆作为典型的木质纤维素类生物质,其纤维素、半纤维和木质素含量分别为41.37%、23.63%和13.03%,较高的纤维素含量使其成为具有潜力的燃料乙醇生产原料[2]。但油菜秸秆木质纤维素组分之间紧密结合,需要通过预处理改变其微观结构、增加孔隙度、降低纤维素结晶度,提高其被酶和微生物的利用效率[3]。目前,针对木质纤维素生物转化的预处理方法包括:物理法,如机械挤压、微波和爆破等,处理能耗高[4-5];化学法,如酸、碱预处理等,严重污染环境[6-7];生物预处理法,生产周期长[8];离子液体预处理法,溶剂制备过程复杂、成本高[9]。
辐照预处理技术是采用γ射线或电子束处理生物质,将其顽固的木质纤维素显著分解为无定形结构,并促进纤维素酶解转化为小分子碳水化合物[10]。陈亮等[11]研究发现,800 kGy处理的稻草采用分批补料法进行酶解,40%的底物浓度纤维素酶解转化率可达到77.1%,葡萄糖的质量浓度可达104.6 g/L。Liu等[12]采用800 kGy处理的玉米芯、松木、桉木进行酶解,底物浓度也能达到30%~40%,纤维素酶水解产物中总糖浓度分别达到251 g/L、185.58 g/L和212.87 g/L。Zhang等[13]研究发现,辐照能够降低油菜秸秆粒径,缩小粒度分布范围,增加比表面积,且处理后的油菜秸秆热稳定性降低,更加容易酶解。这些研究表明,高能氧化辐照预处理能够显著提高材料的酶水解性能,为生物质的高效转化奠定了基础。
辐照预处理尽管可以破坏木质纤维素的顽固结构,增强酶对纤维素的可及性,但在此过程中会产生木质纤维素衍生的抑制物,影响酶解发酵,且不同种类原料经辐照处理产生的抑制物种类和含量均存在差异[14]。Li等[15]在辐照处理芒草中检测到一些潜在的抑制物,如葡萄糖醛酸、半乳糖醛酸、甲酸、乙酸、糠醛和对香豆酸,且吸收剂量对这些产物的生成有明显的影响。张春艳等[16]采用GC-MS对处理后的油菜秸秆中降解产物分析发现,脂肪酸类降解产物相对含量在1 000 kGy时达到最大值,芳香类降解产物在800 kGy时含量最高。Liu等[17]在800 kGy辐照处理的芦苇中检测到酚类抑制物的总含量为4.25 mg/mL。这些抑制物的产生会影响酵母发酵生产乙醇,但目前我们对辐照预处理油菜秸秆发酵抑制产物的生成规律,及其对后续生物转化生产燃料乙醇产生什么样的影响并不清楚。因此,本文以0~1 000 kGy辐照处理的油菜秸秆为原料,研究不同吸收剂量处理后油菜秸秆组分变化、抑制物的种类和含量,并对其酶解发酵特性进行评价,为辐照预处理油菜秸秆发酵抑制物的脱除提供参考。
1 材料与方法
1.1 材料与试剂
油菜秸秆,收集于湖南省农业科学院作物研究所试验基地,自然晾干,切成10~15 cm小段,备用。
98%浓硫酸、磷酸、乙酸、乙酸钠、硫酸铵、磷酸二氢钾、硫酸镁、氯化钙、无水乙醇均为分析纯,购于国药集团化学试剂有限公司;酵母提取粉为生化试剂,购于广东环凯微生物科技有限公司;甲醇、乙腈为色谱纯,购于安徽天地高纯溶剂有限公司。
高效液相色谱(High performance liquid chromatography,HPLC)标准样品:葡萄糖(Glucose)和木糖(Xylose),购于Sigma-Aldrich公司;甲酸(Formic acid)、乙酸(Acetic acid)、丙酸(Propionic acid)和正丁酸(n-Butyric acid),购于上海阿拉丁生化科技股份有限公司;对羟基苯甲酸(p-Hydroxybenzonic acid)、香草酸(Vanillic acid)、丁香酸(Syringic acid)、对羟基苯甲醛(p-Hydroxy benzaldehyde)、香草醛(Vanilline)、对香豆酸(p-Coumaric acid)、丁香醛(Syringaldehyde)、香草乙酮(Acetovanillone)和阿魏酸(Ferulic acid),购于上海麦克林生化科技股份有限公司。
Cellulast 1.5 L纤维素酶购于丹麦诺维信公司。
CICC31014酿酒酵母(Saccharomyces cerevisiae)购于中国工业微生物菌种保藏管理中心。
1.2 仪器与设备
60Co-γ辐照装置,湖南省核农学与航天育种研究所;FW177粉碎机,天津泰斯特仪器有限公司;SHZ-Ⅲ循环水式真空泵,上海贤德实验仪器有限公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;DGH-9246 A电热恒温鼓风干燥箱,上海精密实验设备有限公司;Thermo Ultimate 3000高效液相色谱仪,赛默飞世尔科技(中国)有限公司;YXQ-LS-50S11压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;Bluestar A紫外可见分光光度计,北京莱伯泰科仪器股份有限公司;HZQ-F100恒温摇床,常州诺基仪器有限公司;TG16-Ⅱ台式高速离心机,长沙平凡仪器仪表有限公司。
1.3 60Co-γ射线辐照处理
油菜秸秆,自然晾干,装入金属辐照箱,室温下采用60Co-γ射线进行动态辐照处理,辐照吸收剂量为:0 kGy、200 kGy、400 kGy、600 kGy、800 kGy、1 000 kGy,剂量率为2 kGy/h。辐照处理后的样品粉碎,过0.425 mm筛网,装入自封袋中备用。
1.4 油菜秸秆组分分析
1.4.1 水浸提物制备
称取2.0 g样品,加入60 mL去离子水,于50 ℃条件下超声处理1 h。结束后反应液进行抽滤,收集滤液,进行pH、葡萄糖、木糖、可溶性葡聚糖、可溶性木聚糖、脂肪酸类和芳香类降解产物分析。滤渣,105 ℃烘干,进行木质纤维素组分分析。
1.4.2 pH测定
取一定体积的油菜秸秆水浸提液,采用pH计测定其pH值。
1.4.3 葡萄糖、木糖、水溶性葡聚糖、木聚糖测定
取1 mL油菜秸秆水浸提液,过0.45 μm水系滤膜,采用HPLC分析水浸提液中葡萄糖、木糖含量。取上清液7 mL,加入72%的硫酸0.25 mL,121 ℃反应1 h,结束后稀释,过0.45 μm水系滤膜,采用HPLC分析水浸提液中水溶性葡聚糖和木聚糖含量。
HPLC分析条件参考武小芬等[18]的方法。Bio Rad Aminex HPX-87H(7.8 mm×300 mm)色谱柱、柱温55 ℃,0.005 mol/L硫酸为流动相,流速0.6 mL/min,进样量10 μL,示差折光检测器,温度45 ℃。
1.4.4 脂肪酸类和芳香类降解产物分析
取1 mL油菜秸秆水浸提液,过0.45 μm水系滤膜,采用HPLC分析甲酸、乙酸、丙酸和正丁酸等脂肪酸类降解产物;对羟基苯甲酸、香草酸、丁香酸、对羟基苯甲醛、香草醛、对香豆酸、丁香醛、香草乙酮和阿魏酸等芳香类降解产物。
HPLC分析条件参考Chen等[19]的方法稍加修改。色谱柱为Waters YMC类胡萝卜素柱S-3(250 mm×4.6 mm),流动相A为0.05%(v/v)磷酸(pH=2.2),流动相B为90%乙腈水溶液,流速0.8 mL/min,紫外可见检测器、波长210 nm,柱温30 ℃,进样体积10 μL。梯度洗脱程序为:0.00~25.00 min,流动相B从5%梯度增加至20%;25.01~30.00 min,流动相B从20%梯度增加至80%;30.01~35.00 min,流动相B从80%梯度降低至5%;35.01~40.00 min,流动相B保持5%不变。
1.4.5 木质纤维素组分分析
称取0.3 g水浸提后滤渣于100 mL三角瓶中,加入3 mL 72%硫酸,涡旋振荡至样品与硫酸充分混合,放入30 ℃水浴摇床反应1 h,然后加入84 mL去离子水,121 ℃反应1 h。反应结束后冷却,过滤,滤渣105 ℃烘干计算酸不溶性木质素含量;测定滤液在320 nm波长下吸光值,计算酸溶性木质素含量;纤维素和木聚糖含量通过HPLC测定滤液中的葡萄糖和木糖含量进行计算[20]。
1.5 酶解试验
酶解试验根据Wu等[21]报道的方法进行。不同吸收剂量(0 kGy、200 kGy、400 kGy、600 kGy、800 kGy、1 000 kGy)处理后的油菜秸秆,按照10%底物浓度加入0.1 mol/L乙酸-乙酸钠缓冲液(pH=4.8),纤维素酶添加量为15 FPU/g,酶解条件为:温度50 ℃、转速130 r/min、时间96 h,分别在0 h、4 h、24 h、48 h、72 h和96 h取样,测定葡萄糖含量,根据
1.6 分步糖化发酵
水浸提脱毒:800 kGy处理的油菜秸秆粉,按固液比1∶30加入去离子水,于50 ℃条件下超声处理1 h,结束后抽滤,收集滤渣,60 ℃烘干,为水浸提脱毒后样品。
发酵培养基:含2 g/L硫酸铵、5 g/L磷酸二氢钾、1 g/L硫酸镁、0.2 g/L氯化钙、5 g/L酵母提取粉,pH≈6。
酶解试验:分别以800 kGy辐照处理和水浸提脱毒后油菜秸秆粉为原料,按照5%、10%和15%底物浓度加入发酵培养基,纤维素酶添加量为15 FPU/g,酶解条件为:温度50 ℃、转速130 r/min、时间72 h,分别在0 h、4 h、24 h、48 h和72 h取样,测定葡萄糖含量,根据
乙醇发酵:将上述酶解液115 ℃灭菌20 min,按10%接种量接入活化后酵母菌,置于恒温摇床中,37 ℃、150 r/min条件下进行分步糖化发酵,分别在发酵0 h、4 h、8 h、24 h和48 h取样,按§1.4.3中HPLC分析方法测定其中葡萄糖和乙醇含量,根据
1.7 数据处理
所有试验均重复2次,采用Excel 2016进行数据统计,Origin 2019进行绘图。
2 结果与分析
2.1 不同吸收剂量辐照处理后油菜秸秆组分分析
不同吸收剂量辐照处理后油菜秸秆中各组分含量变化如
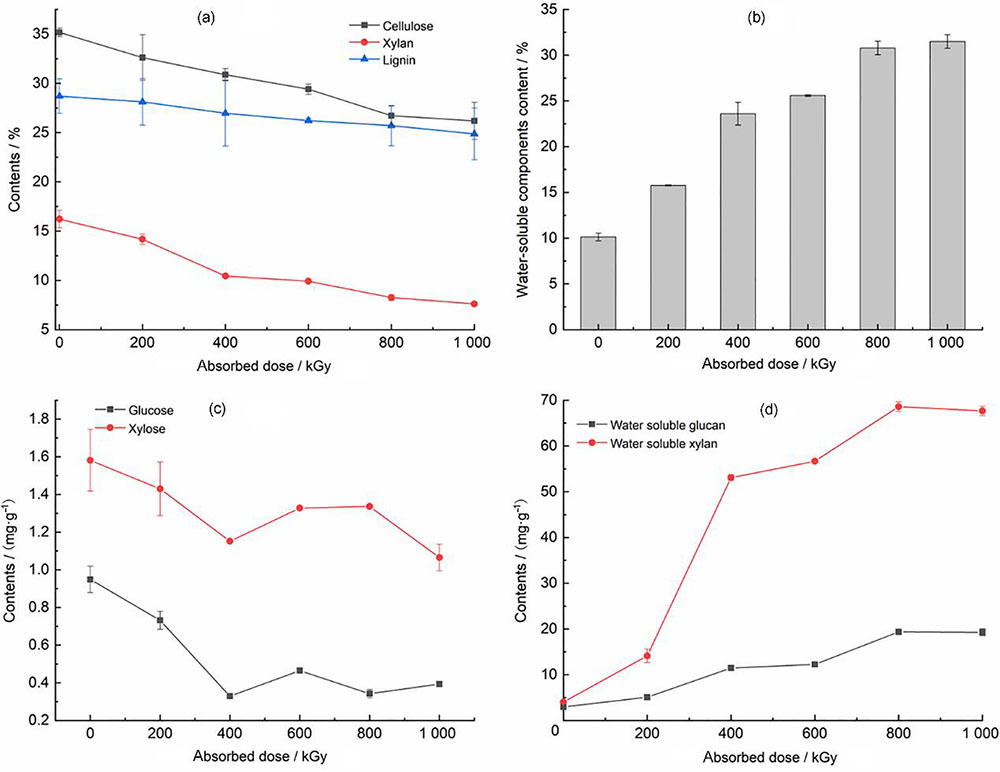
图 1. 辐照处理后油菜秸秆组分分析:(a)纤维素、木聚糖和木质素含量;(b)水溶性组分总量;(c)水溶性组分中葡萄糖和木糖含量;(d)水溶性组分中葡聚糖和木聚糖含量
Fig. 1. Composition analysis of rapeseed straw after irradiation treatment: (a) contents of cellulose, xylan, and lignin; (b) total amount of water soluble components; (c) contents of glucose and xylose in water soluble fraction; (d) contents of glucan and xylan in water soluble fraction
2.2 不同吸收剂量辐照处理后油菜秸秆降解抑制物分析
对不同吸收剂量辐照处理后油菜秸秆水浸提液pH和4种主要脂肪酸类、9种芳香类抑制物进行定量分析,结果如

图 2. 辐照处理后油菜秸秆酶解发酵抑制物分析:(a)水浸提液pH分析;(b)脂肪酸类和芳香类抑制物总量;(c)水溶性组分中脂肪酸类抑制物含量;(d)水溶性组分中芳香类抑制物含量
Fig. 2. Analysis of enzymatic hydrolysis and fermentation inhibitors of rapeseed straw after irradiation treatment: (a) pH analysis of water extracts; (b) contents of aromatic inhibitors in water soluble fractions; (c) total contents of fatty acid and aromatic inhibitors; (d) contents of fatty acid inhibitors in water soluble fraction
9种芳香类降解产物总量随吸收剂量的增加呈先增后降趋势,800 kGy达到最大值0.22 mg/g,其中香草酸和丁香酸是油菜秸秆主要的小分子芳香类降解产物(
2.3 不同吸收剂量辐照处理油菜秸秆酶解糖化研究
0~1 000 kGy辐照处理油菜秸秆酶解纤维素转化率和葡萄糖浓度如

图 3. 不同吸收剂量辐照处理油菜秸秆酶解效果:(a)纤维素转化率;(b)葡萄糖浓度
Fig. 3. Enzymatic hydrolysis of rapeseed straw pretreated with irradiation at different absorbed doses: (a) conversion rate of cellulose; (b) concentration of glucose
由
2.4 辐照处理后油菜秸秆分步糖化发酵
对比不同底物浓度下800 kGy辐照处理油菜秸秆分步糖化发酵纤维素和乙醇转化率的变化,结果如

图 4. 800 kGy辐照处理油菜秸秆分步糖化发酵:(a)酶解纤维素转化率;(b)酶解液葡萄糖浓度;(c)发酵乙醇转化率;(d)发酵液葡萄糖浓度
Fig. 4. Separate hydrolysis and fermentation of 800 kGy irradiated rapeseed straw: (a) cellulose conversion rate of enzymatic hydrolysis; (b) glucose concentration of enzymatic hydrolysis; (c) ethanol conversion rate of fermentation; (d) glucose concentration of fermentation
以水浸提后800 kGy辐照处理油菜秸秆为原料进行分步糖化发酵,结果如

图 5. 水洗处理后800 kGy辐照处理油菜秸秆分步糖化发酵:(a)酶解纤维素转化率;(b)酶解液葡萄糖浓度;(c)发酵乙醇转化率;(d)发酵液葡萄糖浓度
Fig. 5. Separate hydrolysis and fermentation of 800 kGy irradiated rapeseed straw after water extraction treatment: (a) cellulose conversion rate of enzymatic hydrolysis; (b) glucose concentration of enzymatic hydrolysis; (c) ethanol conversion rate of fermentation; (d) glucose concentration of fermentation
通常,预处理后水解液中的发酵抑制物可以分为三类,其中脂肪酸类和呋喃类主要来自于半纤维素及部分纤维素的降解,酚类主要来自于木质素的降解[30]。对于高能氧化辐照预处理后抑制物的种类和含量,也有少量研究报道。Li等[15]在辐照处理芒草中检测到一些潜在的抑制物,如葡糖醛酸、半乳糖醛酸、甲酸、乙酸、糠醛和对香豆酸,且吸收剂量对这些产物的生成有明显的影响。张春艳等[16]对处理后的油菜秸秆进行分析发现,脂肪酸类降解产物相对含量在1 000 kGy时达到最大值19.99 %,芳香类降解产物在800 kGy时含量最高为8.97 %。
发酵液中抑制物的脱除方法主要包括:物理脱除法(吸附、萃取等)、化学脱除法(添加化学试剂中和、沉淀等)、生物脱除法(通过特定的微生物或酶系作用)等[14]。发酵液中抑制物水洗脱毒具有操作简单、无需添加化学试剂、成本低等优点,Liu等[17]在800 kGy辐照处理的芦苇中检测到酚类抑制物的总含量为4.25 mg/mL,通过辐照预处理水洗相结合,使葡萄糖乙醇转化率达到99.7%。张勇等[31]对800 kGy辐照处理的玉米秸秆采用水洗脱毒,乙醇转化率比对照提高10%。这些研究结果表明,水洗处理能够有效去除辐照处理产生的抑制物,提高发酵乙醇转化率。
3 结论
辐照处理能够降解油菜秸秆中纤维素、半纤维素和木质素,产生小分子脂肪酸和芳香类化合物,造成水溶性组分增加和水浸提液pH降低。辐照处理后油菜秸秆酶解纤维素转化率逐渐增加,酶解液中葡萄糖浓度随辐照吸收剂量的升高而增加,均在1 000 kGy时达到最大值。分步糖化发酵随着底物浓度的增加,乙醇转化率显著降低,底物浓度15%时,800 kGy油菜秸秆乙醇转化率低于10%。水浸提处理可以有效去除小分子有机酸和芳香类化合物,经水浸提的800 kGy油菜秸秆酶解转化率和发酵乙醇转化率明显提高,15%底物浓度油菜秸秆酶解72 h,纤维素转化率和葡萄糖浓度分别为71.62%和40.38 mg/mL,发酵48 h后乙醇转化率达到64.00%。本研究为打破油菜秸秆60Co-γ辐照预处理瓶颈,合理有效地脱除预处理产生的抑制物,提供理论和技术支撑。后续将继续研究油菜秸秆高底物浓度酶解发酵工艺,实现油菜秸秆高效转化制备燃料乙醇的目标。
[1] 裴岩杰. 油菜秸秆细胞壁及其降解转化生物乙醇机制研究[D]. 武汉: 华中农业大学, 2016: 75.
PEIYanjie. Analysis of cell wall composition, biomass digestibility and bioethanol conversion in rapeseed straw[D]. Wuhan: Huazhong Agricultural University, 2016: 75.
[2] 张春艳. 辐照预处理对油菜秸秆降解产糖效果的影响及机理研究[D]. 长沙: 湖南农业大学, 2015: 134.
ZHANGChunyan. Studies on the effect of sugar production and mechanism of hydrolysis of irradiation pretreated rapeseed straw[D]. Changsha: Hunan Agricultural University, 2015: 134.
[3] Chen H Y, Liu J B, Chang X, et al. A review on the pretreatment of lignocellulose for high-value chemicals[J]. Fuel Processing Technology, 2017, 160: 196-206.
[4] Bala A J, Singh B. Development of an environmental-benign process for efficient pretreatment and saccharification of Saccharum biomasses for bioethanol production[J]. Renewable Energy, 2019, 130: 12-24.
[5] Rastogi M, Shrivastava S. Recent advances in second generation bioethanol production: an insight to pretreatment, saccharification and fermentation processes[J]. Renewable and Sustainable Energy Reviews, 2017, 80: 330-340.
[6] Kuglarz M, Alvarado-Morales M, Dąbkowska K, et al. Integrated production of cellulosic bioethanol and succinic acid from rapeseed straw after dilute-acid pretreatment[J]. Bioresource Technology, 2018, 265: 191-199.
[7] Tsegaye B, Balomajumder C, Roy P. Optimization of microwave and NaOH pretreatments of wheat straw for enhancing biofuel yield[J]. Energy Conversion and Management, 2019, 186: 82-92.
[8] Prasad R K, Chatterjee S, Mazumder P B, et al. Bioethanol production from waste lignocelluloses: a review on microbial degradation potential[J]. Chemosphere, 2019, 231: 588-606.
[9] Trinh L T P, Lee Y J, Park C S, et al. Aqueous acidified ionic liquid pretreatment for bioethanol production and concentration of produced ethanol by pervaporation[J]. Journal of Industrial and Engineering Chemistry, 2019, 69: 57-65.
[10] Chen J P, Wang L Y, Su X J, et al. Structure, morphology, thermostability and irradiation-mediated degradation fractions of hemicellulose treated with γ-irradiation[J]. Waste and Biomass Valorization, 2016, 7(6): 1415-1425.
[11] 陈亮, 苏小军, 陈静萍, 等. 辐照预处理水稻秸秆在高底物浓度下的酶解[J]. 林产化学与工业, 2015, 35(2): 129-134.
CHEN Liang, SU Xiaojun, CHEN Jingping, et al. Enzymatic hydrolysis of rice straw pretreated by irradiation at high solid loading[J]. Chemistry and Industry of Forest Products, 2015, 35(2): 129-134.
[12] Liu Y, Guo L J, Wang L Y, et al. Irradiation pretreatment facilitates the achievement of high total sugars concentration from lignocellulose biomass[J]. Bioresource Technology, 2017, 232: 270-277.
[13] Zhang C Y, Su X J, Xiong X Y, et al. 60Co-γ radiation-induced changes in the physical and chemical properties of rapeseed straw[J]. Biomass and Bioenergy, 2016, 85: 207-214.
[14] 杨莉, 谭丽萍, 刘同军. 木质纤维素预处理抑制物产生及脱除方法的研究进展[J]. 生物工程学报, 2021, 37(1): 15-29.
YANG Li, TAN Liping, LIU Tongjun. Progress in detoxification of inhibitors generated during lignocellulose pretreatment[J]. Chinese Journal of Biotechnology, 2021, 37(1): 15-29.
[15] Li Q M, Li X J, Jiang Y L, et al. Analysis of degradation products and structural characterization of giant reed and Chinese silvergrass pretreated by 60Co-γ irradiation[J]. Industrial Crops and Products, 2016, 83: 307-315.
[16] 张春艳, 谭兴和, 熊兴耀, 等. 油菜秸秆60Co-γ辐照降解产物分析[J]. 湖南农业大学学报(自然科学版), 2017, 43(1): 92-97.
ZHANG Chunyan, TAN Xinghe, XIONG Xingyao, et al. Analysis of degradation products of rapeseed straw irradiated with 60Co-γ[J]. Journal of Hunan Agricultural University (Natural Sciences), 2017, 43(1): 92-97.
[17] Liu Y, Zhou H, Wang L Y, et al. Improving Saccharomyces cerevisiae growth against lignocellulose-derived inhibitors as well as maximizing ethanol production by a combination proposal of γ-irradiation pretreatment with in situ detoxification[J]. Chemical Engineering Journal, 2016, 287: 302-312.
[18] 武小芬, 雷舒婷, 储奕, 等. 5 MeV电子加速器辐照对甲酸循环分离南荻木质纤维素的影响[J]. 辐射研究与辐射工艺学报, 2022, 40(2): 020402.
WU Xiaofen, LEI Shuting, CHU Yi, et al. Effects of 5-MeV electron accelerator irradiation on cycling separation of lignocellulose from Triarrhena lutarioriparia by formic acid[J]. Journal of Radiation Research and Radiation Processing, 2022, 40(2): 020402.
[19] Chen S F, Mowery R A, Castleberry V A, et al. High-performance liquid chromatography method for simultaneous determination of aliphatic acid, aromatic acid and neutral degradation products in biomass pretreatment hydrolysates[J]. Journal of Chromatography A, 2006, 1104(1/2): 54-61.
[20] 武小芬, 陈亮, 齐慧, 等. 辐照协同甲酸分离油茶壳中纤维素、木质素和木糖的工艺研究[J]. 核农学报, 2020, 34(9): 1975-1982.
WU Xiaofen, CHEN Liang, QI Hui, et al. Separation process of cellulose, lignin and xylose from camellia oleifera shell by irradiation and formic acid[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(9): 1975-1982.
[21] Wu X F, Chen L, He W Q, et al. Characterize the physicochemical structure and enzymatic efficiency of agricultural residues exposed to γ-irradiation pretreatment[J]. Industrial Crops and Products, 2020, 150: 112228.
[22] 陈亮, 武小芬, 陈静萍, 等. γ射线辐照降解微晶纤维素的研究[J]. 核农学报, 2016, 30(9): 1731-1737.
CHEN Liang, WU Xiaofen, CHEN Jingping, et al. Study on the degradation of microcrystalline cellulose irradiated by γ rays[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(9): 1731-1737.
[23] . 武小芬, 陈亮, 陈静萍, 等 γ射线辐照降解木聚糖的机理研究[J]. 核农学报, 2017, 31(5): 889-898.
WU Xiaofen, CHEN Liang, CHEN Jingping, et al. Study on the degradation mechanism of xylose by gamma rays irradiation[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(5): 889-898.
[24] Wu X F, Chen L, Chen J P, et al. The effect of 60Co γ-irradiation on the structure and thermostability of alkaline lignin and its irradiation derived degradation products[J]. Waste and Biomass Valorization, 2019, 10(10): 3025-3035.
[25] Zhang C Y, Su X J, Hu Q L, et al. Effect of 60Co-γ irradiation on the microstructure and enzymatic hydrolysis of rapeseed straw[J]. Cellulose Chemistry and Technology, 2016, 50(9/10): 973-981.
[26] Lee B M, Jeun J P, Kang P H. Enhanced enzymatic hydrolysis of kenaf core using irradiation and dilute acid[J]. Radiation Physics and Chemistry, 2017, 130: 216-220.
[27] Su X J, Zhang C Y, Li W J, et al. Radiation-induced structural changes of miscanthus biomass[J]. Applied Sciences, 2020, 10(3): 1130-1142.
[28] Fei X H, Jia W B, Wang J Q, et al. Study on enzymatic hydrolysis efficiency and physicochemical properties of cellulose and lignocellulose after pretreatment with electron beam irradiation[J]. International Journal of Biological Macromolecules, 2020, 145: 733-739.
[29] Climent Barba F, Rodríguez-Jasso R M, R K Sukumaran, et al. High-solids loading processing for an integrated lignocellulosic biorefinery: effects of transport phenomena and rheology―a review[J]. Bioresource Technology, 2022, 351: 127044.
[30] Saravanakumar T, Park H S, Mo A Y, et al. Detoxification of furanic and phenolic lignocellulose derived inhibitors of yeast using laccase immobilized on bacterial cellulosic nanofibers[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 134: 196-205.
[31] 张勇, 郭栋豪, 王克勤, 等. γ射线辐照预处理玉米秸秆发酵产乙醇的研究[J]. 中国酿造, 2018, 37(9): 58-61.
ZHANG Yong, GUO Donghao, WANG Keqin, et al. Fermentation for ethanol production with γ ray irradiation-pretreated corn straw[J]. China Brewing, 2018, 37(9): 58-61.
Article Outline
邓明, 陈亮, 齐慧, 刘安, 张勇, 周毅吉, 王克勤, 武小芬.



