时间延迟积分荧光显微成像平场校正技术
1 引 言
平场校正也称为响应非均匀性校正技术,是光学成像领域的一个重要研究课题,一般而言,红外成像系统和一些对成像质量要求较高的可见光系统需要进行平场校正[1-3]。高通量TDI荧光显微成像系统是一种对像质要求极为苛刻的可见光系统,其应用包括基因测序仪、切片荧光成像系统等[4-6]。高通量的实现途径是大视场和高帧频,要求全视场内响应度均匀,以实现对样本荧光能量的定量测量和分析。然而,图像传感器、光学系统等都会导致视场内的响应非均匀性,使得荧光能量分布产生异常,为了保证后续处理结果中数据的有效率和准确率,必须进行平场校正[4,7-8]。
现有的非均匀性校正算法主要针对红外成像领域,可以分为两类:一是基于场景的非均匀性校正技术,二是基于定标的非均匀性校正技术。前者校正精度低,不适用于高精度光学测量系统[8-10]。后者利用均匀校正源(或光源)进行系统成像校正,使得视场内各像素点获得几乎相同的响应度。典型的校正方法有单点校正、两点校正和多点校正[3,11]。目前,显微成像系统的校正方法仍基于传统两点校正原理,采用LED、荧光板、荧光纸和荧光膜等均匀光源对系统响应进行校正[12-13]。高通量时间延迟积分(Time Delay Integration, TDI)荧光显微成像系统基于激光诱导荧光成像原理,并且对响应均匀性的要求较高[14-15]。上述校正方法和校正源存在明显的缺陷,不适用于高通量TDI荧光显微成像系统。例如,基于LED光源的校正方案没有激光诱导荧光的成像过程,因此未考虑激光照明系统的非均匀性,也未考虑杂散光的影响,用于高通量TDI荧光显微成像系统有原理上的缺陷。荧光板、荧光纸和荧光膜等受激荧光光源也作为校正源,其原理是激光照射荧光板等激发出荧光,再由成像系统收集获得图像。其优点是对照明非均匀性进行了校正;但对于高分辨率(亚微米级)荧光成像系统而言,普通的荧光板、荧光纸和荧光膜等校准源颗粒度明显、均匀性不足且荧光易衰减。另外,因缺乏图案类目标,难以将校正源调节到物镜最佳焦面处,校正效果较差。综上,高性能、高通量的显微成像系统对响应均匀性的要求较高,并且系统基于激光诱导荧光成像原理,因此目前缺乏适用的校正源和校正方法。
为解决上述问题,本文将高通量基因测序常用的微阵列生物芯片作为标定样板,提出基于该样板的高通量TDI荧光显微成像系统校正方法。将校正参数分为高频和低频两部分,利用微阵列芯片的宏观均匀性(整体上分布均匀)计算低频非均匀性校正系数,对相机单独进行两点校正获得高频非均匀性校正系数。设计实验逐步验证并修正建立的系统响应均匀性退化数学模型,利用现有的高通量TDI荧光显微成像系统采集图像,验证本文提出的校正方法的效果,形成整套校正方案。本文提出的平场校正方法能够直接采用微阵列实现TDI荧光显微成像系统的准实时两点校正,减小相机固定图形噪声、照明系统非均匀性、成像系统非均匀性对荧光图像的影响。
2 TDI荧光显微成像系统非均匀性来源及两点校正原理
2.1 TDI荧光显微成像系统响应非均匀性来源
典型的TDI荧光显微成像系统包含APO显微物镜、激光器、滤光片、管镜、TDI相机和载物台。按照来源可将荧光显微成像系统的响应非均匀性分为三类:(1)相机自身响应非均匀性(Photo Response Nonuniformity, PRNU);(2)激光照明系统导致的照明非均匀性;(3)成像系统导致的非均匀性。相机自身的平场校正主要由相机和图像传感器厂家执行,但对于高性能相机,需要根据应用环境重新校正,一般采用两点非均匀性校正方法。照明非均匀性会受到激光光源、照明光学系统和显微物镜的共同影响,表现为生物芯片上激光照射不均匀,进而受激辐射的荧光强度不均匀,从而影响成像均匀性。成像系统包含显微物镜、管镜、滤光片和分光镜等,导致非均匀性的因素较为复杂,也需要进行校正。相机自身的非均匀性包含高频量和低频量,而激光照明、成像导致的非均匀性绝大部分为低频量。
2.2 TDI成像两点校正原理
TDI相机输出为线列,非均匀性一般表现为条纹状,对一维图像进行非均匀性校正即可,计算量及复杂度小于面阵相机。TDI成像系统的输出灰度与成像目标或均匀场景辐射亮度的关系为:
其中:为扫描方向(也称为积分方向、电荷转移方向)的像素序号,为非扫描方向的像素序号,为成像系统输出图像中点的灰度,,,分别为响应度、偏置和随机噪声,为目标或场景的辐射亮度。对扫描方向上个像素求均值,以减小随机时间噪声的影响,得到:
其中:为线列(非扫描方向)第个像素在扫描方向的灰度均值,为响应度均值,为平均偏置,为扫描方向上的像素数。校正后每个像素的响应度和偏置相等,得到的理想校正结果为:
其中:为输出图像的平均灰度,和为平均增益与偏置,为非扫描方向上的像素数。
两点校正的目的是使得各探测元(像素)的响应度一致,满足式(3)。对于高性能图像传感器而言,像素响应灰度与接收到的能量呈线性关系,即满足线性响应。因此两点校正是较为普遍、效果较好的非均匀性校正方案,需要用到两个亮度不同的均匀辐射场景,通常取亮度接近零的暗场和亮度约使得探测器灰度达到其上限50%的明场,亮度分别设为和,暗场通过光学系统封闭、暗室等方式实现,明场通过积分球、LED等光源均匀照射实现。由TDI成像系统响应公式(2),得到:
进而得到两点校正系数:
其中:和分别为明场和暗场的灰度均值。
目前,TDI荧光显微成像系统的校正方法仍基于传统两点校正原理,采用LED、荧光板、荧光纸、荧光膜等均匀光源对系统响应进行校正。
3 基于微阵列生物芯片的校正方法
3.1 TDI荧光成像系统响应均匀性退化模型
TDI荧光成像系统基于激光诱导荧光成像原理,激光经照明光学系统整形后透过物镜均匀投射到生物芯片上,生物芯片上的荧光分子受激发射荧光,荧光经物镜、管镜收集后到达相机,得到图像。根据上述过程建立生物芯片成像及光机系统响应均匀性退化模型。设未校正的暗场图像为,像素点灰度为,为简化校正过程,暗场通过多层遮光实现,相机接收到的辐亮度几乎为零。相机直接对明场采集图像,得到:
其中:偏置为,增益或响应度为。荧光显微成像系统工作在线性区,即激光能量与激发出的荧光能量呈线性关系。光源和照明光学系统导致入射到生物芯片上的激光能量不均匀,假设生物芯片上的荧光分子是均布的,那么激发出的荧光能量也会呈现非均匀性,即:
其中:为像素对应的物方(芯片)区域接收到的激光强度,为荧光分子的发光效率,为个像素对应物方区域激光强度的均值,为相应位置荧光分子发光效率的均值。加入照明非均匀性后成像系统的响应度为:
成像光学系统包括物镜、滤光片、分光镜和管镜,导致非均匀性的因素包括畸变、渐晕、离焦和装调角度误差等,表现为中心视场的响应度比边缘视场略大,其非均匀性系数用表示,那么响应方程改写为:
3.2 新校正方法的理论依据及校正源设计
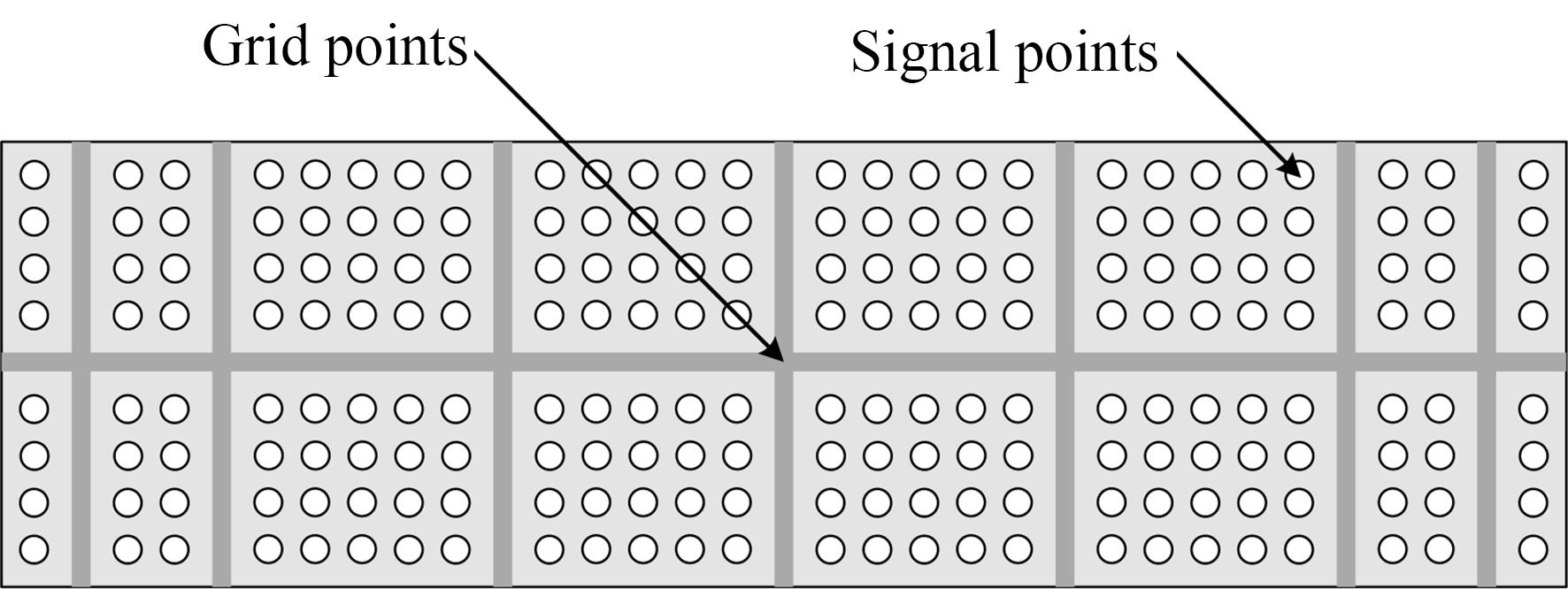
TDI荧光显微成像系统平场校正的难点是设计合适的校正源。原理上,响应度非均匀性包括高频量和低频量,相机引起的非均匀性包含高频和低频,而成像光学系统、激光照明系统引起的非均匀性绝大部分是低频量。本文将低频和高频量分步校正,采用传统的两点校正对相机自身的高频和低频非均匀性进行校正,然后设计一种微阵列生物芯片(一种基因测序使用的非均匀荧光光源)来校正残余的低频非均匀性,校正结果叠加可以实现TDI荧光成像系统的响应非均匀性校正。微阵列芯片如图1所示,以光刻方式制备网格线,位置精度优于±10 nm,网格处无荧光样本,在荧光图像中会形成暗线,作为TDI扫描方向调整的参考线。信号点能量在统计上是均匀的,采用多点累加的方式获得各位置每个信号点的灰度。中心与边缘的差异性由像差和渐晕等因素导致,可用于估算这些因素的影响,进而校正响应非均匀性。
利用信号点低频的均匀性,对微阵列生物芯片图像进行低通滤波后获取照明系统和成像系统导致的低频非均匀性,即可实现TDI荧光成像系统的低频非均匀性校正。
3.3 基于微阵列芯片的校正方法
在建立的系统响应及均匀性退化数学模型的基础上开展校正工作,实现此类特殊成像系统的平场校正。校正工作实际上是响应均匀性退化模型的逆向推演。校正步骤如下:(1)采集暗场图像,获得相机自身FPN;(2)使用积分球光源或者LED光源照射相机,获得均匀场景或者非均匀平滑场景,采集图像;(3)TDI扫描成像采集微阵列生物芯片图像;(4)经过低通滤波、归一化等处理后,平滑拟合获得低频校正系数,与相机自身校正获得的高频校正系数合并后获得综合性的增益、偏置校正系数。校正工作流程如图2所示。
微阵列生物芯片图像减暗背景,得到:
相机自身校正时,去除高频响应度非均匀性。由于此处未引入照明非均匀性和成像光学系统的影响,仅能去除非均匀性中的高频量和少量低频量。高频校正系数为:
高频校正后的微阵列图像为:
采用微阵列生物芯片成像,如图3所示。为限制照明非均匀性中的高频信息,可以使得激光照明(临界照明方式)有一定离焦。图3在扫描方向取均值,局部放大后如图4所示,对每一到两个周期进行低通滤波后,得到灰度分布的骨骼线,即为低频非均匀性分布。
滤波后得到的低频校正系数为:
其中。校正后的图像灰度分布为:
因此,校正系数为:
设为待校正的微阵列生物芯片图像,则校正方程为:
4 实 验
为验证本文提出的平场校正方法,基于某TDI荧光显微成像系统(基因测序成像系统)开展实验。实验系统的工作原理如图5所示,包括生物芯片(均布间隔为500 nm的携带荧光分子的样本点)、显微物镜(NA为1.0,视场约为2 mm)、双色分光镜(反射激光,透射荧光)、自聚焦滤光片、激发滤光片、发射滤光片(滤除激光,透过荧光)、管镜(接收荧光)和相机。采用DALSA公司的TDI相机HL-HM-16K30H-00R,工作行频为200 kHz,积分级数为128,最大分辨率为16 384 pixel。
采集暗场图像和明场图像,对相机自身的响应非均匀性进行校正,去除非均匀性中的高频量。校正装置如图6所示,采用蓝菲积分球作为明场光源,型号为USLR-L20F-NBNL,开口面均匀性优于±1%,积分球直径约为500 mm,开口尺寸约为200 nm。积分球经过照度、色温、光谱辐亮度、均匀性的校准、检测和计量。
得到的暗场图像和明场图像如图7所示,可见暗场存在明显的高频、低频DSNU(或FPN),明场体现出显著的高频响应非均匀性(PRNU)。
对微阵列芯片成像,得到图像,代入式(11)和(13)得到,在扫描方向取灰度均值,得到分布如图8所示。较窄的突变暗线为网格线,网格线越窄说明TDI方向调整越准确,边缘和中心的低频非均匀性主要由照明系统和成像系统导致。
去除网格线、低通滤波,采用样条曲线平滑拟合后得到TDI荧光成像系统的低频响应非均匀性,如图9所示。对y轴归一化后代入式(14)即可得到,进而可以计算校正系数和。校正系数可直接写入相机配置文件中,实现实时平场校正处理。对HL-HM-16K30H-00R相机进行非均匀性校正测试,不校正时其图像行输出频率为200 kHz,即每行输出时间间隔为5 μs,结果显示加入本文校正方法后仍能保证200 kHz的行输出频率,可见每行图像处理速度已足够快(行运算时间小于5 μs),即能够保证实时输出校正后的图像。
图8中的微阵列芯片中样本点之间的亮度差异性导致高频量,样本点在整体上是均匀的,因此通常可用图9中的非均匀性评估TDI荧光成像系统的响应均匀程度。校正后的图像灰度分布如图10所示,校正效果良好。
校正前后的图像如图11所示,为便于目视对比,将校正前后图像采用同样的拉伸处理后显示,可见校正后响应均匀性显著提升。
为验证算法的稳定性,获取不同生物芯片、不同强度的图像,采用两种定量评价指标表征本文校正后的明场响应非均匀性、非均匀性(Nonuniformity, NU)和均方根误差(Root-Mean-Square Error, RMSE)[16-17]:
NU和RMSE都是将图像网格线去除、扫描方向灰度均值处理后得到非扫描方向的响应非均匀性。其中,NU表示响应非均匀性的“峰谷值”评价标准,RMSE表示响应非均匀性的“均方根值”评价标准,均为常规的评价方法。NU和RMSE越小,响应均匀性越好。采集11幅图像,校正前后的非均匀性如图12~图13所示。
由实验结果可知,本文提出的校正方法使得荧光成像系统的响应非均匀性NU从25.21%降低到2.87%,RMSE从3.12%降低到0.48%,校正效果显著。该方法易于实施,广泛适用于各类高性能TDI荧光成像系统。
5 结 论
本文根据高性能TDI荧光成像系统的响应均匀性要求,提出一种基于微阵列生物芯片的平场校正方法。建立系统响应非均匀性产生模型,在此理论基础上提出将非均匀性分为高频和低频分别校正,设计了专用的微阵列芯片作为低频非均匀性校正源,将照明系统、成像光学系统和相机自身的响应非均匀性都进行了校正。实验表明,本文方法能够有效地完成TDI荧光成像非均匀性校正,响应非均匀性NU从25.21%降低到2.87%,RMSE从3.12%降低到0.48%,提高了图像质量。此外,由于微阵列芯片是基因测序领域常用的芯片,校正源易于获取,校正方法的实现较为经济、便捷。下一步工作的重点是寻求更为稳定、均匀的校正源。
[1] GUTSCHWAGER B, HOLLANDT J. Nonuniformity correction of imaging systems with a spatially nonhomogeneous radiation source[J]. Applied Optics, 2015, 54(36): 10599-10605.
[2]
[3] JIN Y, JIANG J, ZHANG G J. Three-step nonuniformity correction for a highly dynamic intensified charge-coupled device star sensor[J]. Optics Communications, 2012, 285(7): 1753-1758.
[4] ZHANG X, ZENG F, LI Y, et al. Improvement in focusing accuracy of DNA sequencing microscope with multi-position laser differential confocal autofocus method[J]. Optics Express, 2018, 26(2): 887-896.
[5] SILVESTRI L, BRIA A, SACCONI L, et al. Confocal light sheet microscopy: micron-scale neuroanatomy of the entire mouse brain[J]. Optics Express, 2012, 20(18): 20582.
[6] GONG H, XU D, YUAN J, et al. High-throughput dual-colour precision imaging for brain-wide connectome with cytoarchitectonic landmarks at the cellular level[J]. Nature Communications, 2016, 7: 12142.
[8] CAO Y P, TISSE C L. Single-image-based solution for optics temperature-dependent nonuniformity correction in an uncooled long-wave infrared camera[J]. Optics Letters, 2014, 39(3): 646.
[9] HE Z, CAO Y, DONG Y, et al. Single-image-based nonuniformity correction of uncooled long-wave infrared detectors: a deep-learning approach[J]. Applied Optics, 2018, 57(18): D155-D164.
[10] ZHOU D B, WANG D J, HUO L J, et al. Scene-based nonuniformity correction for airborne point target detection systems[J]. Optics Express, 2017, 25(13): 14210.
[11] MARCOTTE F, TREMBLAY P, FARLEY V. Infrared camera NUC calibration: comparison of advanced methods[J]. SPIE, 2014, 8706.
[14] FAN Y, NGUYEN D T, AKAY Y, et al. Engineering a brain cancer chip for high-throughput drug screening[J]. Scientific Reports, 2016, 6: 25062.
[15] ZHANG Q, YANG X, HU Q, et al. High axial resolution imaging system for large volume tissues using combination of inclined selective plane illumination and mechanical sectioning[J]. Biomedical Optics Express, 2017, 8(12): 5767-5775.
[16] SUI X B, CHEN Q, GU G H. A novel non-uniformity evaluation metric of infrared imaging system[J]. Infrared Physics & Technology, 2013, 60: 155-160.
Article Outline
常松涛, 夏豪杰. 时间延迟积分荧光显微成像平场校正技术[J]. 光学 精密工程, 2022, 30(5): 527. Songtao CHANG, Haojie XIA. Flat field correction technique for time delay integration fluorescence microscopy imaging[J]. Optics and Precision Engineering, 2022, 30(5): 527.