钼掺杂铜硅钙石的制备及其抗菌性能和细胞相容性研究
在组织修复过程中抑制组织缺损处细菌的生长可以加快修复过程[1,2]。在众多抗菌生物材料中, 无机抗菌生物材料因具有优异的稳定性、高效性、广谱性而受到了广泛关注, 其中含铜生物材料既能有效抑制大肠杆菌和金黄色葡萄球菌[3,4], 又能促进血管内皮细胞血管化[5,6,7],已经在抗细菌感染的组织修复中得到广泛研究。然而抑制细菌生长的铜离子浓度须高于6.4 μg∙mL-1[3], 而保障血管内皮细胞良好存活的铜离子浓度须在0.32~3.2 μg∙mL-1[7,8]之内, 高浓度下铜离子虽然具有抗菌活性, 但同时也具有细胞毒性。因此, 开发一种含铜生物材料在释放相同铜离子浓度下兼具优异的抗菌性能和良好的细胞相容性具有重要意义。
微量元素Mo是动物必需的微量元素, Mo进入机体后, 主要参与两个方面的物质代谢过程: 一是作为硝酸还原酶、黄嘌呤氧化酶和脱氢酶等酶的辅助因子参与许多生化反应; 二是以无机盐的形式与其他营养元素发生相互作用, 特别是与铜离子在生理环境中存在拮抗作用[9,10,11,12]。四硫代钼酸铵((NH4)2MoS4)作为铜离子螯合剂, 能够和铜离子以及细胞内的伴铜蛋白和铜转运蛋白形成三元复合物阻止铜离子向细胞内转运, 这已在医治威尔逊氏病、恶性肿瘤、铜积累导致的肝脏和神经系统疾病中得到应用[13,14,15,16]。
基于钼铜的拮抗作用, 在含铜生物材料中掺杂钼有可能使材料在保持抗菌性能的同时, 降低其对细胞的毒性。本研究将钼离子引入含铜生物材料铜硅钙石(CaCuSi4O10, Cup)中, 评价钼离子通过拮抗效应对减弱高浓度铜离子细胞毒性的作用, 以及钼掺杂铜硅钙石(Mo-Cup)在高浓度铜离子释放下的抗菌性能和细胞相容性。
1 实验方法
1.1 实验药品
实验采用的三水合硝酸铜(Cu(NO3)2·3H2O)、四水合硝酸钙(Ca(NO3)2·4H2O)、四水合七钼酸铵((NH4)6Mo7O24·4H2O)、正硅酸乙酯((C2H5O)4Si(TEOS))、浓硝酸(HNO3)、五水合硫酸铜(CuSO4·5H2O)均为分析纯, 购自中国医药集团上海化学试剂有限公司。
1.2 材料的合成
实验采用溶胶-凝胶法制备钼掺杂铜硅钙石。将摩尔比例为1 : 0.16 : 8的(C2H5O)4Si(TEOS)、HNO3 (2 mol∙mL-1)、去离子水搅拌0.5 h制备硅溶胶。将不同含量(5%、10%)的钼源((NH4)6Mo7O24·4H2O)、铜源(Cu(NO3)2·3H2O)、钙源(Ca(NO3)2)、硅溶胶混合于烧杯中并搅拌5 h, 密封后在60 ℃陈化24 h, 120 ℃干燥48 h。随后将所得样品在1000 ℃煅烧3 h后, 采用行星球磨机球磨4 h过200目(80 μm)筛。
1.3 材料的性能表征
采用18 kW转靶X射线衍射仪(XRD)分析钼掺杂铜硅钙石粉体的物相组成; 使用场发射扫描电子显微镜(SU8200)观察粉体的微观形貌及元素分布; 利用电感耦合等离子体发射光谱仪(ICP-OES)检测粉体在细菌培养基、细胞培养液中Cu、Mo、Si离子的释放量。
1.4 抗菌实验
实验采用菌落计数法研究铜离子、铜钼离子组合及钼掺杂铜硅钙石粉体细菌培养基浸提液对金黄色葡萄球菌(Staphylococcus aureus, S.A.)的增殖抑制效果。
a)离子抗菌操作步骤: 用细菌培养基将五水合硫酸铜(CuSO4·5H2O)、四水合七钼酸铵((NH4)6Mo7O24·4H2O)配制成浓度为10 μg∙mL-1的铜离子、钼离子及铜钼离子组合溶液; 取1 mL离子溶液、1 mL细菌培养基(作为空白对照)加入0.1 mL OD (Optical density, 600 nm)值为0.01的S.A.细菌悬液共培养12 h; 将共培养后菌液用PBS缓冲溶液稀释104倍后取25 μL均匀涂于琼脂培养板上培养16 h, 拍照后统计菌落个数。每组三个平行样。
b)浸提液抗菌步骤: 以200 mg∙mL-1的比例将钼掺杂铜硅钙石粉体加入到细菌培养基中, 密封后置于37 ℃恒温摇床浸提24 h, 静置后取上清液用0.22 μm滤膜过滤后得到200 mg∙mL-1的钼掺杂铜硅钙石细菌培养基标准浸提液。再将其按需要用细菌培养基进行梯度稀释。取每种粉体细菌培养基浸提液溶液1 mL、细菌培养基1 mL (作为空白对照), 加入0.1 mL OD值为0.01的S.A.细菌悬液共培养12 h; 将共培养后菌液用PBS缓冲溶液稀释104倍后取25 μL均匀涂于琼脂培养板上培养16 h, 后续操作步骤同步骤a)。
1.5 细胞实验
实验采用人真皮成纤维细胞(Human Dermal Fibroblasts, HDFS)和人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells, HUVECs)研究铜离子、铜钼离子组合及钼掺杂铜硅钙石粉体细胞浸提液的细胞相容性。
a)含铜离子及铜钼离子组合的细胞培养液由五水合硫酸铜(CuSO4·5H2O)、四水合七钼酸铵((NH4)6Mo7O24·4H2O)和细胞培养液配制并稀释至所需浓度。
b)钼掺杂铜硅钙石细胞培养液浸提液制备过程如下: 以200 mg∙mL-1的比例将钼掺杂铜硅钙石粉体加入到相应细胞培养液中, 密封后置于37 ℃恒温摇床浸提24 h, 静置后取上清液用0.22 μm滤膜过滤后得到200 mg∙mL-1的钼掺杂铜硅钙石细胞培养液标准浸提液, 随后将标准浸提液按需要进行梯度稀释。
用不同浓度的离子溶液和钼掺杂铜硅钙石细胞浸提液将两种细胞在37 ℃, 二氧化碳(CO2)浓度为5%的细胞培养箱中培养, 隔天更换细胞培养液。在预设时间点采用Cell Counting Kit-8试剂盒对细胞活性进行检测。
所有细菌和细胞实验的各组数据均经t检验后, p<0.05和p<0.01时, 将两组数据分别看作有显著差异和极显著差异。
2 结果与讨论
2.1 钼掺杂铜硅钙石的性能表征
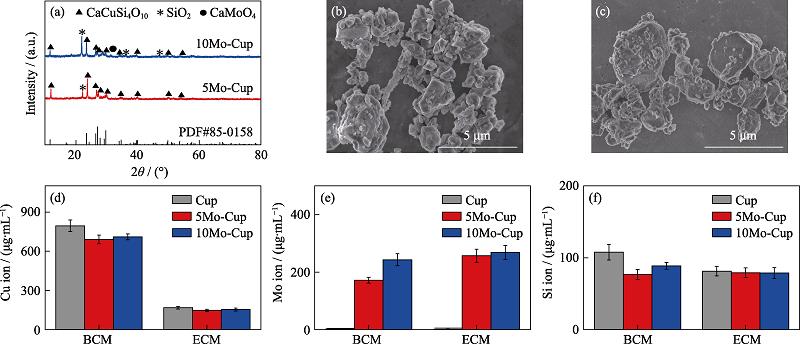
本研究系统评价了钼掺杂铜硅钙石(Mo-Cup)的物相组成、表面形貌、元素分布、离子释放。通过XRD对钼掺杂铜硅钙石的物相进行了表征。Mo-Cup大部分衍射峰均和标准卡片PDF#85-0158 (CaCuSi4O10, Cup)保持一致(图1(a)), 5%钼掺杂铜硅钙石(5Mo-Cup)和10%钼掺杂铜硅钙石(10Mo-Cup)均出现了SiO2物相, 并且随着钼元素掺入量的增加, 10Mo-Cup中出现了CaMoO4物相。使用扫描电镜对粉体的表面形貌进行了观察, 图1(b, c)分别为5Mo-Cup和10Mo-Cup粉体的微观形貌。粉体有轻微的团聚, 粒径分布在几百纳米到几微米之间。对粉体进行元素面扫描分析发现(图2), 钼掺杂铜硅钙石中的确存在钼元素, 且各元素均匀分布。

图 2. 钼掺杂铜硅钙石(a~f)5Mo-Cup和(g~l)10Mo-Cup的(a,g)SEM照片及其(b~f, h~l)元素分布图
Fig. 2. (a,g) SEM images of (a-f) 5Mo-Cup and (g-l) 10Mo-Cup and (b-f, h-l) corresponding elemental maps (b, h): Si; (c, i): Ca; (d, j): O; (e, k): Cu; (f, l): Mo
为了评价钼掺杂铜硅钙石的离子释放行为, 本研究对不同钼掺杂量铜硅钙石和铜硅钙石在细菌培养基(BCM)和细胞培养液(ECM)中铜离子、钼离子、硅离子的释放量进行了检测。硅离子和钼离子在细菌培养基和细胞培养液中释放量接近(图1(d~f)), 而铜离子在细菌培养基浸提液释放量都高于细胞培养液浸提液的释放量, 这是由于铜离子与细胞培养液缓冲体系的磷酸根存在溶解平衡, 不利于铜离子释放。综合来看, 10Mo-Cup和Cup的铜离子和硅离子释放量接近, 为了方便研究钼掺杂后对铜硅钙石抗菌性能和细胞相容性的影响, 本研究选取10Mo-Cup进行抗菌试验和细胞活力实验。
2.2 铜离子及铜钼离子组合的抗菌性能和细胞相容性
图3为不同浓度铜离子(CuSO4·5H2O溶液)和钼离子溶液((NH4)6Mo7O24·4H2O溶液)对S.A.作用后的细菌数量, 发现铜离子浓度为10和100 μg∙mL-1时铜离子溶液对S.A.的抑制率为100%, 钼离子浓度为100 μg∙mL-1时并未对金黄色葡萄球菌产生抑制作用。在铜离子和钼离子都为10或100 μg∙mL-1时其组合溶液对金黄色葡萄球菌抗菌率依然为100%, 说明钼离子不影响铜离子对金黄色葡萄球菌的抑制。

图 3. 不同浓度铜离子溶液和钼离子溶液对金黄色葡萄球菌的作用
Fig. 3. Effect of different concentrations of copper ion (CuSO4·5H2O) solution and molybdenum ion ((NH4)6Mo7O24·4H2O) solution on Staphylococcus aureus
为验证钼离子是否能够拮抗高浓度铜离子对细胞的毒性, 本研究探讨了铜离子、铜钼离子组合对人真皮成纤维细胞(HDFs)和人脐静脉内皮细胞(HUVECs)活力的影响。图4(a)为含钼离子(NH4)6Mo7O24·4H2O培养液对HDFs和HUVECs活力的影响。HDFs的存活结果显示, 2~10 μg∙mL-1浓度的钼离子的细胞活力水平与空白对照(Blank)组相当; HUVECs的存活结果显示, 培养1和3 d时, 随着钼离子浓度的增加, 钼离子对细胞活力有一定的抑制; 培养5 d时, 不同浓度钼离子的细胞活力水平与Blank组水平相当。图4(b)为含钼离子和铜离子培养液(含CuSO4·5H2O和(NH4)6Mo7O24·4H2O细胞培养液)对HDFs和HUVECs活力的影响。HDFs组的存活结果显示, 第1天, 10 μg∙mL-1的铜离子对HDFs产生一定抑制作用, 但仍能维持55% Blank组水平。加入不同浓度钼离子后, HDFs活力水平与Blank组相当, 第3天和第4天, 各组与Blank组活力水平相当。HUVECs的存活结果显示, 10 μg∙mL-1铜离子对HUVECs有明显毒性, 第3天和第5天, 该组的HUVECs存活率低于40%, 而在10 μg∙mL-1铜离子培养液中加入不同浓度钼离子后, HUVECs的存活率都有了明显提升。因此, 10 μg∙mL-1铜离子对HUVECs有明显毒性, 引入钼离子, 即使在最低浓度2 μg∙mL-1钼离子时也能够显著减弱铜离子对HUVECs的毒性。

图 4. 含10 μg∙mL-1铜离子培养液、含钼离子细胞培养液及铜钼组合培养液对细胞活力的影响
Fig. 4. Effects of culture medium containing 10 μg∙mL-1 copper ion, molybdenum ion and copper-molybdenum ions on cell activity assay
Ning等[3]报道铜离子对大肠杆菌和金黄色葡萄球菌的最小抑制浓度为6.4 μg∙mL-1, 同时Kong[7,8]报道铜离子的浓度高于3.2 μg∙mL-1 时, HUVECs的存活率会低于60%。为了探究钼离子是否能够降低在优异抗菌浓度下铜离子对HUVECs的毒性, 本研究选择略高于最小抗菌浓度(10 μg∙mL-1) 的铜离子进行抗菌和细胞活力实验。同时为了进一步观察钼离子是否会降低更高浓度铜离子的抗菌性能, 本研究还探讨了钼离子对浓度为100 μg∙mL-1的铜离子抗菌性能的影响。结果证明: 钼离子确实能够拮抗高浓度铜离子(10 μg∙mL-1)对人脐静脉内皮细胞的毒性, 同时并不影响铜离子对金黄色葡萄球菌的抗菌性能。
2.3 钼掺杂铜硅钙石的抗菌性能和细胞相容性
为了探究钼掺杂铜硅钙石(10Mo-Cup)的抗菌性能, 本研究用不同稀释倍数的10Mo-Cup细菌培养基浸提液进行了S. A.培养实验。如图5所示, 10Mo-Cup浸提液的抗菌性能随浸提液的稀释倍数增大而降低。1/80的10Mo-Cup原始细菌培养基浸提液(铜离子的浓度为8.87 μg∙mL-1, 表1)对S.A的抗菌率为90.5%。因此, 当铜离子的释放量高于8.87 μg∙mL-1时, 10Mo-Cup细菌浸提液对S.A.的抑制率高于90%。

图 5. 10Mo-Cup细菌培养基浸提液对金黄色葡萄球菌的抑制作用
Fig. 5. Inhibition effect of extract from 10Mo-Cup bacterial culture medium on Staphylococcus aureus
表 1.
不同稀释倍数10Mo-Cup细菌培养基浸提液离子浓度
Table 1. Ion contents in the extract with 10Mo-Cup bacterial culture medium after different dilutions
|
为了研究10Mo-Cup释放的铜离子对细胞的毒性, 本研究用不同稀释倍数的10Mo-Cup细胞培养液浸提液进行了HDFs和HUVECs细胞活力实验。如图6(a)所示, HDFs在1/8的10Mo-Cup原始细胞培养液浸提液及更高稀释倍数的浸提液中的存活率能达到Blank组的85%以上。如图6(b)所示, 1/8的10Mo-Cup原始细胞培养液浸提液对HUVECs有明显的毒性, 稀释至1/16时, 铜离子浓度为9.65 μg∙mL-1 (表2)及更高稀释倍数时, HUVECs存活率能达到Blank组的90%以上。因此, 当铜离子释放浓度不高于9.65 μg∙mL-1时, 10Mo-Cup细胞培养液浸提液对HUVECs有良好的细胞相容性。

图 6. 不同稀释倍数的10Mo-Cup细胞培养液浸提液对(a)HDFs和(b)HUVECs活力的影响
Fig. 6. Effects of 10Mo-Cup culture medium extracts with different concentrations on (a) HDFs and (b) HUVECs activity assay. **: p <0.01
表 2.
10Mo-Cup ECM培养基浸提液在不同稀释倍数时的离子浓度
Table 2. Ion contents in the extract with 10Mo-Cup cell culture medium after different dilutions
|
含铜生物材料的抗菌性能与铜离子的释放量呈正相关关系, 对大肠杆菌和金黄色葡萄球菌产生明显抑制作用时, 最低铜离子浓度分别在7和11 μg∙mL-1[6,17]。而含铜生物材料的细胞相容性随材料铜离子的释放量增加而变弱[18,19], HUVECs在铜离子高于3.2 μg∙mL-1时存活率低于60%[7]。因此, 在保证含铜生物材料抗菌性能的同时, 很难避免其对HUVECs的毒性。由于铜钼离子的拮抗作用能降低高浓度铜离子对细胞的毒性, 使得本研究制备的10Mo-Cup在高铜离子浓度(8.87~9.65 μg∙mL-1)释放下, 既能够对金黄色葡萄球菌有90%以上的抑制效果, 又能保证HUVECs存活率在90%以上。
3 结论
通过对铜钼离子组合溶液以及钼掺杂铜硅钙石(10Mo-Cup)的抗菌性能和细胞相容性的研究得到如下结论:
1)当铜钼离子组合溶液作用金黄色葡萄球菌和HUVECs时, 钼离子能够明显降低高浓度铜离子对HUVECs的毒性, 并且不影响铜离子的抗菌性能。
2)采用溶胶凝胶法成功制备了Mo-Cup, 通过掺杂方式将钼元素引入到含铜生物材料中。
3) 10Mo-Cup的铜离子释放浓度在8.87~ 9.65 μg∙mL-1高浓度范围时, 对金黄色葡萄球菌抑制率达到90%以上, 且对HUVECs没有毒性。
因此, 钼掺杂能够有效降低含铜生物材料的高浓度铜离子对HUVECs的毒性而不影响其抗菌性能, 为制备兼具优异抗菌性能和良好生物相容性的含铜生物材料提供了新的路径。
[1] LI P L, HAN F X, CAO W W, et al. Carbon quantum dots derived from lysine and arginine simultaneously scavenge bacteria and promote tissue repair[J]. Applied Materials Today, 2020, 6(19): 100601.
[7] 孔妮. 掺铜硅酸钙生物陶瓷的制备与表征及其促血管化性能的研究[J]. 上海: 上海交通大学硕士学位论文, 2015.
[9] YANG Z J, LONG T, RAN L W, et al. Molybdenum's biological function and roles in animal production[J]. Journal of Henan University of Science and Technology (Agricultrual Science), 2004(2): 40-43.
[10] WU M J. Molybdenum and human health[J]. Studies of Trace Elements and Health, 2006, 5(23): 66-67.
[11] WANG Q X. Trace element molybdenum and human health[J]. Studies of Trace Elements and Health, 2003, 4(20): 58-59.
[12] LIU M. The effect of molybdenum on human health[J]. China Molybdenum Industry, 2001, 5(25): 43-45.
[13] 田瑶. 四硫代钼酸铵抑制顺铂与人铜伴侣蛋白Atoxl的相互作用[J]. 合肥: 中国科学技术大学硕士学位论文, 2018.
[15] PAN Q, KLEER C G, VAN GOLEN K L, et al. Copper deficiency induced by tetrathiomolybdate suppresses tumor growth and angiogenesis[J]. Cancer Research, 2002, 62(17): 4854-4859.
[17] MIAO Z Z, LI G W, LIU C Z, et al. Study on antibacterial properties of copper-loaded chitosan particles[J]. Journal of Henan Institute of Science and Technology, 2010, 38(2): 78-80.
[18] XU Q, CHANG M L, ZHANG Y, et al. PDA/Cu bioactive hydrogel with "hot ions effect" for inhibition of drug-resistant bacteria and enhancement of infectious skin wound healing[J]. ACS Applied Materials & Interfaces, 2020, 12(28): 31255-31269.
Article Outline
王恩典, 常江. 钼掺杂铜硅钙石的制备及其抗菌性能和细胞相容性研究[J]. 无机材料学报, 2021, 36(7): 738. Endian WANG, Jiang CHANG.